Contingut no disponible en valencià
El Decreto de la Presidencia del Gobierno número 2484/1967, de 21 de septiembre («Boletín Oficial del Estado» del 17 al 23 de octubre), que aprueba el Código Alimentario Español, prevé que puedan ser objeto de Reglamentaciones Especiales las materias en él reguladas.
Las ordenes de 31 de enero de 1977 («Boletín Oficial del Estado» de 14 a 27 de julio); 31 de julio de 1979 («Boletín Oficial del Estado» de 29 y 30 de agosto); 17 de septiembre de 1981 («Boletín Oficial del Estado» de 14 de octubre); 1 de diciembre de 1981 («Boletín Oficial del Estado» de 20 de enero de 1982), y 26 de enero de 1989 («Boletín Oficial del Estado» de 4 de febrero), establecieron diversos métodos oficiales de análisis de leche y productos lácteos, siendo necesario complementarlos con otros nuevos que atiendan al control de las mezclas de leches citadas anteriormente.
El presente Real Decreto se dicta en virtud de lo dispuesto en el artículo 149.1.16.ª de la Constitución Española, en cuanto atribuye al Estado la competencia exclusiva sobre las bases y coordinación general de la sanidad.
En su virtud a propuesta de los Ministros de Sanidad y Consumo, de Industria, Comercio y Turismo y de Agricultura, Pesca y Alimentación, oídos los sectores afectados, previo informe preceptivo de la Comisión Interministerial para la Ordenación Alimentaria, de acuerdo con el Consejo de Estado y previa deliberación del Consejo de Ministros en su reunión del día 18 de octubre de 1991,
DISPONGO:
Se aprueban como oficiales los métodos de análisis de leche y productos lácteos que se detallan en el anexo.
Para la detección de la presencia de leche de vaca en mezclas con leche de oveja y leche de cabra, en productos procedentes de otros Estados miembros se reconocen como métodos de control equivalentes los legalmente establecidos en los mismos hasta tanto se apruebe un método único de referencia aplicable en la Comunidad Económica Europea.
El presente Real Decreto se dicta al amparo de lo dispuesto en el artículo 149.1.16.ª de la Constitución Española.
Quedan derogadas las disposiciones de igual o inferior rango en lo que se opongan al presente Real Decreto.
Dado en Madrid a 18 de octubre de 1991.
JUAN CARLOS R.
El Ministro de Relaciones con las Cortes y de la Presidencia del Gobierno,
VIRGILIO ZAPATERO GÓMEZ
ÍNDICE
Leche
21. Detección de leche de vaca en mezclas con leche de oveja y cabra.
22. Sangre soluble.
23 (a) Determinación de leche de vaca en leche de oveja o de cabra (por electroforesis).
23 (b) Determinación de leche de vaca en leche de oveja o de cabra (por inmunodifusión radial).
24 (a) Determinación de leche de cabra en leche de oveja (por electroforesis).
24 (a) Determinación de leche de cabra en leche de oveja (por inmunodifusión radial).
Mantequilla
10. Extracción de la grasa.
Queso
7. Nitratos y nitritos.
8. Determinación de leche de vaca en queso de oveja o de cabra (por electroforesis).
9. Determinación de leche de cabra en queso de oveja (por electroforesis).
21. DETECCIÓN DE LECHE DE VACA EN MEZCLAS CON LECHE DE OVEJA Y CABRA
21.1 Principio.
Se puede detectar la leche de vaca en mezclas con leche de oveja o cabra mediante extracciones de la caseína y posterior separación por electroforesis en gel de poliacrilamida.
La caseínas as1 de leche de vaca presenta una mayor movilidad electroforética que las caseínas as de leches de oveja o cabra.
21.2 Material y aparatos.
21.2.1 Centrífuga.
21.2.2 Equipo de electroforesis.
21.2.3 Fuente de alimentación.
21.2.4 Tubos para electroforesis de 11 cm de longitud y 0,7 cm de diámetro.
21.2.5 pH-metro.
21.2.6 Material de uso corriente en el laboratorio de pipetas, tubos, micropipetas, etcétera.
21.3 Reactivos.
21.3.1 Solución de ácido acético 1N.
21.3.2 Solución de hidróxido sódico 1N.
21.3.3 Solución de urea 7M.
21.3.4 Solución A. Tampón pH 8,9. Disolver 48 ml de HC1 1N, 36,3 g de Trishidroximetilaminometano y 0,46 ml de Temed en agua hasta 100 ml.
21.3.5 Solución B de acrilamida. Disolver 60 g de acrilamida y 1,6 g de NN’ Metilenbisacrilamida (Bis) en agua hasta 200 ml.
21.3.6 Solución tampón para depósitos de los electrodos pH 8,4. Disolver 0,60 g de Trishidroximetilaminometano y 2,88 g de glicina en agua hasta 100 ml. Se puede preparar un tampón concentrado 10 veces y guardar en nevera diluyéndolo en el momento de su utilización.
21.3.7 Solución de persulfato amónio. Disolver 0,56 g de persulfato amónico en agua hasta 100 ml. Este reactivo debe prepararse nuevo cada semana.
21.3.8 Solución de tinción. Disolver 0,56 g de Negro de Amido en una mezcla de 250 ml de metanol, 650 ml de agua y 100 ml de ácido acético glacial.
21.3.9 Solución de lavado. Mezclar 400 ml de metanol, 50 ml de ácido glacial y 550 ml de agua.
21.3.10 Solución de azul de bromofenol. Disolver 1 mg de azul de bromofenol en 100 ml de agua.
21.4 Procedimiento.
21.4.1 Preparación de la muestra:
Diluir la leche, previamente desnatada por centrifugación, a 1/5 con agua destilada. Calentar a 35° C y llevar a pH 4,6 mediante adición de ácido acético 1N. Separar la caseína precipitada por centrifugación y lavar varias veces con agua destilada. Disolver la caseína en un volumen de agua igual a la mitad del volumen de la leche original, añadiendo solución de hidróxido sódico 1N hasta pH7.
Inmediatamente antes de la electroforesis, disolver un volumen igual de urea 7M. preparada recientemente. Para la electroforesis es suficiente aplicar de 100 a 200 ug de caseína disuelta.
21.4.2 Preparación del gel:
Mezclar 5 ml de solución A (21.3.4), 10 ml de solución B (21.3.5) y 11,5 g de urea en una probeta de 50 ml. Añadir agua con agitación hasta 35 ml de disolución. Desairear mediante vacío y añadir 5 ml de la solución de persulfato. Agitar la solución e inmeditamente llenar con la misma los tubos (previamente tapados por su parte inferior) hasta 1 cm del extremo superior, evitando la formación de burbujas de aire.
Completar el llenado de los tubos con una pequeña cantidad de agua que asegura la superficie plana del gel, a la vez que evita la posible inhibición de la polimerización por el oxígeno atmosférico.
La polimerización tiene lugar en veinte-treinta minutos.
21.4.3 Electroforesis:
Colocar los geles, una vez polimerizados y después de eliminar el agua, en los módulos del aparato de electroforesis en posición vertical y llenar las dos cámaras de los electrodos con el tampón pH 8,4.
Aplicar con micropipeta en la superficie del gel una cantidad de la solución de caseína en urea que contenga de 100 a 200 ug de caseína. Añadir una gota de azul de bromofenol y completar el llenado de los tubos con una pequeña cantidad de tampón.
Utilizar el depósito superior como cátodo y el interior como ánodo.
Conectar la corriente y aplicar una intensidad constante de 1 mA por tubo durante 1,5 a dos horas (hasta que el azul de bromofenol llegue al extremo del gel).
21.4.4 Separación, teñido y desteñido de los geles:
Para desprender el gel del tubo de vidrio se puede utilizar una jeringa con una aguja sin punta, colocándola entre el gel y el tubo. Inyectar agua a presión y rotar el tubo, con lo que entra ésta y se desprende el gel.
Una vez desprendido, colocar cada gel en un tubo con solución colorante de Negro de Amido durante una hora.
Elimar la solución de teñido y añadir solución de lavado, que debe renovar hasta que se observe las bandas de nitidez.
Los geles se pueden conservar durante meses en solución de ácido acético al 7 por 100.
21.5.1 Identificación de las bandas:
El diagrama electroforético de las caseínas de leche de oveja contiene dos grupos de bandas de proteínas.
El primer grupo, de dos bandas, corresponde a las β caseínas, y el segundo, consistente en tres bandas, a las as caseínas, que se designan como as1, as2 y as3.
La leche de vaca se puede detectar en mezclas con leche de oveja o cabra, debido a la mayor migración electroforética de la caseína as, de vaca, que se hace visible por encima de las bandas de caseína de oveja o cabra.
La intensidad de la banda as1 de vaca aumenta cuando es mayor el porcentaje de mezcla.
21.5.2 Determinación cuantitativa:
La determinación cuantitativa de la proporción de leche de vaca añadida a la leche de oveja o cabra se puede realizar por el análisis densitométrico de las bandas obtenidas en las electroforesis, midiendo en la mezcla el contenido de caseína as1 de leche de vaca y comparando este valor con el contenido medio de caseína as de leche de vaca pura.
Es necesario efectuar una curva patrón.
21.5.3 Límite de detección:
La técnica descrita permite detectar un 2% de leche de vaca en leche de oveja o en leche de cabra.
21.6 Observaciones.
21.6.1 La electroforesis en gel de acrilamida se puede efectuar también en un equipo para electroforesis en gel plano.
21.6.2 Todas las soluciones se deben preparar con agua destilada reciente o hervida, ya que el oxígeno inhibe la polimerización y se pueden formar burbujas en el gel.
21.6.3 Todas las soluciones se deben almacenar en botellas oscuras en el frigorífico.
21.6.4 La acrilamida es neurotóxica, por lo que se debe manejar con cuidado.
21.7 Bibliografía.
21.7.1 Pierre, A., y Portmann, A., 1970. Ann Teechnol. Ag. 19, 107-130.
21.7.2. Ramos, j.; Martínez-Castro, I., y Juárez, M. 1977. J. of Dairy Sci. 60, 870-877.
21.7.3 Adroid, P. (1968) «Separation of milk proteins», en Smith «Chromatographic and electrophoretic tecniques». Vol. II, pág. 399. William Heineimann Medical Books, Ltd. London.
22. SANGRE SOLUBLE
22.1 Principio.
Disolución de la hemoglobina en una mezcla acético-agua y posterior determinación de su absorbencia a 396 nanómetros.
Este método es aplicable a muestras de leche o suero de leche en polvo que contengan menos del 5 por 100 de grasa.
22.2 Material y aparatos.
22.2.1 Espectrofotómetro y accesorios (cubeta para 1 cm de espesor de líquido).
22.2.2 Agitador electromagnético.
22.2.3 Centrífuga y tubos de 10 ml.
22.3 Reactivos.
22.3.1 Mecla ácido acético-agua (1:1) VN.
22.4 Procedimiento.
Pesar con precisión de 0,001 g, 10 g de leche o suero de leche en polvo e introducir en un vaso de precipitados de 250 ml. Añadir 150 ml de agua destilada previamente calentada a 40°-50° C y agitar hasta que se forme una emulsión; a continuación, trasvasar esta emulsión a un matraz aforado de 250 ml, lavar el vaso repetidas veces con agua destilada, enfriar y enrasar a 250 ml. Tomar 20 ml de la emulsión y verter en un matraz aforado de 100 ml, enrasar con la mezcla de acético glacial-agua destilada. Si la solución resulta turbia, centrifugar 10 ml durante 15 minutos a unas 5.700 revoluciones; retirar a continuación con ayuda de una espátula la película sobrenadante; filtrar el centrifugado y repetir las operaciones si es necesario de forma que la solución quede finalmente transparente. A continuación medir la absorbancia en cubeta de 1 cm a 396 nm, usando como blanco la solución acético-agua.
22.5 Cálculos.
El porcentaje de sangre soluble se deduce por aplicación de la siguiente fórmula:
Siendo:
S = Porcentaje de sangre soluble presente en la muestra.
A = Absorbancia leída de la muestra.
P = Peso en gramos de la leche o suero de leche en polvo.
= Absorbancia específica de la sangre.
22.6 Observaciones.
22.6.1 En el caso de dispoper de la harina de sangre utilizada como desnaturalizante, el valor de se obtendrá como se indica a continuación:
Pesar con precisión de 0,0001 g, 100 mg de harina de sangre, e introducirla en un vaso de precipitado de 250 ml. Añadir 150 ml de agua destilada, agitar durante cinco minutos la solución, transferir a un matraz aforado de 250 ml. A continuación, tomar 20 ml de esta solución, llevar a un matraz aforado de 100 ml y enrasar con la mezcla de ácido acético glacial-agua. Centrifugar 10 ml de esta solución y medir su absorbancia en cubeta de 1 cm a 396 nanómetros usando como blanco la solución acético-agua.
Siendo:
= Absorbancia específica.
A = Absorbancia leída.
P = Peso en gramos de la harina de sangre.
La absorbancia específica no deberá ser inferior a 50. En caso contrario, la harina de sangre no debe ser utilizada como desnaturalizante.
22.6.2 Si no se ha podido determinar este valor previamente a la adición de la harina de sangre a la leche o suero se tomará como valor medio de referencia = 52,4.
23(A) DETERMINACIÓN DE LECHE DE VACA EN LECHE DE OVEJA O DE CABRA (MÉTODO ELECTROFORÉTICO)
23(a)1. Principio.
La fracción sérica de la muestra se extrae por adición de solución tampón a pH 4,6 y posterior centrifugación.
Las proteínas de suero son separadas por electroforesis en gel de poliacrilamida a pH 8,3.
Las β lactoglobulinas de leche de vaca presentan una mayor movilidad electroforética que las α lactoalbúminas y las β lactoglobulinas de la leche de ovjea y de la leche de cabra.
El método es aplicable a la leche cruda o pasterizada a una temperatura máxima de 90° C, durante treinta segundos, fresca o conservada mediante congelación o adición de dicromato potásico.
23(a)2. Material y aparatos.
23(a)2.1 Material de uso corriente en laboratorio.
23(a)2.2 Microjeringa.
23(a)2.3 pH metro.
23(a)2.4 Centrífuga.
23(a)2.5 Equipo de electroforesis.
23(a)2.6 Fuente de alimentación.
23(a)2.7 Densitómetro.
23(a)3. Reactivos.
23(a)3.1 Reactivos para la obtención de la fracción serica.
23(a)3.1.1 Solución de Ácido Acético al 10%.
23(a)3.1.2 Solución de Acetado Sódico 1N.
23(a)3.2 Reactivos para la electroforesis. 23(a)
3.2.1 Tampón de los geles pH 8,9.
– Trishidroximetil aminometano: 46 g.
– Ácido Clorhídrico concentrado: 4 ml.
– Agua destilada: Hasta 1.000 ml.
23(a)3.2.2 Solución de Acrilamida Bisacrilamida (T = 9,4%; c = 4,2).
– Acrilamida: 9 g.
– N N’ Metilenbisacrilamida: 0,4 g.
– Tampón de los geles: 100 ml.
23(a)3.2.3 Tampón de los electrodos pH 8,3.
– Trishidroximetil aminometano: 1,2 g.
– Glicina: 5,8 g.
– Agua destilada: Hasta 2.000 ml.
23(a)3.2.4 Solución de Persulfato amónico al 10% (este reactivo debe prepararse cada semana).
23(a)3.2.5 NNN’N’ Tetrametiletilendiamina (TEMED).
23(a)3.2.6 Solución de azul de bromofenol al 1/1.000.
23(a)3.2.7 Solución de Glicerol al 40%.
23(a)3.3 Reactivos para la tinción.
23(a)3.3.1 Tinción con azul Coomassie R-250.
23(a)3.3.1.1 Solución fijadora.
– Ácido Sulfosalicílico: 17,3 g.
– Ácido Tricloroacético: 57,5 g.
– Agua destilada: Hasta 500 ml.
23(a)3.3.1.2 Solución decolorante.
– Etanol: 500 ml.
– Ácido Acético glacial: 160 ml.
– Agua destilada: Hasta 2.000 ml.
23(a)3.3.1.3 Solución de tinción.
– Azul Coomassie Brillante R-250: 0,46 g.
– Solución decolorante [23(a)3.3.1.2]: 40 ml.
23(a)3.3.2 Tinción con azul Coomassie G-250.
23(a)3.3.2.1 Solución única de fijación y tinción.
– Azul Coomassie G-250: 1 g.
– Agua destilada: 500 ml.
– Solución de Ácido Sulfúrico 2 N: 500 ml.
– Solución de hidróxido potásico 10 N.
– Ácido Tricloroacético.
Disolver el azul de Coomassie G-250 en agua destilada y añadir la solución de Ácido Sulfúrico 2 N. Mezclar bien agitando durante una hora y filtrar por papel Whatman número 1. Medir el volumen de filtrado y añadir 1/9 de este volumen de la solución de hidróxido potásico 10 N. Añadir Ácido Tricloroacético a esta disolución hasta que la concentración final sea de 12%. Esta solución de teñido es estable durante varios meses si el pH se mantiene por debajo de 1. Se puede utilizar varias veces pero es conveniente filtrarla antes de cada uso.
23(a)4. Procedimiento.
23(a)4.1 Obtención de la fracción soluble a pH 4,6.
Añadir a 10 ml de leche, 5 ml de solución de Ácido Acético al 10% [23(a)3.1.1] y 5 ml de solución de Acetato Sódico 1 N [23(a)3.1.2], mezclar y comprobar con pH metro que el pH de la mezcla es exactamente 4,6. Centrifugar a 3.000 r.p.m. durante diez minutos y filtrar el sobrenadante a través de un papel de filtro de velocidad media.
23(a)4.2 Preparación de la curva patrón.
Dependiendo del tipo de muestra que se desee analizar, preparar patrones puros de leche de oveja o de leche de cabra y de leche de vaca y mezclas de leche de vaca en leche de oveja o de leche de vaca en leche de cabra en concentraciones del 5%, 10% y 20%. La leche utilizada para la preparación de estos patrones podrá ser cruda o pasterizada, en este último caso la leche deberá ser pasterizada a una temperatura máxima de L 74° C durante un tiempo máximo de treinta segundos.
La fracción soluble de los patrones se obtiene siguiendo el procedimiento descrito en 23(a)4.1.
23(a)4.3 Inmediatamente antes de su aplicación en el gel mezclar:
– 1 Volumen de la fracción soluble obtenida según [23(a)4.1].
– 1 Volumen de la solución de glicerol al 40% [23(a)3.2.7].
– ½ Volumen de la solución azul de Bromofenol al 1/1.000 [23(a)3.2.6].
23(a)4.4 Preparación del Gel de Poliacrilamida.
Preparar el gel laminar de espesor comprendido entre 0,5 mm y 1 mm. Para 50 ml de la solución de acrilamida-bisacrilamida, añadir 0,5 ml de solución de persulfato amónico al 10% [23(a)3.2.4], desairear en un Kitasato mediante vacío y añadir como agente polimerizante 50 ml de TEMED [23(a)3.2.5].
23(a)4.5 Electroforesis.
Colocar el gel en el aparato de electroforesis y llenar las cámaras de los electrodos con el tampón pH 8,3 [23(a)3.2.4].
Aplicar con microjeringa en cada uno de los pocillos del gel un volumen comprendido entre 10 µl y 20 µl de las soluciones obtenidas según 23(a)4.3, tanto de la muestra como de los patrones.
La electroforesis se realiza a 60 mA (220 V) dejando correr el frente hasta que la línea del azul de bromofenol esté a 0,5 mm del extremo inferior del gel. La duración es aproximadamente de tres horas.
23(a)4.6 Métodos de tinción.
23(a)4.6.1 Tinción con azul Coomassie R-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución fijadora [23(a)3.3.1.1]: Una hora.
2.° La solución decolorante [23(a)3.3.1.2]: Diez minutos.
3.° La solución de tinción [23(a)3.3.1.3]: Doce horas.
4.° La solución decolorante [23(a)3.3.1.2], que se renovará con frecuencia, hasta eliminar el fondo.
23(a)4.6.2 Tinción con azul Coomassie G-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución de fijación/tinción [23(a)3.3.2.1]: Doce horas.
2.° Agua destilada que se renovará con frecuencia: Una hora.
25(a)5 Interpretación de resultados.
23(a)5.1 Identificación de las bandas.
En el diagrama se observa el orden de las bandas de las proteínas de menor a mayor movilidad electroforética en cada una de las especies.
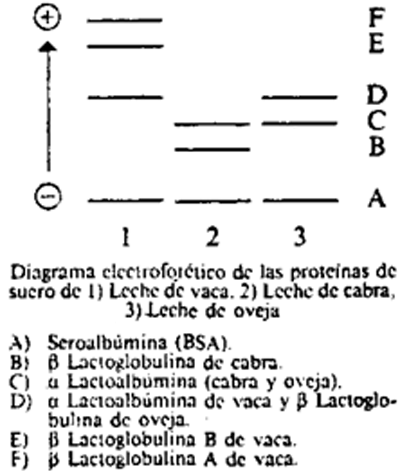
23(a)5.2 Densitometría.
Medir la intensidad de las bandas con densitómetro a una longitud de onda de 560 nm si se utiliza Coomassie R-250 en la tinción y de 600 nm si se utiliza el método del Coomassie G-250.
23(a)5.3 Cuantificación.
Como se puede observar en el diagrama, las β lactoglobulinas A y B en leche de vaca presentan una mayor movilidad electroforética que las de las otras dos especies. Al aumentar el porcentaje de leche de vaca presente en la muestra, aumenta la intensidad de las bandas correspondientes a dichas β lactoglobulinas y por tanto aumenta la altura de los picos obtenidos en el desintograma.
Medir las alturas de los picos de las β lactoglobulinas A y B de leche de vaca y del pico de la seroalbumina (BSA). A partir de los datos obtenidos para los patrones, resulta la recta de regresión y = ax + b, donde
El porcentaje de leche de vaca en la muestra se determina sustituyendo en la recta de regresión calculada con los patrones, el valor
obtenido para la muestra.
23(a)6. Expresión de resultados.
Expresar el contenido en leche de vaca según los siguientes intervalos:
– Menor del 5 por 100.
– Entre el 5 y el 10 por 100.
– Entre el 10 y el 20 por 100.
– Mayor del 20 por 100.
Siendo el límite de detección práctico del 2 por 100 de leche de vaca, en leche de oveja o en leche de cabra.
23(a)7. Observaciones.
Un resultado negativo debe obligatoriamente ser confirmado por la técnica electroforética de las caseínas (21. Detección de leche de vaca en mezclas con leche de oveja y cabra).
23(a)8. Referencias.
23(a)8.1 Ramos, M.; Juárez, M. (1986): «Chromatographie, electrophoretic and immunological methods for detecting mixtures of milks from different species». Bulletin of International Dairy Federation numero 202, paginas 175-187.
23(a)8.2 Amigo, L.; Santamaría, G.; González del Llano, D.; Ramos, M. (1986): «Polyacrilamide gel electrophoresis of whey proteins in cheeses made from milk of different species. Milk the vital force», XII Internat. Dairy Congress, The Hague, 152.
23(a)8.3 Amigo, L.; Calvo, M.; Ramos, M. (1987): «Quantitative determination cow’s milk in goat’s and ewe’s milk by PAGE using a internal standard». II Congreso Mundial de Tecnología de Alimentos, Barcelona, 151.
23(a)8.4 Calvo, M. M.; Amigo, L.; Olano Martín, P. J.; Ramos, M. (1989): «Effect of thermal treatments on the determination of bovine milk added to ovine or caprine milk». Food Chemistry 32 (99-108).
23(B) DETERMINACIÓN DE LECHE DE VACA EN LECHE DE OVEJA O DE CABRA (MÉTODO INMUNOLÓGICO)
23(b)1 Principio.
El método está basado en la precipitación de las inmunoglobilinas de la leche de vaca por la acción de un antisuero específico.
La muestra es depositada en los pocillos practicados en una capa de agar que contiene el antisuero específico de la leche de vaca.
Cuando la muestra contiene leche de vaca se produce una reacción que se observa en forma de halo alrededor del picollo donde se había depositado dicha muestra. El diámetro de este halo es proporcional a la concentración.
El método es aplicable a la leche cruda o pasterizada a una temperatura máxima de 74° C durante un tiempo máximo de treinta segundos, fresca o conservada mediante congelación o adición de dicromato potásico.
23(b)2 Material y aparatos.
23(b)2.1 Material de uso corriente en laboratorio.
23(b)2.2 Centrífuga.
23(b)2.3 Microjeringa.
23(b)2.4 Placas Petri preparadas con agar conteniendo el antisuero específico de leche de vaca. En la capa de agar se han practicado 10 pocillos cilíndricos.
23(b)2.5 Estufa regulada a 37º C.
23(b)2.6 Agitador magnético o equivalente.
23(b)2.7 Dispositivo de lectura: Lupa equipada con micrómetro o un retroproyector. En su defecto se puede utilizar un doble decímetro graduado al medio milímetro.
23(b)3 Reactivos.
23(b)3.1 Cuajo de título 1/10.000.
23(b)3.2 Solución de Cloruro Sódico al 9/1.000.
23(b)3.3 Solución acuosa de glicerol al 5% (V/V).
23(b)3.4 Solución acuosa de Ácido Acético al 2% (V/V).
23(b)3.5 Solución de tinción.
– Negro amido: 1 gr.
– Solución acuosa de Ácido Acético al 2% (V/V): 1.000 ml.
23(b)3.6 Solución acética de glicerol:
– Glicerol: 5 ml.
– Ácido Acétido glacial: 2 m.
– Agua destilada: Hasta 100 ml.
23(b)4 Procedimiento.
23(b)4.1 Obtención de la fracción sérica.
Añadir a 10 ml de leche una gota de cuajo de título 1/10.000 [23(b)3.1], mezclar, incubar a 37° C durante cinco a diez minutos y centrifugar a 3.000 r.p.m. durante diez minutos. Tomar con cuidado el lactosuero evitando arrastrar materia grasa.
23(b)4.2 Preparación de la curva patrón.
Preparar mezclas de leche de vaca en leche de oveja o en leche de cabra a concentraciones del 2%, 5%, 10% y 20%.
La fracción sérica de los patrones se obtiene siguiendo el procedimiento descrito en 23(b)4.1.
23(b)4.3 Inmunodifusión.
Depositar con la ayuda de una microjeringa, 10 ml de la fracción sérica preparada según 23(b)4.1 de cada uno de los patrones y de la muestra a analizar en los pocillos de una misma placa. Dejar difundir de doce a veinticuatro horas a 37º C en una cámara húmeda (estufa hermética regulada a 37º C en cuyo fondo se coloca un pliego de papel de filtro humedecido con agua).
Para una valoración rápida, transcurrido este tiempo, se puede proceder a la lectura según 23(b)4.5.
23(b)4.4 Tratamiento de la placa.
Lavar la placa dentro de la solución de Cloruro Sódco al 9/1.000 [23(b)3.2) bajo agitación durante ocho a doce horas.
Llenar la placa con la solución acuosa de glicerol al 5% V/V [23(b)3.3] y mantenerla llena diez minutos. Depositar en la superficie de la solución un disco de papel de filtro del mismo diámetro que el de la placa, dejándolo deslizar hasta el fondo. Mantener el disco de papel de filtro contra el agar mientras se elimina la solución de glicerol. Verificar que no haya presencia de burbujas de aire.
Dejar secar veinticuatro horas o acelerar el proceso con la ayuda de un secador de aire, manteniendo la distancia que permita no sobrepasar los 45° C a 50° C al nivel de la placa.
Cuando la placa esté perfectamente seca, recubrirla con agua durante algunos minutos para permitir que el papel de filtro se despegue progresivamente. Una vez despegado retirarlo con unas pinzas.
Teñir, durante quince minutos, con la solución de tinción 23(b)3.5.
Lavar, durante unos minutos cada vez, tres o cuatro veces, con la solución de Ácido Acético al 2% [23(b)3.4] para eliminar el fondo.
Enjuagar durante cinco minutos en la solución acética de glicerol [23(b)3.6]. Vaciar y dejar secar.
23(b)4.5 Lectura de los resultados.
Medir los diámetros de los halos con la ayuda de un doble decímetro graduado al medio milímetro o mejor con una lupa equipada con micrómetro o con un retroproyector.
23(b)5 Interpretación de resultados.
23(b)5.1 Curva de calibrado.
En un papel milimetrado trazar la curva, llevando en ordenadas los diámetros de los halos obtenidos con las mezclas preparadas para la curva patrón y en abscisas las raíces cuadradas de las concentraciones en leche de vaca.
23(b)5.2 Determinación del porcentaje de leche de vaca en la muestra.
Llevar sobre la curva de calibrado el diámetro medido para la muestra. Elevar al cuadrado el dato obtenido para expresar el resultado en porcentaje de leche de vaca.
23(b)5.3 Límite de detección.
La técnica descrita permite detectar un 1% de leche de vaca en leche de oveja o en leche de cabra.
23(b)6 Observaciones.
23(b)6.1 Una reacción negativa debe obligatoriamente ser confirmada por la técnica electroforética de las caseínas (21.Detección de leche de vaca en mezclas con leche de oveja y cabra).
23(b)6.2 En el caso de una reacción positiva, se tendrá en cuenta que el resultado obtenido puede ser inferior al valor real, dado el efecto de un tratamiento térmico efectuado en condiciones de temperatura y/o de tiempo superiores a los fijados en 23(b)1.
23(b)7 Referencia.
23(b)7.1 Journal Officiel de la Republique Française (1 de junio de 1978).
24(a) DETERMINACIÓN DE LECHE DE CABRA EN LECHE DE OVEJA (MÉTODO ELECTROFORÉTICO)
24(a).1 Principio.
La fracción sérica de la muestra se extrae por adición de solución tampón a pH 4,6 y posterior centrifugación.
Las proteínas de suero son separadas por electroforesis en gel de poliacrilamida a pH 8,3.
La β lactoglobulina de leche de cabra presenta una menor movilidad electroforética que la α lactoalbúmina y la β lactoglobulina de la leche de oveja.
24(a).2 Material y aparatos.
24(a).2.1 Material de uso corriente en laboratorio.
24(a).2.2 Microjeringa.
24(a).2.3 pH metro.
24(a).2.4 Centrífuga.
24(a).2.5 Equipo de electroforesis.
24(a).2.6 Fuente de alimentación.
24(a).2.7 Densitómetro.
24(a).3 Reactivos.
24(a).3.1 Reactivos para la obtención de la fracción sérica:
24(a).3.1.1 Solución de Ácido Acético al 10 por 100.
24(a).3.1.2 Solución de Acetato Sódico 1N.
24(a).3.2 Reactivos para la electroforesis.
24(a).3.2.1 Tampón de los geles pH 8,9:
– Trishidroximetil aminometano: 46 g.
– Ácido Clorhídrico concentrado: 4 ml.
– Agua destilada: Hasta 1.000 ml.
24(a).3.2.2 Solución de Acrilamida Bisacrilamida:
(T = 9,4%; C = 4,2)
– Acrilamida: 9 g.
– N N’ Metilenbisacrilamida: 0,4 g.
– Tampón de los geles: 100 ml.
24(a).3.2.3 Tampón de los electrodos pH 8,3:
– Trishidroximetil aminometano: 1,2 g.
– Glicina: 5,8 g.
– Agua destilada: Hasta 2.000 ml.
24(a).3.2.4 Solución de Persulfato amónico al 10% (este reactivo debe preprarse cada semana).
24(a).3.2.5 NNN’N’ Tetrametiletilendiamina (TEMED).
24(a).3.2.6 Solución de azul de bromofenol al 1/1.000.
24(a).3.2.7 Solución de Glicerol al 40%.
24(a).3.3 Reactivos para la tinción:
24(a).3.3.1 Tinción con Azul Coomassie R-250.
24(a).3.3.1.1 Solución fijadora:
– Ácido Sulfosalicílico: 17,3 g.
– Ácido Tricloroacético: 57,5 g.
– Agua destilada: Hasta 500 ml.
24(a).3.3.1.2 Solución decolorante:
– Etanol: 500 ml.
– Ácido Acético glacial: 160 ml.
– Agua destilada: Hasta 2.000 ml.
24(a).3.3.1.3 Solución de tinción:
– Azul Coomassie Brillante R-250: 0,46 g.
– Solución decolorante [24(a).3.3.1.2]: 400 ml.
24(a).3.3.2 Tinción con Azul Coomassie G-250:
24(a).3.3.2.1 Solución única de fijación y tinción:
– Azul Coomassie G-250: 1 g.
– Agua destilada: 500 ml.
– Solución de Ácido Sulfúrico 2N: 500 ml.
– Solución de Hidróxido Potásico 10N.
– Ácido Tricoloracético.
Disolver el azul de Coomassie G-250 en agua destilada y añadir la solución de Ácido Sulfúrico 2 N. Mezclar bien agitando durante una hora y filtrar por papel Whatman número 1. Medir el volumen de filtrado y añadi 1/9 de este volumen de la solución de hidróxido potásico 10 N. Añadir Ácido Tricloroacético a esta disolución hasta que la concentración final sea del 12%. Esta solución de teñido es estable durante varios meses si el pH se mantiene por debajo de 1. Se puede utilizar varias veces pero es conveniente filtrarla antes de cada uso,
24(a).4 Procedimiento.
24(a).4.1 Obtención de la fracción soluble pH 4,6.
Añadir a 10 ml de leche, 5 ml de solución de Ácido Acético al 10% [24(a).3.1.1] y 5 ml de solución de Acetato Sódico 1N [24(a).3.1.2], mezclar y comprobar con pH metro que el pH de la mezcla es exactamente 4,6. Centriguar a 3.000 r.p.m. durante 10 minutos y filtrar el sobrenadante a través de un papel de filtro de velocidad media.
24(a).4.2 Preparación de la curva patrón.
Preparar patrones puros de leche de oveja y de leche de cabra y mezclas de leche de cabra en leche de oveja en concentraciones del 5%, 10% y 20%. La leche utilizada para la preparación de estos patrones podrá ser cruda o pasterizada, en este último caso la leche deberá ser pasterizada a una temperatura máxima de 74° C durante un tiempo máximo 30 segundos.
La fracción soluble de los patrones se obtiene siguiendo el procedimiento descrito en 24(a).4.1.
24(a).4.3 Inmediatamente antes de su aplicación en el gel mezclar:
– 1 Volumen de la fracción soluble obtenida según 24(a).4.1.
– 1 Volumen de solución de glicerol al 40% [24(a).3.2.7].
– ½ Volumen de solución Azul de Bromofenol al 1/1.000 [24(a).3.2.6].
24(a).4.4 Preparación del Gel de Poliacrilamida.
Preparar el gel laminar de espesor comprendido entre 0,5 mm y 1 mm. Para 50 ml de la solución de acrilamida-bisacrilamida, añadir 0,5 ml de solución de persulfato amónico al 10% [24(a).3.2.4], desairear en un Kitasato mediante vacío y añair como agente polimerizante 50µl de TEMED [24(a).3.2.5].
24(a).4.5 Electroforesis.
Colocar el gel en el aparato de electroforesis y llenar las cámaras de los electrodos con el tampón pH 8,3 [24(a).3.2.3].
Aplicar con microjeringa en cada uno de los pocillos del gel un volumen comprendido entre 10 µl y 20 µl de las soluciones obtenidas según 24(a).4.3, tanto de la muestra como de los patrones.
La electroforesis se realiza a 60 mA (220 V) dejando correr el frente hasta que la línea de azul de bromofenol esté a 0,5 ml del extremo inferior del gel. La duración es aproximadamente de tres horas.
24(a).4.6 Métodos de tinción.
24(a).4.6.1 Tinción con azul Coomassie R-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución fijadora 24(a).3.3.1.1: Una hora.
2.° La solución decolorante 24(a).3.3.1.2: Diez minutos.
3.° La solución de tinción 24(a).3.3.1.3: Doce horas.
4.° La solución decolorante 24(a).3.3.1.2, que se renovará con frecuencia, hasta eliminar el fondo.
24(a).4.6.2 Tinción con azul Coomassie G-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución de fijación/tinción 24(a)3.3.2.1: Doce horas.
2.° Agua destilada, que se renovará con frecuencia: Una hora.
24(a)5. Interpretación de resultados.
24(a)5.1 Identificación de las bandas.
En el diagrama se observa el orden de las bandas de las proteínas de menor a mayor movilidad electroforética en la leche de cabra y en la leche de oveja.
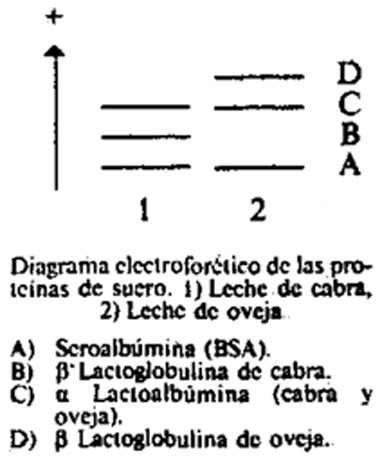
24(a)5.2 Densitometría.
Medir la intensidad de las bandas con densitómetro a una longitud de onda da de 560 nm si se utiliza Coomassie R-250 en la tinción de 600 nm si se utiliza el método del Coomassie G-250.
24(a)5.3 Cuantificación.
Como se puede observar en el diagrama, la β lactoglobulina de leche de cabra presenta una menor movilidad electroforética que la α lactoalbúmina y la β lactoglobulina de oveja. Al aumentar el porcentaje de leche de cabra presente en la muestra, aumenta la intensidad de la banda correspondiente a la β lactoglobulina de la leche de cabra y, por tanto, aumenta la altura del pico obtenido en el densitograma.
Medir la altura del pico de la β lactoglobulina de leche de cabra y del pico de la seroalbumina (BSA). A partir de los datos obtenidos para los patrones, resulta la recta de regresión y = ax + b, donde
El porcentaje de leche de cabra en la muestra se determina sustituyendo en la recta de regresión calculada con los patrones, el valor
obtenido para la muestra.
24(a)6 Expresión de resultados.
Expresar el contenido en leche de cabra según los siguientes intervalos:
– Menor del 5 por 100.
– Entre el 5 y el 10 por 100.
– Entre el 10 y el 20 por 100.
– Mayor del 20 por 100.
Siendo el límite de detección práctico del 2 por 100 de leche de cabra en leche de oveja.
24(a)7 Referencias.
24(a)7.1 Ramos, M.; Juárez, M. (1986): «Chromatographie, electrophoretic and immunological methods for detecting mixtures of milks from different species».
24(a)7.2 Amigo, L.; Santamaría, G.; González del Llano, D.; Ramos, M. (1986): «Polyacrilamide gel electrophoresis of whey proteins in cheeses mede from milk of different species. Milk the vital force», XII Internat. Dairy Congress, The Hague, 152.
24(a)7.3 Amigo, L.; Calvo, M.; Ramos, M. (1987): «Quantitative determination cow’s milk in goat’s and ewe’s milk by PAGE using a internal standard». II Congreso Mundial de Tecnología de Alimentos, Barcelona, 151.
24(a)7.4 Calvo, M. M.; Amigo, L.; Olano A.; Martín, P. J.; Ramos, M. (1989): «Effect of thermal treatments on the determination of bovine milk added to ovine or caprine milk». Food Chemistry 32 (99-108).
24(B) DETERMINACIÓN DE LECHE DE CABRA EN LECHE DE OVEJA (MÉTODO INMUNOLÓGICO)
24(b)1 Principio.
El método está basado en la precipitación de las inmunoglobulinas de la leche de cabra por la acción de un antisuero específico.
La muestra es depositada en los pocillos practicados en una capa de agar que contiene el antisuero específico de la leche de cabra.
Cuando la muestra contiene leche de cabra se produce una reacción que se observa en forma de halo alrededor del pocillo donde se había depositado dicha muestra. El diámetro de este halo es proporcional a la concentración de leche de cabra.
El método es aplicable a la leche cruda o pasterizada a una temperatura máxima de 74° C durante un tiempo máximo de treinta segundos, fresca o conservada mediante congelación o adición de dicromato potásico.
24(b)2 Material y aparatos.
24(b)2.1 Material de uso corriente en laboratorio.
24(b)2.2 Centrífuga.
24(b)2.3 Microjeringa.
24(b)2.4 Placas Petri preparadas con agar conteniendo el antisuero específico de leche de cabra. En la capa de agar se han practicado 10 pocillos cilíndricos.
24(b)2.5 Estufa regulada a 37º C.
24(b)2.6 Agitador magnético o equivalente.
24(b)2.7 Dispositivo de lectura: Lupa equipada con micrómetro o un retroproyector. En su defecto se puede utilizar un doble decímetro graduado al medio milímetro.
24(b)3 Reactivos.
24(b)3.1 Cuajo de título 1/10.000.
24(b)3.2 Solución de cloruro sódico a 9/1.000.
24(b)3.3 Solución acuosa de glicerol al 5% (V/V).
24(b)3.4 Solución acuosa de ácido acético al 2% (V/V).
24(b)3.5 Solución de tinción:
– Negro amido: 1 g.
– Solución acuosa de ácido acético al 2% (V/V): 1.000 ml [24(b)3.4].
24(b)3.6 Solución acética de glicerol:
– Glicerol: 5 ml.
– Ácido Acético glacial: 2 ml.
– Agua destilada: Hasta 100 ml.
24(b)4 Procedimiento.
24(b)4.1 Obtención de la fracción sérica.
Añadir a 10 ml de leche, una gota de cuajo de título 1/10.000 [24(b)3.1], mezclar, incubar a 37º C durante cinco a diez minutos y centrifugar a 3.000 r.p.m. durante diez minutos. Tomar con cuidado el lactosuero evitando arrastrar materia grasa.
24(b)4.2 Preparación de la curva patrón.
Preparar mezclas de leche de cabra en leche de oveja en concentraciones del 2%, 5%, 10% y 20%.
La fracción sérica de los patrones se obtiene siguiendo el procedimiento descrito en 24(b)4.1.
24(b)4.3 Inmunodifusión.
Depositar con la ayuda de una microjeringa, 10 µl de la fracción sérica preparada según 24(b)4.1 de cada uno de los patrones y de la muestra a analizar en los pocillos de una misma placa. Dejar difundir de doce a veinticuatro horas a 37º C en una cámara húmeda (estufa hermética regulada a 37º C en cuyo fondo se coloca un pliego de papel de filtro humedecido con agua).
24(b)4.4 Tratamiento de la placa.
Lavar la placa dentro de la solución de cloruro sódico al 9/1.000 [24(b)3.2] bajo agitación durante ocho a doce horas.
Llenar la placa con la solución acuosa de glicerol al 5% V/V [24(b)3.3] y mantenerla llena diez minutos. Depositar en la superficie de la solución un disco de papel de filtro del mismo diámetro que el de la placa, dejándolo deslizar hasta el fondo. Mantener el disco de papel de filtro contra el agar mientras se elimina la solución de glicerol. Verificar que no haya presencia de burbujas de aire.
Dejar secar veinticuatro horas o acelerar el proceso con la ayuda de un secador de aire, manteniendo la distancia que permita no sobrepasar los 45° C a 50° C al nivel de la placa.
Cuando la placa esté perfectamente seca, recubrirla con agua durante algunos minutos para permitir que el papel de filtro se despegue progresivamente. Una vez despegado retirarlo con unas pinzas.
Teñir, durante quince minutos, con la solución de tinción 24(b)3.5.
Lavar, durante unos minutos cada vez, tres o cuatro veces, con la solución de Ácido Acético al 2% [24(b)3.4] para eliminar el fondo.
Enjuagar durante cinco minutos en la solución acética de glicerol [24(b)3.6]. Vaciar y dejar secar.
24(b)4.5 Lectura de los resultados.
Medir los diámetros de los halos con la ayuda de un doble decímetro graduado al medio milímetro o mejor con una lupa equipada con micrómetro o con un retroproyector.
24(b)5 Interpretación de los resultados.
24(b)5.1 Curva de calibrado.
En un papel milimetrado trazar la curva, llevando en ordenadas los diámetros de los halos obtenidos con las mezclas preparadas para la curva patrón y en abscisas las raíces cuadradas de las concentraciones en leche de cabra.
24(b)5.2 Determinación del porcentaje de leche de cabra en la muestra.
Llevar sobre la curva de calibrado el diámetro medido para la muestra. Elevar al cuadrado el dato obtenido para expresar el resultado en porcentaje de leche de cabra.
24(b)5.3 Límite de detección.
La técnica descrita permite detectar un 1% de leche de cabra en leche de oveja.
24(b)6 Observaciones.
24(b)6.1 Una reacción negativa debe obligatoriamente ser confirmada por la técnica electroforética de las proteínas del suero [24(a). Determinación de leche de cabra en leche de oveja (Método Electroforético)].
24(b)6.2 En el caso de una reacción positiva, se tendrá en cuenta que el resultado obtenido puede ser inferior al valor real, dado el efecto de un trataminto térmico efectuado en condiciones de temperatura y/o de tiempo superiores a los fijados en 24(b)1.
24(b)7 Referencia.
Journal Officiel de la Republique Française (1 de junio de 1978).
10. EXTRACCIÓN DE LA GRASA EN MANTEQUILLA
10.1 Principio.
Separación de las fases acuosa y grasa mediante fusión, decantación y filtración.
10.2 Material y aparatos.
10.2.1 Estufa de desecación.
10.3 Procedimiento.
Tomar aproximadamente 50 g de la muestra de mantequilla en una cápsula de porcelana e introducirla en una estufa de desecación a una temperatura entre 45° C y 50° C hasta separación de las fases acuosa y grasa. Separar la capa grasa por decantación y filtrar a través de papel de filtro seco, evitando que pase la fase acuosa, manteniendo una temperatura de unos 40° C.
10.4 Referencias.
1. Norma Internacional FIL-IDF 32: 1965.
7. NITRATOS Y NITRITOS EN QUESOS
7.1 Principio.
Tratamiento de la muestra con agua caliente, precipitación de la grasa y proteína y filtración.
Reducción en una porción del filtrado del nitrato a nitrito, por medio de una columna de cadmio.
Desarrollo de una reacción coloreada en alícuotas del filtrado no reducida, por adición de sulfanilamida y cloruro de N-1 naftiletilendiamina. Medición de la absorbancia de la solución obtenida a 538 nm.
7.2 Material y aparatos.
7.2.1 Aparato apropiado para triturar la muestra.
7.2.2 Mezclador-homogeneizador con recipiente de vidrio de 250 y 400 ml.
7.2.3 Papel de filtro de poro medio, de 15 cm de diámetro, exento de nitratos y nitritos.
7.2.4 Columna de reducción similar a la de la figura.
7.2.5 Colorímetro fotoeléctrico o espectrofotómetro que permita lecturas a una longitud de onda de 538 nm.
7.3 Reactivos.
7.3.1 Gránulos de cadmio de diámetro aproximado 0,3 a 0,8 mm.
7.3.2 Solución de sulfato de cobre (II). Disolver 20 g de sulfato de cobre (II) pentahidratado en agua y diluir a 1.000 ml.
7.3.3 Solución tampón pH 9,6 a 9,7. Diluir 50 ml de ácido clorhídrico concentrado (d = 1,19 g/ml) con 600 ml de agua destilada. Después de mezclar añadir 140 ml de solución de amoníaco al 25% (p/p). Diluir a 1.000 ml con agua y mezclar.
Ajustar el pH a 9,6-9,7 si es necesario.
7.3.4 Ácido clorhídrico 2 N. Diluir 160 ml de ácido clorhídrico concentrado (d = 1,19 g/ml) a 1.000 ml con agua.
7.3.5 Ácido clorhídrico 0,1 N. Diluir 50 ml de la solución 7.3.4 a 1.000 ml con agua.
7.3.6 Solución de sulfato de zinc. Disolver 53,5 g de sulfato de zinc (ZNSO4.7H20) en agua y diluir a 100 ml.
7.3.7 Solución de ferrocianuro potásico. Disolver 17,2 g de ferrocianuro potásico (K4Fe (CN)6.3H20) en agua y diluir a 100 ml.
7.3.8 Solución EDTA. Disolver 33,5 g de EDTA (Na2 C10 H14 N2 08.2H20) en agua y diluir a 1.000 ml.
7.3.9 Solución de ácido clorhídrico (Sol.I). Diluir 540 ml de ácido clorhídrico concentrado (d = 1,19 g/m) a 1.000 ml con agua.
7.3.10 Solución de sulfanilamida (Sol. II). Disolver, calentando en baño de agua 0,5 g de sulfanilamida (NH2 C6 H4 SO2 NH2) en una mezcla de 75 ml de agua y 5 ml de ácido clorhídrico concentrado (d = 1,19 g/ml). Enfriar a temperatura ambiente y diluir a 100 ml con agua. Filtrar si es necesario.
7.3.11 Solución de naftiletilendiamina (Sol.III). Disolver 0,1 g de cloruro de N1 naftilendiamina (C10 H7 NHCH2. NH2. 2HCL) en agua. Diluir a 100 ml con agua. Filtrar si es necesario.
Esta solución se puede conservar hasta una semana en refrigerador en un recipiente oscuro bien cerrado.
7.3.12 Solución patrón de nitrato de sodio. Disolver en agua 0,150 g de nitrito de sodio desecado a peso constante a 110-120 °C, diluir a 1.000 ml con agua y mezclar. En el momento de su empleo diluir 10 ml de esta solución con 20 ml de solución tampón (7.3.3) y diluir a 1.000 ml con agua. 1 ml de esta solución final contiene 1,00 g de NO2.
7.3.13 Solución patrón de nitrato de potasio. Disolver en agua 1,468 g de nitrato de potasio desecado a peso constante a 110-120 °C y diluir a 1.000 ml con agua. En el momento de su empleo diluir 5 ml de la solución tampón (7.3.3) y diluir a 1.000 ml con agua. 1 ml de esta solución final contiene 4,5 g de NO3.
7.4 Procedimiento.
7.4.1 Preparación de la columna de cadmio.
7.4.1.1 Llevar los gránulos de cadmio (aproximadamente 40-60 g para cada columna) a un erlenmeyer de 250 ml. Añadir suficiente solución de ácido clorhídrico 2 N (7.3.4) para cubrir el cadmio. Agitar durante unos minutos.
Decantar la solución y lavar el cadmio en el matraz con agua hasta que esté libre de cloruros.
Añadir la solución de sulfato de cobre (II) (aproximadamente 2,5 ml por g de cadmio) y agitar durante un minuto.
Decantar la solución y lavar el cadmio cuprizado inmediatamente con agua, teniendo cuidado de que el cadmio esté cubierto con agua en todo momento. Terminar el lavado cuando el agua esté exenta de cobre precipitado.
7.4.1.2 Llenar la columna con agua (ver figura) y llevar el cadmio cuprizado a la misma, con la mínima exposición al aire. La altura del cadmio debe ser de 15 a 20 centímetros. Se debe evitar que queden atrapadas burbujas de aire entre los gránulos de cadmio y que el nivel del líquido quede por debajo de la parte superior del cadmio.
7.4.1.3 Acondicionar la columna haciendo pasar una mezcla de 750 ml de agua, 225 ml de solución patrón de nitrato de potasio (7.3.1.2), 20 ml de solución tampón (7.3.3) y 20 ml de solución EDTA (7.3.8) a un flujo no superior a 6 ml/min.
Lavar la columna con 50 ml de agua.
7.4.2 Comprobación de la capacidad de reducción de la columna.
7.4.2.1 Pipetear 20 ml de solución patrón de nitrato de potasio (7.3.1.2) y llevarlos al depósito superior de la columna. Añadir inmediatamente 5 ml de solución tampón (7.3.3). Eluir a un flujo no superior a 6 ml/min y recoger el eluido en un matraz aforado de 100 ml. Cuando el depósito se ha vaciado casi completamente, lavar las paredes del mismo con 15 ml de agua y repetir esta operación con otros 15 ml de agua. Cuando esta segunda porción de agua ha pasado a la columna, llenar completamente el depósito con agua y eluir con la máxima velocidad de flujo posible.
Cuando se hayan recogido casi 100 ml retirar el matraz, completar hasta el aforo y mezclar bien.
7.4.2.2 Pipetear 10 ml del eluido a un matraz aforado de 100 ml. Añadir agua hasta un volumen aproximado de 60 ml y proceder de la forma especificada en (7.4.8).
Si la concentración de nitrito en el eluido determinada a partir de la curva de calibración (7.4.9) está por debajo de 0,63 g de NO2 por ml (95 por 100 del valor teórico), se debe degenerar la columna, 100 por 100 del rendimiento corresponde a 0,66 g de nitritos por ml.
7.4.3 Regeneración de la columna: La columna se debe regenerar cada día después de su empleo, o más frecuentemente si se observa una pérdida de eficacia, de la siguiente manera: Añadir 5 ml de la solución EDTA (7.3.8) y 2 ml de ácido clorhídrico 0,1 N (7.3.5) a 100 ml de agua. Pasar la mezcla a través de la columna a un flujo aproximado de 10 ml/min. Cuando el depósito se ha vaciado, lavar la columna con agua, solución de HCI 0,1 N y agua sucesivamente.
Si la columna no muestra todavía una eficacia satisfactoria, repetir el procedimiento especificado en 7.4.1.3.
7.4.4 Preparación de la muestra: Antes del análisis quitar la corteza o la capa superficial, de modo que se obtenga una muestra representativa del queso tal y como se consume habitualmente. Triturar la muestra con un triturador u otro aparato apropiado y mezclar cuidadosamente, evitando las pérdidas por evaporación.
La muestra así preparada se conservará en un recipiente cerrado hasta el momento del análisis, que se realizará tan pronto como sea posible. Si el retraso es inevitable se deben tomar todas las precauciones para asegurar la conservación de la muestra y para prevenir la condensación de humedad en la superficie interior del recipiente.
7.4.5 Extracción y desproteinización: Pesar con precisión de 1 mg, 10 g de muestra y llevarlos al recipiente de vidrio del mezclador homogeneizador. Añadir gradualmente 164 ml de agua a 50-55º C. Mezclar hasta que el queso esté bien suspendido. Añadir en el siguiente orden: 6 ml de solución de sulfato de zinc (7.3.6), 6 ml de solución de ferrocianuro potásico (7.3.7) y 20 ml de solución tampón (7.3.3) a la suspensión de queso, agitando cuidadosamente después de cada adición. Después de tres minutos filtrar a través del papel de filtro, recogiendo el filtrado en un erlenmeyer de 250 ml.
Es necesario obtener un filtrado transparente. Por esta razón, en algunos quesos puede ser necesario añadir una cantidad mayor de reactivos de precipitación, disminuyendo en este caso la cantidad de agua en la misma proporción.
7.4.6 Reducción de nitrato a nitrito: Pipetear 20 ml del filtrado obtenido en el apartado anterior y operar de la misma forma que en el apartado (7.4.2.1).
7.4.7 Preparación de la solución para la determinación de nitrito en la muestra: Pipetear 20 ml del filtrado del apartado 7.4.5 en un matraz aforado de 100 ml y completar con agua. Mezclar bien.
7.4.8 Determinación colorimétrica: Pipetear alícuotas iguales dependiendo del contenido probable en nitritos, de la solución 7.4.7 y del eluido del apartado 7.4.6 en matraces aforados de 100 ml. Añadir agua hasta un volumen aproximado de 60 ml. Añadir 5 ml de solución I (7.4.9) y 5 ml de la solución II (7.3.10). Mezclar cuidadosamente y dejar reposar la solución durante cinco minutos a temperatura ambiente protegiéndola de la luz solar directa.
Añadir 2 ml de solución III. Mezclar cuidadosamente y dejar reposar cinco minutos a temperatura ambiente al abrigo de la luz solar directa. Completar hasta 100 ml con agua y mezclar bien. Medir en el plazo de quince minutos la absorbancia de la solución frente al ensayo en blanco (7.4.10) a una longitud de onda de 538 nm.
7.4.9 Curva de calibración: Pipetear 0, 2, 4, 6, 8, 10, 12, 16 y 20 ml de la solución patrón de nitrito de sodio (7.3.11.) en matraces aforados de 100 ml. Añadir agua hasta un volumen aproximado de 60 ml. Llevar a cabo el procedimiento descrito en (7.4.8). Representar las absorbancias obtenidas frente a las concentraciones de nitrito, en microgramos por mililitro.
7.4.10 Ensayo en blanco: Llevar a cabo un ensayo en blanco usando todos los reactivos, pero sustituyendo los 10 g de muestra por 4 ml de agua.
7.5 Cálculo.
7.5.1 Contenido en nitritos:
Siendo:
m = Peso en gramos de la muestra.
c1 = Concentración en microgramos de NO2 por ml, obtenidos a partir de la curva de calibración, correspondiente a la absorbancia de la solución obtenida usando el filtrado diluido (7.4.7).
V = Volumen en ml de la alícuota tomada en (7.4.8) sobre el filtrado diluido (7.4.7).
7.5.2 Contenido en nitrato:
Siendo:
m = Peso en gramos de la muestra.
c2 = Concentración en microgramos de NO2 por ml, obtenidos a partir de la curva de calibración, correspondiente a la absorbancia de la solución obtenida del eluido de la columna.
V = Volumen en ml de la alícuota tomada del eluido.
r = 100/rendimiento de la columna.
7.6 Referencias.
1. Norma Internacional L FIL-IDF 84 A: 1984.
8. DETERMINACIÓN DE LECHE DE VACA EN QUESO DE OVEJA 0 DE CABRA (MÉTODO ELECTROFORÉTICO)
8.1 Principio.
La fracción sérica de la muestra se extrae por adición de solución tampón a pH 4,6 y posterior centrifugación.
Las proteínas de suero son separadas por electroforesis en gel de poliacrilamida a pH 8,3.
Las p lactoglobulinas de leche de vaca presentan una mayor movilidad electroforética de las a lactoalbúminas y las p lactoglobulinas de la leche de oveja y de la leche de cabra.
El método es aplicable a la leche cruda o pasterizada a una temperatura máxima de 90 °C, durante treinta segundos, fresca o conservada mediante congelación o adición de dicromato potásico.
8.2 Material y aparatos.
8.2.1 Material de uso corriente en laboratorio.
8.2.2 Microjeringa.
8.2.3 pH metro.
8.2.4 Centrífuga.
8.2.5 Equipo de electroforesis.
8.2.6 Fuente de alimentación.
8.2.7 Densitómetro.
8.3 Reactivos.
8.3.1 Reactivos para la obtención de la fracción sérica.
8.3.1.1 Solución de ácido acético al 10 por 100.
8.3.1.2 Solución de acetato sódico 1 N.
8.3.2 Reactivos para la electroforesis.
8.3.2.1 Tampón de los geles pH 8,9.
– Trishidroximetil aminometano: 46 g.
– Ácido clorhídrico concentrado: 4 ml.
– Agua destilada: Hasta 1.000 ml.
8.3.2.2 Solución de acrilamida bisacrilamida (T = 9,4 por 100, C = 4,2).
– Acrilamida: 9 g.
– N N’ metilenbisacrilamida: 0,4 g.
– Tampón de los geles: 100 ml.
8.3.2.3 Tampón de los electrodos pH 8,3.
– Trisidroximetil aminometano: 1,2 g.
– Glicina: 5,8 g.
– Agua destilada: Hasta 2.000 ml.
8.3.2.4 Solución de persulfato amónico al 10 por 100 (este reactivo debe prepararse cada semana).
8.3.2.5 NNN’N’ tetrametiletilendiamina (TEMED).
8.3.2.6 Solución de azul de bromofenol al 1/1.000.
8.3.2.7 Solución de glicerol al 40 por 100.
8.3.3 Reactivos para la tinción.
8.3.3.1 Tinción con azul coomassie R-250.
8.3.3.1.1 Solución fijadora.
– Ácido sulfosalicílico: 17,3 g.
– Ácido tricloroacético: 57,5 g.
– Agua destilada: Hasta 500 ml.
8.3.3.1.2 Solución decolorante.
– Etanol: 500 ml.
– Ácido acético glacial: 160 ml.
– Agua destilada: Hasta 2.000 ml.
8.3.3.1.3 Solución de tinción.
– Azul coomassie brillante R-250: 0,46 g.
– Solución decolorante (8.3.3.1.2): 400 ml.
8.3.3.2 Tinción con azul coomassie G-250.
8.3.3.2.1 Solución única de fijación y tinción.
– Azul coomassie G-250: 1 g.
– Agua destilada: 500 ml.
– Solución de ácido sulfúrico 2 N: 500 ml.
– Solución de hidróxido potásico 10 N.
– Ácido tricloroacético.
Disolver el azul de coomassie G-250 en agua destilada y añadir la solución de ácido sulfúrico 2 N. Mezclar bien agitando durante una hora y filtrar por papel Whatman número 1. Medir el volumen de filtrado y añadir 1/9 de este volumen de la solución de hidróxido potásico 10 N. Añadir ácido tricloroacético a esta disolución hasta que la concentración final sea del 12 por 100. Esta solución de teñido es estable durante varios meses si el pH se mantiene por debajo de 1. Se puede utilizar varias veces pero es conveniente filtrarla antes de cada uso.
8.4 Procedimiento.
8.4.1 Obtención de la fracción soluble a pH 4,6.
Pesar 15 g de queso previamente triturado, añadir 5 ml de solución de ácido acético al 10 por 100 (8.3.1.1) y 5 ml de solución de acetato sódico 1 N (8.3.1.2), homogeneizar y comprobar con pH metro que el pH de la mezcla es exactamente 4,6. Centrifugar a 3.000 r.p.m. durante diez minutos y filtrar el sobrenadante a través de un papel de filtro de velocidad media.
8.4.2 Preparación de la curva patrón.
Dependiendo del tipo de muestra que se desea analizar, partir de patrones de quesos puros de oveja o de cabra y de vaca, así como patrones de quesos de mezcla de vaca en oveja o de vaca en cabra, en concentraciones del 5 por 100, 10 por 100 y 20 por 100. La leche utilizada para la fabricación de estos quesos patrón podrá ser cruda o pasteurizada, en este último caso la leche deberá ser pasteurizada a una temperatura máxima de 74 °C durante un tiempo máximo de treinta segundos.
La fracción soluble de los patrones se obtiene siguiendo el procedimiento descrito en 8.4.1.
8.4.3 Inmediatamente antes de su aplicación en gel mezclar.
– Un volumen de la fracción soluble obtenida según 8.4.1.
– Un volumen de la solución de glicerol al 40 por 100 (8.3.2.7).
– Medio volumen de la solución azul de bromofenol al 1/1.000 (8.3.2.6).
8.4.4 Preparación del gel de poliacrilamida.
Preparar el gel laminar de espesor comprendido entre 0,5 mm y 1 mm. Para 50 ml de la solución de acrilamida-bisacrilamida, añadir 0,5 ml de solución de persulfato amónico al 10 por 100 (8.3.2.4), desairear en un kitasato mediante vacío y añadir como agente polimerizante 50 ml de TEMED (8.3.2.5).
8.4.5 Electroforesis.
Colocar el gel en el aparato de electroforesis y llenar las cámaras de los electrodos con el tampón pH 8,3 (8.3.2.3).
Aplicar con microjeringa en cada uno de los pocillos del gel un volumen comprendido entre 10 µl y 20 µl de las soluciones obtenidas según 8.4.3, tanto de la muestra como de los patrones.
La electoforesis se realiza a 60 mA (220 V) dejando correr el frente hasta que la línea del azul de bromofenol esté a 0,5 mm del extremo inferior del gel. La duración es aproximadamente de tres horas.
8.4.6 Métodos de tinción.
8.4.6.1 Tinción con azul coomassie R-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución fijadora (8.3.3.1.1): Una hora.
2.° La solución decolorante (8.3.3.1.2): Diez minutos.
3.° La solución de tinción (8.3.1.3): Doce horas.
4.° La solución decolorante (8.3.3.1.2), que se renovará con frecuencia, hasta eliminar el fondo.
8.4.6.2 Tinción con azul coomassie G-250.
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución de fijación/tinción (8.3.3.2.1): Doce horas.
2.° Agua destilada, que se renovará con frecuencia: Una hora.
8.5 Interpretación de resultados.
8.5.1 Identificación de las bandas.
En el diagrama se observa el orden de las bandas de las proteínas de menor a mayor movilidad electroforética en cada una de las especies:
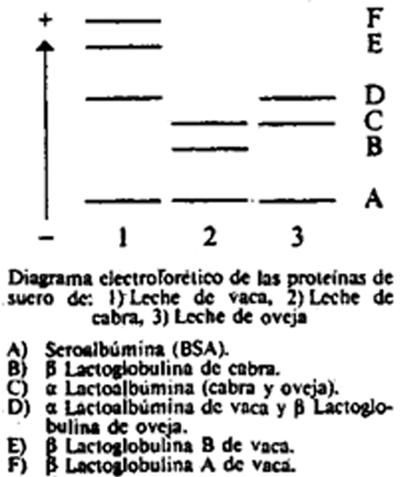
8.5.2 Densitometría.
Medir la intensidad de las bandas con densitómetro a una longitud de onda de 560 nm si se utiliza coomassie R-250 en la tinción y de 600 nm si se utiliza el método del coomassie G-250.
8.5.3 Cuantificación.
Como se puede observar en el diagrama, las β lactoglobulinas A y B en leche de vaca presentan una mayor movilidad electroforética que las de las otras dos especies. Al aumentar el porcentaje de leche de vaca presente en la muestra, aumenta la intensidad de las bandas correspondientes a dichas β lactoglobulinas y por tanto aumenta la altura de los picos obtenidos en el densitograma.
Medir las alturas de los picos de las β lactoglobulinas A y B de leche de vaca y del pico de la seroalbúmina (BSA). A partir de los datos obtenidos para los patrones, resulta la recta de regresión y = ax + b, donde
El porcentaje de leche de vaca en la muestra se determina sustituyendo en la recta de regresión calculada con los patrones, el valor
obtenido para la muestra.
8.6 Expresión de resultados.
Expresar el contenido en leche de vaca según los siguientes intervalos:
– Menor del 5 por 100.
– Entre el 5 y el 10 por 100.
– Entre el 10 y el 20 por 100.
– Mayor del 20 por 100.
Siendo el límite de detección práctico del 3 por 100 en leche de vaca, en queso de oveja o en queso de cabra.
8.7 Referencias
8.7.1 Ramos, M.; Juárez, M. (1986): «Chromatographie, electrophoretic and immunological methods for detecting mixtures of milks from different species».
8.7.2 Amigo, L.; Santamaría, G.; González del Llano, D.; Ramos, M. (1986): «Polyacrilamide gel electrophoresis of whey proteins in cheeses made from milk of different species. Milk the vital force», XII Internat. Dairy Congress, The Hague, 152.
8.7.3 Amigo, L.; Calvo, M.; Ramos, M. (1987): «Quantitative determination cow’s milk in goat’s and ewe’s milk by PAGE using a internal standard». II Congreso Mundial de Tecnología de Alimentos, Barcelona, 151.
8.7.4 Calvo, M. M.; Amigo, L.; Olano, A.; Martín, P. J.; Ramos, M. (1989): «Effect of thermal treatments on the determination of bovine milk added to ovine or caprine milk». Food Chemistry 32 (99-108).
9. DETERMINACIÓN DE LECHE DE CABRA EN QUESO DE OVEJA (MÉTODO ELECTROFORÉTICO)
9.1 Principio.
La fracción sérica de la muestra se extrae por adición de solución tampón a pH 4,6 y posterior centrifugación.
Las proteínas de suero son separadas por electroforesis en gel de poliacrilamida a pH 8,3.
La β lactoglobulina de leche de cabra presenta una menor movilidad electroforética que la α lactoalbúmina y la β lactoglobulina de la leche de oveja.
9.2 Material y aparatos.
9.2.1 Material de uso corriente en laboratorio.
9.2.2 Microjeringa.
9.2.3 pH metro.
9.2.4 Centrífuga.
9.2.5 Equipo de electroforesis.
9.2.6 Fuente de alimentación.
9.2.7 Densitómetro.
9.3 Reactivos.
9.3.1 Reactivos para la obtención de la fracción sérica.
9.3.1.1 Solución de ácido acético al 10 por 100.
9.3.1.2 Solución de acetato sódico 1 N.
9.3.2 Reactivos para la electroforesis.
9.3.2.1 Tampón de los geles pH 8,9.
– Trishidroximetil aminometano: 46 g.
– Ácido clorhídrico concentrado: 4 ml.
– Agua destilada: Hasta 1.000 ml.
9.3.2.2 Solución de acrilamida disacrilamida (T = 9,4 por 100, C = 4,2).
– Acrilamida: 9 g.
– N N’ Metilenbisacrilamida: 0,4 g.
– Tampón de los geles: 100 ml.
9.3.2.3 Tampón de los electrodos pH 8,3.
– Trishidroximetil aminometano: 1,2 g.
– Glicina: 5,8 g.
– Agua destilada: Hasta 2.000 ml.
9.3.2.4 Solución de persulfato amónico al 10 por 100 (este reactivo debe prepararse cada semana).
9.3.2.5 NNN’N’ Tetrametiletilendiamina (TEMED).
9.3.2.6 Solución de azul de bromofenol al 1/1.000.
9.3.2.7 Solución de glicerol al 40 por 100.
9.3.3 Reactivos para la tinción.
9.3.3.1 Tinción con azul coomassie R-250.
9.3.3.1.1 Solución fijadora.
– Ácido sulfosalicílico: 17,3 g.
– Ácido tricloroacético: 57,3 g.
– Agua destilada: Hasta 500 ml.
9.3.3.1.2 Solución decolorante.
– Etanol: 500 ml.
– Ácido acético glacial: 160 ml.
– Agua destilada: Hasta 2.000 ml.
9.3.3.1.3 Solución de tinción.
– Azul coomassie brillante R-250: 0,46 g.
– Solución decolorante (9.3.3.1.2): 400 ml.
9.3.3.2 Tinción con azul coomassie G-250.
9.3.3.2.1 Solución única de fijación y tinción.
– Azul coomassie G-250: 1 g.
– Agua destilada: 500 ml.
– Solución de ácido sulfúrico 2N: 500 ml.
– Solución de hidróxido potásico: 10 N.
– Ácido tricloroacético.
Disolver al azul de coomassie G-250 en agua destilada y añadir la solución del ácido sulfúrico 2N. Mezclar bien, agitando durante una hora, y filtrar por papel Whatman número 1. Medir el volumen de filtrado y añadir 1/9 de este volumen de la solución de hidróxico potásico 10 N. Añadir ácido tricloroacético a esta disolución hasta que la concentración final sea del 12 por 100. Esta solución de teñido es estable durante varios meses si el pH se mantiene por debajo de 1. Se puede utilizar varias veces pero es conveniente filtrarla antes de cada uso.
9.4 Procedimiento.
9.4.1 Obtención de la fracción soluble a pH 4,6.
Pesar 15 g de queso previamente triturado, añadir 5 ml de solución de ácido acético al 10 por 100 (9.3.1.1) y 5 ml de solución (9.3.1.2), homogeneizar y comprobar con pH metro que el pH de la mezcla es exactamente 4,6. Centrifugar a 3.000 r.p.m. durante diez minutos y filtrar el sobrante a través de un papel de filtro de velocidad media.
9.4.2 Preparación de la curva patrón.
Partir de patrones de quesos puros de oveja y de cabra, así como de patrones de quesos de mezcla de cabra en oveja, en concentraciones del 5 por 100, 10 por 100 y 20 por 100. La leche utilizada para la fabricación de estos quesos patrón podrá ser cruda o pasterizada, en este último caso la leche deberá ser pasterizada a una temperatura máxima de 74º C durante un tiempo máximo de treinta segundos.
La fracción soluble de los patrones se obtiene siguiendo el procedimiento descrito en 9.4.1.
9.4.3 Inmediatamente antes de su aplicación en el gel mezclar.
– 1 volumen de la fracción soluble obtenida según 9.4.1.
– 1 volumen de la solución de glicerol al 40 por 100 (9.3.2.7).
– ½ volumen de la solución azul de bromofenol al 1/1.000 (9.3.2.6).
9.4.4 Preparación del gel de poliacrilamida.
Preparar el gel laminar de espesor comprendido entre 0,5 mm y 1 mm. Para 50 ml de la solución de acrilamida-bisacrilamida, añadir 0,5 ml de solución de persulfato amónico al 10 por 100 (9.3.2.4), desairear en un Kitasato mediante vacío y añadir como agente polimerizante 50 de TEMED (9.3.2.5).
9.4.5. Electroforesis
Colocar el gel en el aparato de electroforesis y llenar las cámaras de los electrodos con el tampón pH 8,3 (9.3.2.3).
Aplicar con microjeringa en cada uno de los pocillos del gel un volumen comprendido entre 10 y 20 de las soluciones obtenidas según 9.4.3, tanto de la muestra como de los patrones.
La electroforesis se realiza a 60 mA (220 V) dejando correr el frente hasta que la línea de Azul de Bromofenol esté a 0,5 mm del extremo inferior del gel. La duración es aproximadamente de tres horas.
9.4.6 Métodos de tinción
9.4.6.1 Tinción con azul coomassie R-250
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución fijadora (9.3.3.1.1): Una hora.
2.° La solución decolorante (9.3.3.1.2): Diez minutos.
3.° La solución de tinción (9.3.3.1.3): Doce horas.
4.° La solución decolorante (9.3.3.1.2), que se renovará con frecuencia, hasta eliminar el fondo.
9.4.6.2 Tinción con azul coomassie G-250
Una vez completada la electroforesis, introducir el gel sucesivamente en:
1.° La solución de fijación/tinción (9.3.3.2.1): Doce horas.
2.° Agua destilada, que se renovará con frecuencia: Una hora.
9.5 Interpretación de resultados
9.5.1 Identificación de las bandas.
En el diagrama se observa el orden de las bandas de las proteínas de menor a mayor movilidad electroforética en la leche de cabra y en la leche de oveja.
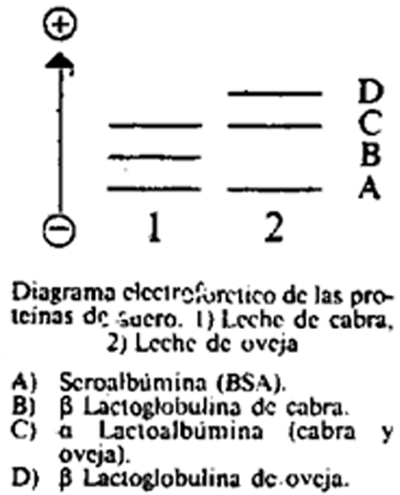
9.5.2 Densitometría.
Medir la intensidad de las bandas con densitómetro a una longitud de onda de 560 nm si se utiliza Coomassie R-250 en la tinción y de 600 nm si se utiliza el método del Coomassie G-250.
9.5.3 Cuantificación
Como se puede observar en el diagrama, la β lactoglobulina de leche de cabra presenta una menor movilidad electroforética que la α lactoalbúmina y la β lactoglobulina de oveja. Al aumentar el porcentaje de leche de cabra presente en la muestra, aumenta la intensidad de la banda correspondiente a la β lactoglobulina de la leche de cabra y, por tanto, aumenta la altura del pico obtenido en el densitograma.
Medir la altura del pico de la β lactoglobulna de leche de cabra y el pico de la seroalbúmina (BSA). A partir de los datos obtenidos para los patrones, resulta la recta de regresión y = ax + b, donde
El porcentaje de la leche de cabra en la muestra se determina sustituyendo en la recta de regresión calculada con los patrones, el valor
obtenido para la muestra.
9.6 Expresión de resultados
Expresar el contenido en leche de cabra según los siguientes intervalos:
– Menor del 5 por 100.
– Entre el 5 y el 10 por 100.
– Entre el 10 y el 20 por 100.
– Mayor del 20 por 100.
Siendo el límite de detección práctico del 3 por 100 de leche de cabra en queso de oveja.
9.7 Referencias
9.7.1 Ramos. M.; Juárez, M. (1986): «Chromatographie electrophoretic and immunological methods for detecting mixtures of milks from different species».
9.7.2 Amigo, L.; Santamaría, G.; González del Llano, D.; Ramos M. (1986): «Polyacrilamide gel electrophoresis of whey proteins in cheeses made from milk of different species. Milk the vital force», XII Internat. Dairy Congress, The Hague, 152.
9.7.3 Amigo, L.; Calvo, M.; Ramos, M. (1987): «Quantitative determination cow’s milk in goat’s and ewe’s milk by PAGE using internal standard». II Congreso Mundial de Tecnología de Alimentos Barcelona, 151.
9.7.4 Calvo, M. M.; Amigo, L.; Olano, A.; Martín, P. J.; Ramos, M. (1989): «Effect of thermal treatments on the determination of bovine milk added to ovine or caprine milk». Food Chemistry 32 (99-108).
Agència Estatal Butlletí Oficial de l'Estat
Avda. de Manoteras, 54 - 28050 Madrid