Con el fin de atender las necesidades de personal de la Administración Pública y, en cumplimiento de lo dispuesto en el Real Decreto 656/2024, de 2 de julio, por el que se aprueba la oferta de empleo público correspondiente al ejercicio 2024,
Esta Subsecretaría en uso de las competencias que le están atribuidas en el por el artículo 63 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, previo informe favorable de la Dirección General de la Función Pública, acuerda convocar el proceso selectivo para el ingreso por el sistema general de acceso libre y promoción interna en la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
Resultará de aplicación a la presente convocatoria el Libro Segundo del Real Decreto-ley 6/2023, de 19 de diciembre, por el que se aprueban medidas urgentes para la ejecución del Plan de Recuperación, Transformación y Resiliencia en materia de servicio público de justicia, función pública, régimen local y mecenazgo, el texto refundido de la Ley del Estatuto Básico del Empleado Público, aprobado por el Real Decreto Legislativo 5/2015, de 30 de octubre, la Ley 30/1984, de 2 de agosto, de Medidas para la Reforma de la Función Pública, el Reglamento General de Ingreso del personal al servicio de la Administración General del Estado y de provisión de puestos de trabajo y promoción profesional de los funcionarios civiles de la Administración General del Estado, aprobado por el Real Decreto 364/1995, de 10 de marzo, el Real Decreto 203/2021, de 30 de marzo, por el que se aprueba el Reglamento de actuación y funcionamiento del sector público por medios electrónicos, la Orden HFP/688/2017, de 20 de julio, por la que se establecen las bases comunes que regirán los procesos selectivos para el ingreso o el acceso en cuerpos o escalas de la Administración General del Estado, en todo lo que no se oponga a las anteriores normas, el Real Decreto 656/2024, de 2 de julio, por el que se aprueba la oferta de empleo público correspondiente al ejercicio 2024, la Resolución de la Secretaría de Estado de Función Pública por la que se establece un modelo común de convocatoria que regirá los procesos selectivos para el ingreso en cuerpos o escalas de la Administración General del Estado y el resto de normativa vigente en la materia, incluyendo aquellas normas especiales que resulten de aplicación y que gozarán de prevalencia respecto de la normativa general.
Asimismo, esta convocatoria tendrá en cuenta el principio de igualdad de trato entre mujeres y hombres por lo que se refiere al acceso al empleo público, de acuerdo con lo que establece el artículo 14 de la Constitución Española, la Ley Orgánica 3/2007, de 22 de marzo, para la igualdad efectiva de mujeres y hombres, así como el Acuerdo del Consejo de Ministros de 9 de diciembre de 2020, por el que se aprueba el III Plan para la igualdad de género en la Administración General del Estado y en los Organismos Públicos vinculados o dependientes de ella y, en su caso, se adecuará a lo establecido en el Acuerdo del Consejo de Ministros de 30 de noviembre de 2018, por el que se aprueban instrucciones para actualizar las convocatorias de pruebas selectivas de personal funcionario, estatutario y laboral, civil y militar, en orden a eliminar ciertas causas médicas de exclusión en el acceso al empleo público.
La presente convocatoria se desarrollará de conformidad con los siguientes apartados y anexos:
1. Publicación
1.1 La presente convocatoria, así como los actos que se deriven de su ejecución, se publicarán en el Punto de Acceso General (http://administracion.gob.es), en la página web del Ministerio de Sanidad (https://sanidad.gob.es), en el Portal del empleado público Funciona, así como en aquellos lugares que se estime conveniente.
2. Descripción de las plazas
2.1 Las plazas convocadas se ajustan a lo dispuesto en los siguientes cuadros:
Turno libre
| Acceso general | Discapacidad | Total |
|---|---|---|
| 121 | 12 | 133 |
| Año del Real Decreto | Acceso general | Discapacidad | Total |
|---|---|---|---|
| 2022 | 37 | 4 | 41 |
| 2023 | 42 | 4 | 46 |
| 2024 | 42 | 4 | 46 |
Promoción interna
| Acceso general | Discapacidad | Total |
|---|---|---|
| 35 | 2 | 37 |
| Año del Real Decreto | Acceso general | Discapacidad | Total |
|---|---|---|---|
| 2022 | 8 | 0 | 8 |
| 2023 | 13 | 1 | 14 |
| 2024 | 14 | 1 | 15 |
2.2 En concreto, se convoca proceso selectivo para cubrir 133 plazas de acceso libre, y 37 plazas por promoción interna, en la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo, código 6000S.
2.3 Del total de las plazas convocadas por el sistema de acceso libre se reservarán 12 para ser cubiertas por personas con un grado de discapacidad igual o superior al 33 por ciento.
Del total de las plazas convocadas por el sistema de promoción interna se reservarán 2 para ser cubiertas por personas con un grado de discapacidad igual o superior al 33 por ciento.
El total de las 133 plazas convocadas por el sistema de acceso libre se establecen de acuerdo:
– Al Real Decreto 407/2022 corresponden 41 plazas, de las cuales 37 son de acceso general y 4 se reservan para ser cubiertas por personas con discapacidad.
– Al Real Decreto 625/2023 corresponden 46 plazas, de las cuales 42 son de acceso general y 4 se reservan para ser cubiertas por personas con discapacidad.
– Al Real Decreto 656/2024 corresponden 46 plazas, de las cuales 42 son de acceso general y 4 se reservan para ser cubiertas por personas con discapacidad.
El total de las 37 plazas convocadas por promoción interna se establecen de acuerdo:
– Al Real Decreto 407/2022 corresponden 8 plazas de acceso general.
– Al Real Decreto 625/2023 corresponden 14 plazas, de las cuales 13 son de acceso general y 1 se reserva para ser cubierta por una persona con discapacidad.
– Al Real Decreto 656/2024 corresponden 15 plazas, de las cuales 14 son de acceso general y 1 se reserva para ser cubierta por una persona con discapacidad.
2.4 La distribución de las plazas convocadas por áreas es la siguiente:
| Áreas | Turno libre | Promoción interna | ||
|---|---|---|---|---|
| Acceso general | Discapacidad | Acceso general | Discapacidad | |
| Medicamentos biológicos. | 2 | |||
| Farmacovigilancia. | 3 | |||
| Productos sanitarios y cosméticos. | 5 | 1 | ||
| Evaluación Clínica y Preclínica de Medicamentos. | 8 | 1 | 1 | |
| Medicamentos veterinarios. | 4 | 1 | ||
| Inspección y Control de Medicamentos. | 3 | |||
| Química y Tecnología Farmacéutica. | 3 | |||
| Seguridad alimentaria y nutrición. | 15 | 1 | 1 | |
| Consumo. | 4 | 8 | ||
| Evaluación de Sustancias y Mezclas Químicas. | 11 | 1 | 8 | |
| Vigilancia en Salud Púbica, Sistemas de Información Sanitaria y Cartera Común. | 63 | 7 | 17 | 2 |
2.5 Las personas aspirantes sólo podrán participar en una de las áreas anteriores mediante uno de los dos sistemas de ingreso, bien acceso libre o bien promoción interna.
3. Requisitos de las personas aspirantes
3.1 Las personas candidatas deberán poseer en el día de finalización del plazo de presentación de solicitudes y mantener hasta el momento de la toma de posesión como personal funcionario de carrera los requisitos exigidos.
Requisitos generales de participación
3.2 Nacionalidad: Las personas aspirantes deberán tener la nacionalidad española.
También podrán participar, como personal funcionario, en igualdad de condiciones que los españoles, con excepción de aquellos empleos públicos que directa o indirectamente impliquen una participación en el ejercicio del poder público o en la salvaguardia de los intereses generales del Estado y de las Administraciones Públicas:
a. Los nacionales de los Estados Miembros de la Unión Europea.
b. El cónyuge de los españoles y de los nacionales de otros Estados miembros de la Unión Europea, cualquiera que sea su nacionalidad siempre que no estén separados de derecho. Asimismo, con las mismas condiciones, podrán participar los descendientes menores de veintiún años o mayores de dicha edad que sean dependientes.
c. Las personas incluidas en el ámbito de aplicación de los Tratados Internacionales celebrados por la Unión Europea y ratificados por España en los que sea de aplicación la libre circulación de trabajadores.
Las personas aspirantes no residentes en España incluidas en el apartado b), así como las personas extranjeras incluidas en el apartado c), deberán acompañar a su solicitud, documento que acredite las condiciones que se alegan. Todo ello en aplicación de lo dispuesto en el Real Decreto 543/2001, de 18 de mayo, sobre acceso al empleo público de la Administración General del Estado y sus Organismos públicos de nacionales de otros Estados a los que es de aplicación el derecho a la libre circulación de trabajadores.
3.3 Capacidad: Poseer la capacidad funcional para el desempeño de las tareas.
3.4 Edad: Tener cumplidos dieciséis años y no exceder, en su caso, de la edad máxima de jubilación forzosa.
3.5 Habilitación: No haber sido separado mediante expediente disciplinario del servicio de cualquiera de las Administraciones Públicas o de los Organismos Constitucionales o Estatutarios de las Comunidades Autónomas, ni hallarse en inhabilitación absoluta o especial para empleos o cargos públicos por resolución judicial, para el acceso a cuerpos o escalas de funcionarios de carrera, ni pertenecer al mismo cuerpo o escala al que se presenta. En el caso de las pruebas limitadas al acceso a una especialidad de un cuerpo o escala, no tener previamente reconocida la misma.
En caso de ser nacional de otro Estado, no hallarse inhabilitado o en situación equivalente ni haber sido sometido a sanción disciplinaria o equivalente que impida, en su Estado, en los mismos términos el acceso al empleo público.
3.6 El personal funcionario español de Organismos Internacionales podrá acceder al empleo público siempre que posea la titulación requerida y supere los correspondientes procesos selectivos.
Este personal tiene derecho a solicitar a la Comisión Permanente de Homologación la exención de la realización de pruebas encaminadas a acreditar conocimientos ya exigidos para el desempeño de sus puestos de origen. Esta petición deberá efectuarse con anterioridad al último día del plazo de presentación de solicitudes para participar en el proceso correspondiente y se acompañará de la acreditación de convocatorias, programas y pruebas superadas, así como de la correspondiente certificación expedida por el Organismo Internacional en cuestión. A estos efectos, se tendrá en cuenta lo establecido en el Real Decreto 182/1993, de 5 de febrero, sobre el acceso de funcionarios de nacionalidad española de Organismos internacionales a los cuerpos y escalas de la Administración General del Estado.
Titulación
3.7 Las personas aspirantes deberán estar en posesión o en condiciones de obtener el título de Licenciatura, Grado, Ingeniero/a o Arquitecto/a a la fecha de fin del plazo de presentación de solicitudes.
3.8 A la fecha de finalización del plazo de presentación de solicitudes, las personas aspirantes con titulaciones obtenidas en el extranjero deberán estar en posesión de la correspondiente credencial de homologación o, en su caso, del correspondiente certificado de equivalencia. Este requisito no se aplicará a aquellas personas que hubieran obtenido el reconocimiento de su cualificación profesional, en el ámbito de las profesiones reguladas, al amparo de las disposiciones de derecho de la Unión Europea.
Promoción interna
Las personas aspirantes que concurran por promoción interna deberán cumplir, además de todos los anteriores, los siguientes requisitos específicos:
3.9 Pertenecer como personal funcionario de carrera a alguno de los siguientes colectivos:
a) De los cuerpos o escalas de la Administración General del Estado del subgrupo A2.
b) De los cuerpos o escalas postales y telegráficos, adscritos al subgrupo A2.
c) De los cuerpos o escalas del subgrupo A2 de las demás Administraciones públicas incluidas en el artículo 2.1 del texto refundido de la Ley del Estatuto Básico del Empleado Público que estén desempeñando como personal funcionario de carrera un puesto de trabajo en la Administración General del Estado y hayan obtenido destino definitivo en la misma.
3.10 Pertenecer como personal laboral fijo a alguno de los siguientes colectivos:
a) Grupo profesional M3 del IV Convenio Colectivo Único para el personal laboral de la Administración General del Estado. Las personas aspirantes deberán pertenecer a una especialidad que incluya titulaciones propias del ámbito de Sanidad y Consumo.
b) Grupo profesional 1G del IV Convenio Colectivo Único para el personal laboral de la Administración General del Estado. En este grupo podrán participar aquellas personas aspirantes con especialidad en «Veterinaria» o en «Farmacia».
c) Categorías y grupos profesionales equivalentes al servicio de la Administración General del Estado, sus organismos públicos, agencias y demás entidades de derecho público con personalidad jurídica propia, vinculadas o dependientes de la Administración General del Estado.
Las funciones desempeñadas por las personas laborales fijas candidatas deberán ser análogas o coincidentes con las propias de la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
3.11 Antigüedad: haber prestado servicios efectivos, durante al menos dos años, como personal funcionario de carrera en los cuerpos o escalas del subgrupo A2 mencionados en el punto 3.9 y en los términos previstos en el mismo.
En el caso del personal laboral será requisito haber desempeñado durante al menos dos años un puesto de trabajo como personal laboral fijo en los términos del segundo párrafo del apartado 3.10 de esta convocatoria.
La acreditación de los anteriores requisitos se realizará mediante el certificado recogido en el anexo III de la convocatoria.
4. Solicitudes
Presentación por medios electrónicos
4.1 De acuerdo con el Real Decreto 203/2021, de 30 de marzo, por el que se aprueba el Reglamento de actuación y funcionamiento del sector público por medios electrónicos, las personas aspirantes deberán realizar la presentación de las solicitudes y documentación y, en su caso, la subsanación y los procedimientos de impugnación de las actuaciones de este proceso selectivo por medios electrónicos a través del servicio de Inscripción en Pruebas Selectivas (IPS) del Punto de Acceso General, de acuerdo con las instrucciones que se indican en el anexo II. Todo ello sin perjuicio de lo dispuesto en el artículo 16.4.c) de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas, para las solicitudes que se cursen desde el extranjero.
4.2 Para participar en estas pruebas selectivas se deberá cumplimentar y presentar electrónicamente la solicitud de admisión en el modelo oficial 790, en el Punto de Acceso General (https://ips.redsara.es/IPSC/secure/buscarConvocatorias). La no presentación de la solicitud en tiempo y forma supondrá la exclusión de la persona aspirante.
La presentación por esta vía permitirá:
– La inscripción en línea en el modelo oficial (obligatorio).
– Anexar documentos a la solicitud (opcional).
– El pago electrónico de las tasas, si procede (obligatorio).
– El registro electrónico de la solicitud (obligatorio).
– La modificación, durante el plazo de inscripción, de la solicitud registrada (opcional).
– La subsanación de la solicitud, en su caso, durante el plazo otorgado a estos efectos, permitiendo completar o modificar los datos relacionados con la causa de exclusión, y/o adjuntar la documentación que se requiera para legitimar la subsanación.
4.3 Los sistemas de identificación y firma admitidos para realizar la inscripción serán los que determine el servicio de IPS.
4.4 En el caso de que se produzca alguna incidencia técnica durante el proceso de inscripción deberán rellenar el siguiente formulario https://centrodeservicios.redsara.es/ayuda/consulta/IPS o dirigirse al teléfono 060.
4.5 Únicamente se tendrá en cuenta una solicitud por persona aspirante. En el supuesto de que se presentara más de una solicitud, se tendrá en cuenta a todos los efectos la última solicitud presentada.
Plazo de presentación
4.6 Las personas interesadas dispondrán de un plazo de presentación de solicitudes de veinte días hábiles contados a partir del día siguiente al de la fecha de publicación de esta convocatoria en el «Boletín Oficial del Estado». En el supuesto de que haya de subsanarse la presentación electrónica de la solicitud, se considerará como fecha de presentación de la solicitud aquella en la que haya sido realizada la subsanación.
4.7 Las personas aspirantes quedan vinculadas a los datos consignados en su solicitud registrada telemáticamente, que podrán modificar dentro del plazo establecido para la presentación de solicitudes.
4.8 Los errores de hecho, materiales o aritméticos, que pudieran advertirse en la solicitud podrán subsanarse en cualquier momento de oficio o a petición de la persona interesada.
4.9 De acuerdo con el artículo 32.4 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas, si una incidencia técnica debidamente acreditada imposibilitara el funcionamiento ordinario de los sistemas, el órgano convocante podrá acordar la ampliación del plazo de presentación de solicitudes, siempre y cuando este no hubiera vencido, debiendo publicar en la sede electrónica tanto la incidencia técnica acontecida como la ampliación concreta del plazo acordada.
Pago de las tasas
4.10 El importe de la tasa por derechos de examen será de 31,10 euros para el sistema general de acceso libre y de 15,55 euros para promoción interna. El importe reducido para familias numerosas será de 15,55 euros y de 7,78 euros respectivamente.
4.11 El pago electrónico de la tasa de derechos de examen se realizará en los términos previstos en la Orden HAC/729/2003, de 28 de marzo, por la que se establecen los supuestos y las condiciones generales para el pago por vía electrónica de las tasas que constituyen recursos de la Administración General del Estado y sus organismos públicos. La constancia del pago correcto de las tasas estará avalada por el Número de Referencia Completo (NRC) que figurará en el justificante de registro.
4.12 En el caso de que el pago de la tasa de derechos de examen se abone en el extranjero, se realizará en la cuenta corriente número código IBAN ES06-0182-2370-4902-0020-3962 (código BIC BBVAESMM) del Banco Bilbao Vizcaya Argentaria abierta a nombre de «Tesoro Público. Derechos de examen». Este sistema solo será válido para las solicitudes que sean cursadas en el extranjero.
4.13 Estarán exentas del pago de esta tasa:
a) Las personas con un grado de discapacidad igual o superior al 33 %, que deberán acompañar a la solicitud el certificado acreditativo de tal condición. No será necesario presentar este certificado cuando la condición de discapacidad haya sido reconocida en alguna de las Comunidades Autónomas que figuran en la dirección http://administracion.gob.es/PAG/PID. En este caso, y previa conformidad de la persona interesada, el órgano gestor podrá verificar esta condición mediante el acceso a la Plataforma de Intermediación de Datos de las Administraciones Públicas ofrecido a través del servicio Inscripción en Pruebas Selectivas.
b) Las personas que figurasen como demandantes de empleo durante el plazo, al menos, de un mes anterior a la fecha de publicación de la convocatoria en el «Boletín Oficial del Estado». Serán requisitos para el disfrute de la exención:
– Que, en el plazo de que se trate, no hubieran rechazado oferta de empleo adecuado ni se hubiesen negado a participar, salvo causa justificada, en acciones de promoción, formación o reconversión profesionales.
– Que carezcan de rentas superiores, en cómputo mensual, al Salario Mínimo Interprofesional.
Estos extremos deberán verificarse, en todo caso y salvo que conste oposición expresa de la persona interesada, por el órgano gestor mediante el acceso a la Plataforma de Intermediación de Datos de las Administraciones Públicas ofrecido a través del servicio Inscripción en Pruebas Selectivas.
En caso de no dar el consentimiento, la certificación relativa a la condición de demandante de empleo, con los requisitos señalados, se solicitará en la oficina de los servicios públicos de empleo.
En cuanto a la acreditación de las rentas, se realizará mediante certificado de la declaración presentada del Impuesto sobre la Renta de las Personas Físicas correspondiente al último ejercicio en el que el plazo de presentación de la declaración del Impuesto sobre la Renta de las Personas Físicas correspondiente al año 2023 o, en su caso, del certificado del nivel de renta del mismo ejercicio.
c) Las familias numerosas en los términos del artículo 12.1.c) de la Ley 40/2003, de 18 de noviembre de Protección a las Familias Numerosas. Tendrán derecho a una exención del 100 por 100 de la tasa los miembros de familias de la categoría especial y a una bonificación del 50 por 100 los que fueran de la categoría general. La condición de familia numerosa se acreditará mediante el correspondiente título actualizado.
La aportación del título de familia numerosa no será necesaria cuando el mismo haya sido obtenido en alguna de las Comunidades Autónomas que figuran en la dirección http://administracion.gob.es/PAG/PID. En este caso, y salvo que conste oposición expresa de la persona interesada, el órgano gestor podrá verificar esta condición mediante el acceso a la Plataforma de Intermediación de Datos de las Administraciones Públicas.
d) Las víctimas del terrorismo, entendiendo por tales, las personas que hayan sufrido daños físicos o psíquicos como consecuencia de la actividad terrorista y así lo acrediten mediante sentencia judicial firme o en virtud de resolución administrativa por la que se reconozca tal condición, su cónyuge o persona que haya convivido con análoga relación de afectividad, el cónyuge del fallecido y los hijos de los heridos y fallecidos.
4.14 El abono de los derechos de examen o, en su caso, la justificación de la concurrencia de alguna de las causas de exención total o parcial del mismo deberá hacerse dentro del plazo de presentación de solicitudes. La falta de justificación del abono de las tasas por derechos de examen o de encontrarse exento del pago determinará la exclusión de la persona aspirante.
4.15 En ningún caso, el pago de la tasa de los derechos de examen o la justificación de la concurrencia de alguna de las causas de exención total o parcial del mismo supondrá la sustitución del trámite de presentación, en tiempo y forma, de la solicitud de participación en el proceso selectivo.
4.16 No procederá la devolución de la tasa por derechos de examen en los supuestos de exclusión de las pruebas selectivas por causa imputable a la persona interesada ni en caso de inasistencia al ejercicio.
Protección de datos personales
4.17 El tratamiento de la información se ajustará a lo establecido en la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, y en el Reglamento (UE) 2016/679 del Parlamento Europeo y del Consejo, de 27 de abril de 2016, relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/46/CE (Reglamento general de protección de datos), así como en la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas y en la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público y demás disposiciones que resulten de aplicación.
4.18 Los datos personales recogidos en la solicitud de admisión serán tratados con la finalidad de la gestión de las pruebas selectivas y las comunicaciones necesarias para ello y del análisis y estudio de los datos relativos a estos procesos selectivos.
4.19 El nombre, apellidos y número del documento de identidad se publicarán respetando la seudoanonimización exigida en la Ley Orgánica 3/2018, de 5 de diciembre, Protección de Datos Personales y garantía de los derechos digitales.
4.20 La Subsecretaría de Sanidad es responsable del tratamiento de esos datos y publica su política de protección de datos en https://sanidad.gob.es.
4.21 Los derechos de protección de datos de los solicitantes se podrán ejercer dirigiéndose al responsable del tratamiento por vía electrónica a través de la sede electrónica señalada o presencialmente a través de la red de oficinas de asistencia en materia de registros.
4.22 En caso de incumplimiento del responsable del tratamiento, las personas interesadas podrán reclamar ante la Agencia Española de Protección de Datos (AEPD), www.aepd.es.
5. Admisión de aspirantes
5.1 Expirado el plazo de presentación de solicitudes, el órgano convocante dictará resolución, en el plazo máximo de un mes, por la que declarará aprobada la lista provisional de personas admitidas y excluidas. En dicha resolución, que se publicará en el «Boletín Oficial del Estado» y en los lugares previstos en el apartado 1.1, se indicará la relación de personas aspirantes excluidas, los lugares en los que se encuentran expuestas al público las listas completas de personas aspirantes admitidas y excluidas, así como el lugar, fecha y hora de comienzo del primer ejercicio.
5.2 Las personas aspirantes dispondrán de un plazo de diez días hábiles computados desde el día siguiente a la publicación de la resolución en el «Boletín Oficial del Estado» para subsanar, en su caso, los defectos que hubieran motivado la exclusión u omisión.
5.3 Finalizado dicho plazo, se expondrá la relación definitiva de personas admitidas y excluidas en los mismos lugares en que lo fueron las relaciones iniciales.
6. Proceso selectivo
6.1 El proceso selectivo se realizará mediante el sistema de oposición para las personas aspirantes que se presenten por el turno de acceso libre, y mediante el sistema de concurso–oposición para aquellas que lo hagan por el turno de promoción interna, con las valoraciones, ejercicios y calificaciones que se especifican en este apartado.
6.2 Este proceso incluirá la superación de un curso selectivo, cuyo contenido y desarrollo diferirá de lo valorado en las fases previas. Para la realización de este curso selectivo, las personas aspirantes que hayan superado la fase de oposición y, en su caso, la de concurso serán nombradas personal funcionario en prácticas por la autoridad convocante.
6.3 Descripción de la fase de oposición.
La fase de oposición del turno de acceso libre constará de cuatros ejercicios, mientras que la promoción interna constará de tres ejercicios. Todos los ejercicios de la fase de oposición son obligatorios y de carácter eliminatorio.
6.3.1 Primer ejercicio.
6.3.1.1 Acceso libre.
El primer ejercicio consta de un ejercicio tipo test debido a que permite una evaluación completa e integral de los conocimientos de las personas aspirantes sobre la totalidad del programa. Asimismo, es una herramienta objetiva, eficaz y eficiente que permite evaluar de forma rápida y equitativa a un elevado número de personas aspirantes.
Este ejercicio, de carácter eliminatorio, consistirá en la contestación por escrito, en un tiempo máximo de 150 minutos, de un cuestionario de 120 preguntas, más diez de reserva, con cuatro respuestas alternativas, siendo sólo una de ellas la correcta, que versará sobre el contenido de todo el temario de la oposición. Como mínimo, el 25 por ciento de las preguntas se referirán a temas de la parte primera del programa.
6.3.1.2 Promoción interna.
Las personas opositoras que se presentan por este turno están exentas de realizar este ejercicio y, por lo tanto, de la parte primera del temario.
6.3.2 Segundo ejercicio.
Se incluye en el proceso selectivo una prueba de traducción de inglés a español como forma de evaluar las competencias en el idioma de las personas aspirantes. Las funciones a desarrollar en esta Escala requieren el uso del inglés para consulta de normativas internacionales, colaboración en proyectos transnacionales, participación en foros y eventos internacionales o para relacionarse con organismos e instituciones internacionales.
Este ejercicio, de carácter eliminatorio, consistirá en una prueba de conocimiento de inglés. Para la acreditación de estos conocimientos se establecen dos modalidades excluyentes de evaluación, una presencial y, otra, sustitutiva de la anterior, mediante la cual las personas candidatas podrán acreditar su conocimiento del idioma equivalente al nivel B2 o superior, de acuerdo con el Marco Común Europeo de Referencia de las Lenguas (MCER), mediante la presentación de alguno de los títulos de inglés recogidos en el anexo V.
a) Modalidad presencial.
El ejercicio consistirá en la traducción al castellano y sin diccionario de un texto en inglés propuesto por el Tribunal. Para la realización del ejercicio las personas aspirantes dispondrán de un tiempo máximo de 45 minutos.
El Tribunal podrá estar asistido por especialistas en idioma inglés.
b) Modalidad acreditación de conocimiento de inglés mediante titulación.
Alternativamente a la modalidad anterior, las personas opositoras que así lo deseen podrán acreditar su conocimiento de inglés presentando alguno de los títulos que se incluyen en el anexo V, siempre y cuando se haya realizado el examen de acreditación en los cinco años anteriores al plazo de finalización de presentación de instancias.
Previamente a la celebración del ejercicio el Tribunal habrá de estudiar la documentación presentada por las personas aspirantes con el fin de corroborar la idoneidad de los títulos presentados, y podrá convocar a aquellas personas aspirantes que no reúnan los requisitos para que se presenten por la modalidad «Presencial».
El Tribunal cotejará la autenticidad de la documentación aportada, ante la existencia de dudas derivadas de la calidad de la copia, pudiendo requerir la documentación original acreditativa de la titulación en cualquier momento del proceso selectivo. Si no se presentara dicha documentación o de la documentación presentada se dedujera que no se está en posesión de una titulación acreditativa del nivel requerido, el Tribunal podrá convocar a la persona aspirante para que se presente por la modalidad «Presencial».
Aquellas personas aspirantes que se acojan a esta modalidad deberán indicarlo en la solicitud de inscripción, tal y como se especifica en anexo V. Una vez finalice el plazo de subsanación de solicitudes la modalidad escogida no podrá ser posteriormente modificada. El título deberá anexarse durante el plazo de presentación de solicitudes o, en caso contrario, la modalidad del ejercicio será «Presencial».
6.3.3 Tercer ejercicio.
Se incluye en el proceso selectivo una prueba de desarrollo por escrito de tres temas como forma de evaluar el conocimiento del programa además de la utilización adecuada del lenguaje, la capacidad de redacción, la claridad en la exposición de ideas y el orden lógico en la exposición de las mismas. Todas ellas, habilidades imprescindibles para un desempeño profesional de calidad.
Este ejercicio, de carácter eliminatorio, consistirá en el desarrollo por escrito, en un tiempo máximo de tres horas, de un tema elegido por la persona aspirante de entre dos extraídos al azar de la segunda parte del programa, y dos temas de entre cuatro elegidos al azar de la tercera parte del programa de cada área. Cada persona opositora procederá a la lectura pública de su ejercicio. Finalizada la exposición, el Tribunal podrá formular preguntas sobre el contenido de los temas que haya desarrollado durante un tiempo máximo de quince minutos.
6.3.4 Cuarto ejercicio.
Se incluye en el proceso selectivo una prueba de desarrollo por escrito de un supuesto práctico como forma de evaluar la capacidad de las personas aspirantes para aplicar sus conocimientos teóricos en situaciones reales. Este enfoque no solo mide el dominio del temario sino también habilidades clave como la resolución de problemas, la toma de decisiones, la gestión de recursos, la argumentación de manera coherente en contextos específicos y la originalidad en el planteamiento de la resolución del supuesto.
Este ejercicio, de carácter eliminatorio, consistirá en la resolución por escrito, durante un tiempo máximo de dos horas, de un supuesto práctico propuesto por el Tribunal sobre las materias contenidas en la parte segunda y tercera del programa. Cada persona aspirante procederá a la lectura pública de su ejercicio. Finalizada la exposición, el Tribunal podrá formular preguntas sobre el contenido del mismo durante un tiempo máximo de quince minutos.
6.4 Los ejercicios de la fase de oposición se calificarán de la siguiente forma:
Con el fin de respetar los principios de publicidad, transparencia, objetividad y seguridad jurídica que deben regir el acceso al empleo público, el Tribunal deberá calificar los ejercicios de las personas aspirantes de acuerdo con los criterios de corrección y los baremos de puntuación establecidos en esta convocatoria y conforme a lo indicado en el apartado 12.10, y deberá publicar con anterioridad a la realización de la prueba los criterios de corrección, valoración y superación de aquella que no estén expresamente establecidos en las bases de la convocatoria.
El Tribunal fijará las puntuaciones directas mínimas necesarias para superar cada uno de los ejercicios.
La puntuación directa mínima no podrá ser inferior al 30 por ciento de la puntuación máxima obtenible del ejercicio.
Las puntuaciones directas máximas obtenibles equivaldrán a las calificaciones máximas del ejercicio.
En los ejercicios de la fase de oposición las calificaciones resultarán de las puntuaciones transformadas que se derivan de los baremos establecidos por el Tribunal.
6.4.1 Primer ejercicio.
En este ejercicio se valorarán hasta un máximo de 120 preguntas, que se puntuarán de la forma siguiente:
− Cada contestación correcta valdrá 1 punto.
− Se restará 0,25 puntos por cada una de las respuestas incorrectas.
− Se dejarán de valorar las preguntas no respondidas.
− De las operaciones anteriores se obtendrá la valoración de cada persona participante en el ejercicio.
Este ejercicio se calificará de 0 a 10 puntos, siendo necesario obtener un mínimo de 5 puntos para acceder al siguiente ejercicio, para lo cual el Tribunal calificador adaptará la puntuación del ejercicio a una calificación de 0 a 10 puntos.
Las personas aspirantes que alcancen al menos la mitad de la puntuación máxima superarán el ejercicio y, en caso de que de este modo no superasen el ejercicio al menos tres personas aspirantes por plaza ofertada, se considerará como puntuación mínima del ejercicio la que corresponda hasta que el mismo sea superado por el triple de personas aspirantes que plazas se convocan en la presente convocatoria, siempre que dichas personas aspirantes hayan obtenido al menos el 35 por ciento de la puntuación teórica máxima (3,5 puntos).
A las personas que hubieran superado el primer ejercicio con una nota superior al 60 por ciento de calificación máxima en la convocatoria de 2023, se les podrá conservar la calificación, siempre y cuando ésta sea análoga en el contenido del temario y la forma de calificación, salvo actualización normativa. No obstante, si optasen por presentarse estando exentas, quedará sin efecto el resultado obtenido en la convocatoria inmediata anterior.
Para hacer uso de este derecho, deberán presentar solicitud de participación a las pruebas selectivas y solicitar dicha conservación conforme el anexo II de esta convocatoria.
Las plantillas correctoras de este ejercicio se harán públicas en el plazo máximo de dos días hábiles a contar desde el día siguiente a la finalización del mismo.
6.4.2 Segundo ejercicio.
Este ejercicio, tanto la modalidad presencial como la modalidad por acreditación, se calificará como «apto» o «no apto», siempre cuando el nivel corresponda con un nivel B2 o superior. Los niveles inferiores a B2 no se considerarán válidos para la superación del ejercicio.
6.4.3 Tercer ejercicio.
Este ejercicio se calificará de 0 a 20 puntos, siendo necesario obtener un mínimo de 10 puntos para superarlo. Se valorarán los conocimientos, la claridad y el orden de ideas y la calidad de expresión escrita, así como la forma de presentación y exposición.
6.4.4 Cuarto ejercicio.
Este ejercicio se calificará de 0 a 20 puntos, siendo necesario obtener un mínimo de 10 puntos para superarlo. Se valorarán los conocimientos, el rigor analítico, la sistemática y la claridad de ideas en orden a la elaboración de una propuesta razonada.
6.4.5 Las personas aspirantes que tengan la condición de funcionarios/as de organismos internacionales estarán exentos de la realización de aquellas pruebas que la Comisión Permanente de Homologación considere que tienen por objeto acreditar conocimientos ya exigidos para el desempeño de sus puestos de origen en el organismo internacional correspondiente.
6.4.6 La calificación final de la fase de oposición.
6.4.6.1 Acceso libre.
La calificación de las personas aspirantes vendrá determinada por la suma de las puntuaciones obtenidas en los diferentes ejercicios de dicha fase.
No podrá superar esta fase de oposición un número mayor de personas aspirantes que el de plazas convocadas.
En el supuesto de que alguna de las plazas convocadas por el turno general quedara desierta, el Tribunal calificador podrá proponer al órgano convocante que dicha plaza se destine a incrementar el número de las inicialmente previstas en áreas distintas.
En caso de empate el orden se establecerá atendiendo a la mayor puntuación obtenida en el tercero, cuarto y primer ejercicio, por este orden. De persistir el empate se atenderá al orden alfabético de actuación mencionado en el apartado 8.1., en los términos especificados en este.
6.4.6.2 Promoción interna.
La calificación de las personas aspirantes vendrá determinada por la suma de las puntuaciones obtenidas en los diferentes ejercicios de dicha fase.
Para acceder a la fase de concurso deberán superarse los ejercicios de los que consta la fase de oposición.
6.4.7 Conservación de nota en la convocatoria inmediata siguiente.
En caso de no superar la fase de oposición, las personas aspirantes del turno de discapacidad que superaran uno o más ejercicios con una calificación superior al 50 por ciento de la calificación máxima del ejercicio correspondiente, podrán solicitar la conservación de dicha calificación en la convocatoria inmediata siguiente.
Asimismo, las personas aspirantes del turno general de acceso libre que superaran el primer ejercicio con una calificación superior al 50 por ciento de la calificación máxima, podrán solicitar dicha conservación de dicha nota.
Se entiende por nota la puntuación directa obtenida con carácter previo, en su casi, a la aplicación por parte del Tribunal calificador de fórmulas matemáticas que transformen la puntuación obtenida al objeto al objeto de determinar la superación del ejercicio.
La validez de esta medida será aplicable siempre y cuando el contenido del temario y la forma de calificación de los ejercicios en los que se ha conservado la nota sean análogos, salvo actualización normativa.
6.5 Descripción de la fase de concurso.
6.5.1 Promoción interna.
La fase de concurso no tiene carácter eliminatorio y en ningún caso la puntuación obtenida en la fase de concurso podrá aplicarse para superar la fase de oposición.
Esta fase y tendrá una valoración máxima de 20 puntos para aquellas personas aspirantes que hayan superado la fase de oposición, de acuerdo con el siguiente baremo:
6.5.1.1 Personal Funcionario.
a) Antigüedad. Se valorarán los servicios prestados y reconocidos hasta la fecha de publicación de la presente convocatoria, en puestos de trabajo del subgrupo A2. Asimismo, también se valorará como mérito específico la valoración gradual y diferenciada de la experiencia acreditada por las personas candidatas que, con carácter interino, hubieran desempeñado funciones idénticas o análogas a las del área por la que se presenta. La puntuación será de 0,5 puntos por cada año completo de servicios, hasta un máximo de 12 puntos.
b) Grado personal consolidado y formalizado. Se valorará el grado personal que se tenga consolidado en la Administración General del Estado el día de la publicación de esta convocatoria y formalizado a través del acuerdo de reconocimiento de grado por la autoridad competente en el cuerpo o escala desde el que se participa en estas pruebas. Se otorgará la siguiente puntuación, hasta un máximo de 4 puntos:
a. Grado personal igual o superior al 26: 4 puntos.
b. Grado personal igual al 25: 3,5 puntos.
c. Grado personal igual al 24: 3 puntos.
d. Grado personal igual al 23: 2,5 puntos.
e. Grado personal igual al 22: 2 puntos.
f. Grado personal igual al 21: 1,5 puntos.
g. Grado personal igual al 20: 1,25 puntos.
h. Grado personal igual al 19: 1 punto.
i. Grado personal igual al 18: 0,75 puntos.
Asimismo, se otorgarán 0,75 puntos a aquellas personas funcionarias que en la fecha de publicación de la convocatoria no tengan ningún grado consolidado y formalizado en la Administración General del Estado.
c) Cursos de formación y perfeccionamiento. Se valorará un máximo de ocho cursos de formación, recibidos y acreditados en los cinco años anteriores a la fecha de publicación de esta convocatoria, cuyo contenido esté directamente relacionado con las funciones propias a la escala al que se pretende acceder y que hayan sido convocados, impartidos u homologados por el Instituto Nacional de Administración Pública, por otros institutos de Administración Pública o por organizaciones sindicales u otros agentes promotores dentro del marco del Acuerdo de Formación para el Empleo de las Administraciones Públicas de 9 de marzo de 2018. Se valorará 0,5 puntos por curso, hasta una puntuación máxima de 4 puntos.
No se valorarán los cursos que no acrediten las fechas de realización y las horas de duración. Asimismo, no se valorarán los inferiores a 15 horas lectivas, los pertenecientes a una carrera universitaria, los de doctorado, los derivados de procesos selectivos y los diplomas relativos a jornadas, seminarios, simposios y similares.
No se valorará ningún curso que no haya sido acreditado por las unidades centrales de personal en el certificado de requisitos y méritos. La documentación que acredite los cursos de formación a valorar se acompañará al certificado de requisitos y méritos. Aquellos cursos de formación objeto de valoración que no estén debidamente anotados en el Registro Central de Personal deberán ser acreditados por la persona aspirante ante los servicios centrales de personal o equivalentes, quienes acreditarán este mérito en el correspondiente certificado de requisitos y méritos.
6.5.1.2 Personal laboral fijo.
a) Antigüedad. Se valorará la antigüedad como personal laboral fijo, hasta la fecha de publicación de esta convocatoria, en el grupo o en la categoría desde el que participan descritos en el apartado 3.10. Asimismo, también se valorará como mérito específico la valoración gradual y diferenciada de la experiencia acreditada por las personas candidatas que, con carácter interino, hubieran desempeñado funciones idénticas o análogas a las del área por la que se presenta. La puntuación será de 0,5 puntos por año trabajado, hasta un máximo de 12 puntos.
b) Trabajo desarrollado. Se valorará la permanencia o tiempo de trabajo desarrollado en el grupo y especialidad o en la categoría y grupo profesional desde el que participan, hasta la fecha de publicación de esta convocatoria. Se otorgará la siguiente puntuación, hasta un máximo de 4 puntos, según el siguiente baremo:
a. 20 años o más: 4 puntos.
b. De 15 hasta 20 años: 3 puntos.
c. De 10 hasta 15 años: 2 puntos.
d. De 2 a 10 años: 1 punto.
c) Cursos de formación y perfeccionamiento. Se valorará un máximo de ocho cursos de formación, recibidos y acreditados en los cinco años anteriores a la fecha de publicación de esta convocatoria, cuyo contenido esté directamente relacionado con las funciones propias a la escala al que se pretende acceder y que hayan sido convocados, impartidos u homologados por el Instituto Nacional de Administración Pública, por otros institutos de Administración Pública o por organizaciones sindicales u otros agentes promotores dentro del marco del Acuerdo de Formación para el Empleo de las Administraciones Públicas de 9 de marzo de 2018. Se valorará 0,5 puntos por curso, hasta una puntuación máxima de 4 puntos.
No se valorarán los cursos que no acrediten las fechas de realización y las horas de duración. Asimismo, no se valorarán los inferiores a 15 horas lectivas, los pertenecientes a una carrera universitaria, los de doctorado, los derivados de procesos selectivos y los diplomas relativos a jornadas, seminarios, simposios y similares.
No se valorará ningún curso que no haya sido acreditado por las unidades centrales de personal en el certificado de requisitos y méritos. La documentación que acredite los cursos de formación a valorar se acompañará al certificado de requisitos y méritos. Aquellos cursos de formación objeto de valoración que no estén debidamente anotados en el Registro Central de Personal deberán ser acreditados por la persona aspirante ante los servicios centrales de personal o equivalentes, quienes acreditarán este mérito en el correspondiente certificado de requisitos y méritos.
6.5.2 Calificación final concurso-oposición.
La lista que contenga la valoración de los méritos de la fase de concurso se hará pública en los lugares indicados en el apartado 1, que comprenderá a las personas aspirantes que superen la misma.
La calificación final del concurso-oposición vendrá determinada por la suma de las puntuaciones obtenidas en la fase de oposición y en la de concurso.
No podrá superar las fases de concurso-oposición un número mayor de personas aspirantes que el de plazas convocadas.
En el supuesto de que alguna de las plazas convocadas por el turno general de promoción interna quedara desierta, el Tribunal calificador podrá proponer al órgano convocante que dicha plaza se destine a incrementar el número de las inicialmente previstas en áreas distintas.
En caso de empate en la valoración final del proceso selectivo, el orden de prelación se establecerá atendiendo a los siguientes criterios:
1) Mayor antigüedad global (servicios prestados y reconocidos) en la Administración General del Estado, computándose los años, meses y días de servicio que consten en el Registro Central de Personal al día de publicación de esta convocatoria.
2) La mayor calificación obtenida en el tercero y en el cuarto ejercicio de la fase de oposición, por este orden.
3) La mayor puntuación en la valoración del grado personal consolidado y formalizado (personal funcionario de carrera) o mayor permanencia o tiempo trabajado (personal laboral).
4) La mayor puntuación en cursos de formación y perfeccionamiento.
De persistir el empate se atenderá al orden alfabético de actuación mencionado en el apartado 8.1., en los términos especificados en esta.
6.6 Curso selectivo.
El curso selectivo consistirá en un periodo de formación de teórico-práctico destinado a la adquisición de conocimientos y habilidades en materia de administración, reglamentación, evaluación y gestión de medicamentos y productos sanitarios y consistirá en un periodo formativo con una duración máxima de un mes, a celebrar en las sedes del Ministerio de Sanidad y en las áreas funcionales y dependencias provinciales de Sanidad y Política Social de las delegaciones y subdelegaciones del Gobierno.
El curso selectivo deberá contemplar formación en materia de igualdad de trato y oportunidades entre mujeres y hombres y en materia de violencia de género, tal y como recoge el artículo 61 de la Ley Orgánica 3/2007, de 22 de marzo, para la igualdad efectiva de mujeres y hombres, y el Acuerdo de Consejo de Ministros de 9 de diciembre de 2020 («Boletín Oficial del Estado» de 1 de enero de 2021), por el que se aprueba el III Plan para la igualdad de género en la Administración General del Estado y en los organismos públicos vinculados o dependientes de ella.
La Subsecretaría del Ministerio de Sanidad designará a la persona directora del curso selectivo. Al final de dicho curso, la persona directora del curso emitirá informe para cada una de las personas aspirantes en el que se valorará su rendimiento considerando la asistencia y adquisición de conocimientos, teniendo en cuenta el informe de las unidades donde hayan realizado la parte práctica. Ese informe se elevará al órgano convocante declarando a las personas aspirantes «aptas» o «no aptas». Las personas aspirantes que no obtengan la calificación de «aptas» perderán el derecho a su nombramiento como personal funcionario de carrera, mediante resolución motivada de la autoridad convocante, a propuesta del órgano responsable de la evaluación del curso selectivo.
La coincidencia en el tiempo de varios cursos selectivos no será considerada causa de fuerza mayor. La persona aspirante deberá comunicar tal circunstancia al órgano gestor, informando del proceso selectivo por el que opta realizar. La no realización del curso selectivo dará lugar a la pérdida del derecho al nombramiento como personal funcionario de carrera en esta Escala.
7. Duración del proceso selectivo
7.1 De acuerdo con lo establecido en el artículo 108.2 del Real Decreto-ley 6/2023, de 19 de diciembre, esta convocatoria deberá ejecutarse en el plazo máximo de dos años desde su publicación en el «Boletín Oficial del Estado» y, las respectivas fases de oposición, en un año.
El primer ejercicio de la fase de oposición tendrá que celebrarse en un plazo máximo de tres meses contados a partir de la publicación de esta convocatoria en el «Boletín Oficial del Estado».
7.2 Con el fin de respetar los principios de publicidad, transparencia, objetividad y seguridad jurídica que deben regir el acceso al empleo público, el Tribunal calificador deberá publicar un cronograma orientativo con las fechas de realización de las distintas pruebas del proceso selectivo.
8. Desarrollo del proceso selectivo
8.1 El orden de actuación de las personas aspirantes se iniciará alfabéticamente por aquellas cuyo apellido comience por la letra «V» de conformidad con lo previsto en la Resolución de 25 de julio de 2024, de la Secretaría de Estado de Función Pública («Boletín Oficial del Estado» de 31 de julio).
8.2 En el supuesto de que no exista ninguna persona aspirante cuyo primer apellido comience por la letra «V», el orden de actuación se iniciará por aquéllas cuyo primer apellido empiece por la letra «W» y así sucesivamente.
8.3 Una vez comenzado el proceso selectivo, los anuncios de celebración de los restantes ejercicios se harán públicos con, al menos, doce horas de antelación a la señalada para su inicio, si se trata del mismo ejercicio, o con veinticuatro horas, si se trata de uno nuevo. Estos anuncios se difundirán en los lugares previstos en el apartado 1.1, así como por cualquier otro medio que se juzgue conveniente para facilitar su máxima divulgación.
8.4 Entre la total conclusión de un ejercicio o prueba y el comienzo del siguiente, el plazo máximo a transcurrir será de cuarenta y cinco días naturales, conforme al artículo 16. j) del Real Decreto 364/1995, de 10 de marzo.
8.5 Con el fin de dotar de celeridad y agilidad al desarrollo de este proceso selectivo, se posibilita la realización de pruebas coincidentes en el tiempo.
8.6 Asimismo, el desarrollo de este proceso selectivo podrá ser coincidente en el tiempo con el desarrollo de otros procesos selectivos, en cualquiera de sus fases, incluida la celebración o lectura de ejercicios, realización de cursos selectivos, periodos de prácticas o cualquier otra fase previa al nombramiento como personal funcionario de carrera.
8.7 Las personas aspirantes serán convocadas en llamamiento único quedando decaídos en su derecho quienes no comparezcan a realizarlo, sin perjuicio de lo dispuesto en el apartado 14.
8.8 Las consultas sobre el proceso se podrán realizar a través del correo electrónico consultasprocesos@sanidad.gob.es, sin que este correo tenga la consideración de registro telemático.
9. Acceso por promoción interna
9.1 A efectos de lo dispuesto en el artículo 79 del Real Decreto 364/1995, de 10 de marzo, por el que se aprueba el Reglamento General de ingreso del personal al servicio de la Administración General del Estado y de provisión de puestos de trabajo y promoción profesional de los funcionarios civiles de la Administración General del Estado, se consideran independientes ambos sistemas de selección por lo que las plazas convocadas por el sistema de promoción interna que, en su caso, queden vacantes, no podrán acumularse a las del sistema de acceso libre.
9.2 Las personas aspirantes que superen la fase de oposición deberán presentar, en el plazo de veinte días hábiles, contados a partir del día siguiente al de publicación de las listas de aprobados de la fase de oposición, el certificado de requisitos y méritos según el modelo que figura como anexo III.
9.3 Los certificados de requisitos y méritos deberán ser cumplimentados electrónicamente por los servicios centrales de personal o equivalentes del ministerio u organismo donde presten o hayan prestado servicios a través del Sistema Integrado de Gestión de Personal (SIGP), previa petición de las personas aspirantes. Excepcionalmente, en aquellos supuestos en los que la solicitud electrónica no resulte posible o si el organismo que debe expedir dicha certificación no se encuentra en el ámbito del SIGP, el certificado deberá ser cumplimentado por la máxima autoridad de gestión de recursos humanos.
El órgano gestor verificará la información recibida y la cotejará con los datos obrantes en el Registro Central de Personal, considerándose éstos últimos como prevalentes en caso de discrepancia.
9.4 La aportación de este certificado podrá ser suplida por la consulta por parte de la Administración de los datos obrantes en el Registro Central de Personal en el caso de que los participantes que sean funcionarios en servicio activo en la Administración del Estado no insten la valoración de otros méritos diferentes a los que figuren inscritos en dicho Registro, que serán los que se tengan en cuenta en la valoración de la fase de concurso. En el plazo señalado en el punto 9.2, la persona candidata deberá dar su conformidad con la información que consta de su expediente en el Registro Central de Personal, mediante la cumplimentación y presentación del anexo IV dirigido al órgano gestor. La persona candidata puede consultar la información de su expediente mediante la extracción automática de un informe sobre su expediente personal en el Portal Funciona.
9.5 La no presentación del certificado de requisitos y méritos previsto en el anexo III o del modelo de conformidad recogido en el anexo IV, según corresponda, en el plazo señalado en el apartado 9.2 supondrá que la fase de concurso se valore con cero puntos.
9.6 Los méritos a valorar deberán poseerse a la fecha de publicación de la convocatoria en el «Boletín Oficial del Estado».
9.7 El Tribunal calificador publicará en la página web del organismo convocante, así como en cuantos lugares estime convenientes, la relación que contenga la valoración provisional de méritos de la fase de concurso, con indicación de la puntuación obtenida en cada mérito y la total.
9.8 Las personas aspirantes dispondrán de un plazo de diez días hábiles, a contar a partir del siguiente al de la publicación de dicha relación, para efectuar las alegaciones pertinentes. Finalizado dicho plazo, el Tribunal calificador publicará la relación con la valoración definitiva de la fase de concurso.
9.9 Las personas aspirantes que ingresen por promoción interna tendrán, en todo caso, preferencia para cubrir los puestos vacantes que se oferten de acuerdo con lo dispuesto en el artículo 78.1 del Real Decreto 364/1995, de 10 de marzo.
10. Superación del proceso selectivo y nombramiento
10.1 Finalizada la fase de oposición y, en su caso, de concurso-oposición, el Tribunal calificador hará pública la relación de personas aspirantes que la hayan superado, por riguroso orden de puntuación y con indicación expresa de la misma, en la página web del organismo, en la sede del órgano convocante, así como en aquellos lugares que se estimen convenientes.
10.2 La relación de personas aspirantes que han superado la fase de oposición y, en su caso, la fase de concurso-oposición se elevará a la autoridad convocante, que la publicará en el «Boletín Oficial del Estado», disponiendo las personas aspirantes propuestas de un plazo de veinte días hábiles, desde el día siguiente al de la publicación en el «Boletín Oficial del Estado», para la presentación de la documentación acreditativa del cumplimiento de los requisitos exigidos en la convocatoria.
10.3 De acuerdo con lo establecido en el artículo 61.8 del Real Decreto Legislativo 5/2015, de 30 de octubre, el Tribunal calificador no podrá proponer el acceso a la condición de personal funcionario de un número superior de aprobados al de plazas convocadas.
10.4 No obstante lo anterior, siempre que el Tribunal calificador haya propuesto el nombramiento de igual número de personas aspirantes que el de plazas convocadas en el proceso, y siempre que se produzcan renuncias expresas de las personas seleccionadas con antelación a su nombramiento o toma de posesión, el órgano convocante podrá requerir, por una sola vez, al citado Tribunal calificador una relación complementaria de personas aspirantes que sigan a las propuestas para su posible nombramiento como personal funcionario de carrera.
10.5 Dicha relación se elevará a la autoridad convocante, que la publicará en el «Boletín Oficial del Estado», disponiendo las personas aspirantes propuestas de un plazo de veinte días hábiles, desde el día siguiente al de la publicación en el «Boletín Oficial del Estado», para la presentación de la documentación acreditativa del cumplimiento de los requisitos exigidos en la convocatoria.
10.6 Dado que el proceso selectivo incluye una fase de curso selectivo y/o periodo de prácticas, a las personas aspirantes que hayan acreditado el cumplimiento de los requisitos exigidos en la convocatoria se les nombrará personal funcionario en prácticas, y, a las que superen esta fase, personal funcionario de carrera.
10.7 La adjudicación de los puestos entre las personas aspirantes que superen el proceso selectivo se efectuará según la petición de destino de acuerdo con la puntuación total obtenida, a excepción de lo previsto en el artículo 9 del Real Decreto 2271/2004, de 3 de diciembre, por el que se regula el acceso al empleo público y la provisión de puestos de trabajo de personas con discapacidad.
10.8 De acuerdo con lo dispuesto en el artículo 14.3 de la Ley 39/2015, de 1 de octubre, de Procedimiento Administrativo Común de las Administraciones Públicas y el Real Decreto 203/2021, de 30 de marzo, por el que se aprueba el Reglamento de actuación y funcionamiento del sector público por medios electrónicos, las personas aspirantes que superen este proceso selectivo deberán solicitar destino utilizando exclusivamente medios electrónicos.
10.9 La persona titular de la Secretaría de Estado de Función Pública nombrará personal funcionario de carrera y asignará destino inicial a las personas aspirantes que hayan superado el proceso selectivo y acreditado, en los términos indicados en la convocatoria, cumplir los requisitos exigidos.
10.10 Los nombramientos y la asignación de destino inicial se publicarán en el «Boletín Oficial del Estado».
11. Programas
11.1 El programa que ha de regir los procesos selectivos se incluye como anexo I de esta convocatoria.
12. Tribunal calificador
12.1 El Tribunal calificador de este proceso selectivo, común a ambos procesos selectivos, es el que figura en el presente apartado.
12.2 Se publicará un breve currículum profesional de las personas que forman parte de este Tribunal calificador en la sede electrónica del órgano convocante.
12.3 El Tribunal calificador actuará conforme a los principios de agilidad y eficiencia a la hora de ordenar el desarrollo de los procesos selectivos, sin perjuicio del cumplimiento de los principios de actuación de acuerdo con lo establecido en el texto refundido de la Ley del Estatuto Básico del Empleado Público.
12.4 El procedimiento de actuación del Tribunal calificador se ajustará en todo momento a lo dispuesto en el artículo 112 del Real Decreto-ley 6/2023, de 19 de diciembre, en la Ley 39/2015, de 1 de octubre, en la Ley 40/2015, de 1 de octubre, en la Ley 19/2013, de 9 de noviembre y en las demás disposiciones vigentes. Sus competencias serán las necesarias para su adecuado funcionamiento, incluyendo la calificación de los ejercicios. En particular, los miembros del Tribunal calificador deberán abstenerse y podrán ser recusados de conformidad con lo establecido en los artículos 23 y 24 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
12.5 En el acta de la sesión de constitución del Tribunal calificador podrá acordarse que los miembros titulares y suplentes de los mismos actúen de forma indistinta.
12.6 El Tribunal calificador, de acuerdo con el artículo 14 de la Constitución Española, velará por el estricto cumplimiento del principio de igualdad de oportunidades entre ambos sexos.
12.7 El Tribunal calificador adoptará las medidas necesarias para garantizar que los ejercicios de la fase de oposición que sean escritos y no deban ser leídos ante el mismo, sean corregidos sin que se conozca la identidad de las personas aspirantes. Asimismo, El Tribunal calificador podrá excluir a aquellas personas opositoras en cuyas hojas de examen figuren nombres, rasgos, marcas o signos que permitan conocer la identidad las personas autoras.
12.8 Sin perjuicio de que a la finalización del proceso selectivo se requiera a quienes hayan superado el mismo la acreditación documental del cumplimiento de los requisitos de participación, si en cualquier momento del proceso selectivo, el Tribunal calificador tuviera conocimiento de que alguna de las personas aspirantes no cumple cualquiera de dichos requisitos o resultara que su solicitud adolece de errores o falsedades que imposibilitaran su acceso al Cuerpo o Escala correspondiente en los términos establecidos en la presente convocatoria, previa audiencia de la persona interesada, deberá proponer su exclusión al órgano convocante, para que este resuelva al respecto.
12.9 Corresponderá al Tribunal calificador la consideración, verificación y apreciación de las incidencias que pudieran surgir en el desarrollo de los ejercicios, y adoptará al respecto las decisiones que estime pertinentes.
12.10 El Tribunal calificador actuará de acuerdo con el principio de transparencia. En las actas de sus reuniones y de los ejercicios celebrados deberá dejar constancia de todo acuerdo que afecte a la determinación de las calificaciones otorgadas a cada ejercicio.
12.11 Se difundirán, con anterioridad a la realización de cada prueba, los criterios generales y aspectos a considerar en la valoración que no estén expresamente establecidos en las bases de la convocatoria y en el caso de ejercicios con respuestas alternativas, la penalización que suponga cada respuesta errónea.
12.12 Igualmente, en las actas del Tribunal calificador deberá quedar constancia del cálculo y del desglose de las puntuaciones otorgadas a las personas aspirantes por cada uno de los criterios de valoración establecidos para los ejercicios de la convocatoria.
12.13 Se habilita al Tribunal calificador para la adopción de cuantas medidas, instrucciones o resoluciones sean precisas para el normal desarrollo de las pruebas o de alguna de sus fases. Del mismo modo, se le habilita para el desarrollo descentralizado de las pruebas selectivas, de la lectura de los ejercicios o de alguna de las fases del proceso selectivo, incluyendo el uso de medios electrónicos o telemáticos, entre ellos los audiovisuales. También podrá disponer la incorporación a sus trabajos de asesores especialistas para todos o alguno de los ejercicios, en los casos que sea necesario.
12.14 Asimismo, se habilita al Tribunal calificador para establecer la forma y procedimientos a seguir en el uso de medios electrónicos o telemáticos, incluidos los audiovisuales, para el desarrollo de las pruebas o de alguna de sus fases, así como para la digitalización, encriptación, almacenamiento y custodia, por medios electrónicos, de los exámenes realizados por escrito que así lo requieran, garantizando en todo momento el secreto de aquellos hasta su apertura y lectura pública por las personas aspirantes.
12.15 A efectos de comunicaciones y demás incidencias, el Tribunal calificador tendrá su sede en el Ministerio de Sanidad dirección de correo electrónico etgoas2024@sanidad.gob.es.
12.16 El Tribunal calificador estará conformado por las siguientes personas:
Tribunal titular
Presidente: Don Santiago Vélez Castillo. Cuerpo de Farmacéuticos Titulares.
Secretario: Don Javier Alonso Naveda. Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
Vocales:
Doña Teresa Dannert Alsasua. Cuerpo de Farmacéuticos Titulares.
Don Carlos Bellón Marrero. Cuerpo de Farmacéuticos Titulares.
Doña Lara Quiroga González. Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
Tribunal suplente
Presidenta: Doña Margarita Martín López. Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
Secretaria: Doña Lidia Fernández Matellano. Cuerpo de Farmacéuticos Titulares.
Vocales:
Don Ignacio Garcia Lombardero. Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
Doña Marina Ibor Morales. Cuerpo de Farmacéuticos Titulares.
Doña Natividad Pereiro Couto. Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo.
13. Acceso de personas con discapacidad
13.1 El Tribunal calificador adoptará las medidas oportunas que permitan participar a las personas aspirantes con discapacidad en las pruebas del proceso selectivo en igualdad de condiciones que el resto de personas participantes, siempre que así lo hubieran indicado expresamente en la solicitud, de acuerdo con lo previsto en el Real Decreto 2271/2004, de 3 de diciembre, por el que se regula el acceso al empleo público y la provisión de puestos de trabajo de las personas con discapacidad.
13.2 Las personas con un grado de discapacidad igual o superior al 33 por ciento podrán participar bien por el sistema de acceso general o bien por el cupo de reserva de personas con discapacidad, debiendo indicarlo en el formulario de solicitud de participación en el proceso selectivo.
13.3 Con independencia del sistema por el que opten, las personas aspirantes que presenten un grado de discapacidad igual o superior al 33 %, podrán requerir en el formulario de solicitud las adaptaciones y los ajustes razonables de tiempos y medios oportunos en las pruebas del proceso selectivo.
13.4 Las personas interesadas deberán indicar expresamente en el formulario de participación las adaptaciones de tiempo y/o medios que soliciten para cada uno de los ejercicios del proceso selectivo. Para que el Tribunal calificador pueda valorar la procedencia o no de la adaptación solicitada, las personas interesadas deberán adjuntar necesariamente, en el plazo de presentación de solicitudes, copia auténtica del dictamen técnico facultativo emitido por el órgano técnico de calificación del grado de discapacidad en el que quede acreditado de forma fehaciente la o las deficiencias permanentes que hayan dado origen al grado de discapacidad reconocido, sin que sea válido, a estos efectos, ningún otro documento. El Tribunal calificador aplicará las adaptaciones de tiempos que correspondan previstas en la Orden PRE/1822/2006, de 9 de junio, por la que se establecen criterios generales para la adaptación de tiempos adicionales en los procesos selectivos para el acceso al empleo público de personas con discapacidad e informará a las personas opositoras afectadas sobre la concesión de tiempos y medios otorgada en su caso.
13.5 A las personas que participen por el turno de reserva de discapacidad se les conservará la nota de los ejercicios, siempre que supere como mínimo el 50 por ciento de la calificación prevista para el correspondiente ejercicio. La validez de esta medida será aplicable a la convocatoria inmediata siguiente, cuando el contenido del temario y su forma de calificación sean análogos.
Se entiende por nota la puntuación directa obtenida con carácter previo, en su caso, a la aplicación por parte del Tribunal calificador de fórmulas matemáticas que transformen la puntuación obtenida al objeto de determinar la superación del ejercicio.
13.6 En el supuesto de que alguna de las personas aspirantes que se haya presentado por el cupo de reserva de personas con discapacidad superase los ejercicios correspondientes, pero no obtuviese plaza y su puntuación fuese superior a la obtenida por otras personas aspirantes del sistema de acceso general, éste será incluido por su orden de puntuación en el sistema de acceso general.
13.7 De acuerdo con lo previsto en el Real Decreto 2271/2004, de 3 de diciembre, por el que se regula el acceso al empleo público y la provisión de puestos de trabajo de las personas con discapacidad, las plazas reservadas para las personas con discapacidad que queden desiertas en el caso de acceso libre no se podrán acumular al turno general. En el caso de la promoción interna, las plazas no cubiertas en el cupo de reserva para personas con discapacidad se acumularán a las del turno general.
14. Embarazo de riesgo o parto
14.1 Si a causa de una situación debidamente acreditada de embarazo de riesgo o parto, alguna de las personas aspirantes no pudiera completar el proceso selectivo o realizar algún ejercicio del mismo, su situación quedará condicionada a la finalización del proceso y a la superación de las fases que hayan quedado aplazadas. La realización de estas pruebas no podrá conllevar una demora que menoscabe el derecho del resto de las personas aspirantes a una resolución del proceso ajustada a tiempos razonables, lo que deberá ser valorado por el Tribunal calificador. En todo caso, la realización de las citadas pruebas tendrá lugar antes de la publicación de la lista de personas aspirantes que han superado el proceso selectivo.
15. Pie de recurso
15.1 Contra la presente resolución, que pone fin a la vía administrativa, podrá interponerse, con carácter potestativo, recurso de reposición ante Subsecretaría de Sanidad en el plazo de un mes desde su publicación en el «Boletín Oficial del Estado» o bien recurso contencioso-administrativo, en el plazo de dos meses desde su publicación en el «Boletín Oficial del Estado», ante la Sala de lo Contencioso-administrativo del Tribunal Superior de Justicia de Madrid, de conformidad con lo dispuesto en la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas y la Ley 29/1998, de 13 de julio, reguladora de la Jurisdicción Contencioso-administrativa. En el caso de interponer un recurso de reposición, no se podrá interponer un recurso contencioso-administrativo hasta que aquel sea resuelto expresamente o se haya producido su desestimación presunta.
Madrid, 16 de diciembre de 2024.–La Subsecretaria de Sanidad, Ana María Sánchez Hernández.
Primera parte
Tema 1. La Constitución Española de 1978. Características, estructura, principios constitucionales y valores superiores. Los derechos y deberes fundamentales y su especial protección.
Tema 2. El Poder Judicial. El Tribunal Constitucional. El Tribunal de Cuentas. El Defensor del Pueblo. El Consejo de Estado.
Tema 3. La Corona: Funciones constitucionales del Rey. Sucesión y Regencia. El refrendo.
Tema 4. Las Cortes Generales: Composición y atribuciones del Congreso de los Diputados y del Senado.
Tema 5. El Gobierno: Composición, designación y funciones. La Ley del Gobierno. Los Presupuestos Generales del Estado. Estructura. El ciclo presupuestario.
Tema 6. La Administración Pública en la Constitución Española: Principios Constitucionales. La organización territorial del Estado. La Administración General del Estado y su organización periférica. La Administración Local y las Comunidades Autónomas. Las Ciudades Autónomas. Distribución competencial. Los conflictos de competencias. La coordinación entre las distintas Administraciones Públicas.
Tema 7. Las fuentes del Derecho Administrativo. La jerarquía de fuentes. La Ley. Las disposiciones del Ejecutivo con fuerza de Ley: Decreto-ley y Decreto Legislativo. El Reglamento: Concepto, clases y límites. Otras fuentes del Derecho Administrativo.
Tema 8. La Ley 39/2015, de 1 de octubre, de Procedimiento Administrativo Común de las Administraciones Públicas (I): Disposiciones generales. De las personas interesadas en el procedimiento. De la actividad de las Administraciones Públicas.
Tema 9. La Ley 39/2015, de 1 de octubre, de Procedimiento Administrativo Común de las Administraciones Públicas (II): De los actos administrativos. De las disposiciones sobre el procedimiento administrativo común. De la revisión de los actos en vía administrativa.
Tema 10. La Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público (I): Disposiciones generales. Principios de la potestad sancionadora. Responsabilidad patrimonial de las Administraciones Públicas. Funcionamiento electrónico del sector público. Los convenios.
Tema 11. La Ley 40/2015. de 1 de octubre, de Régimen Jurídico del Sector Público (II): La Administración General del Estado. Organización administrativa. Los Ministerios y su estructura interna. Órganos territoriales. La Administración General del Estado en el exterior.
Tema 12. La Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público (III): Organización y funcionamiento del sector público institucional. Los organismos públicos estatales. Las autoridades administrativas independientes del ámbito estatal. Las sociedades mercantiles estatales. Los consorcios. Las fundaciones del sector público estatal. Los fondos carentes de personalidad jurídica del sector público estatal.
Tema 13. La Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público (IV): Relaciones interadministrativas. Principios generales. Deber de colaboración. Relaciones de cooperación. Relaciones electrónicas entre las Administraciones.
Tema 14. La Ley 9/2017, de 8 de noviembre, de Contratos del Sector Público. Los contratos en el sector público: concepto, tipos, principios, características y elementos. Adjudicación y ejecución.
Tema 15. Régimen jurídico del personal al servicio de las Administraciones Públicas. El Real Decreto legislativo 5/2015, de 30 de octubre, por el que se aprueba el Texto Refundido de la Ley del Estatuto Básico del Empleado Público. Derechos y deberes del personal al servicio de la Administración Pública. Incompatibilidades.
Tema 16. Políticas de igualdad, protección y no discriminación en la Administración General del Estado. Igualdad de género. Políticas contra la violencia de género. Políticas de integración de las personas con discapacidad. Igualdad de trato y no discriminación de las personas LGTBI. Normativa vigente.
Tema 17. Política de integración de las personas con discapacidad. Normativa vigente. La Ley 39/2006, de 14 de diciembre, de Promoción de la Autonomía Personal y Atención a las personas en situación de dependencia.
Tema 18. Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales. Los servicios de prevención. La participación del trabajador. El Reglamento de los servicios de prevención. La vigilancia de la salud de los trabajadores en relación con los riesgos derivados del trabajo. Los reconocimientos de admisión y periódicos.
Tema 19. La Organización de Naciones Unidas y otros organismos internacionales en materia sanitaria. La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). La Organización Mundial del Comercio. El Programa de Cooperación de Inspección Farmacéutica (PIC/S). Agenda 2030 para el Desarrollo Sostenible.
Tema 20. La Organización Mundial de la Salud: Estructura y funciones. Oficinas Regionales. La Organización Panamericana de la Salud. Principales programas y actividades relacionadas. La contribución de la Organización Mundial de la Salud a la promoción de la salud y la asistencia sanitaria. Principales programas y actividades relacionadas con medicamentos.
Tema 21. El Consejo de Europa: Estructura y funciones. Su implicación en la evaluación y control de medicamentos, productos sanitarios y cosméticos. La Farmacopea Europea. Laboratorios Oficiales de Control de Medicamentos (OMCL). El Convenio sobre falsificación de productos médicos. El Convenio de Bioética.
Tema 22. La gobernanza pública y el gobierno abierto. Concepto y principios informadores del gobierno abierto: colaboración, participación, transparencia y rendición de cuentas. Datos abiertos y reutilización. El marco jurídico y los planes de gobierno abierto en España.
Tema 23. Ley 19/2013, de 9 de diciembre, de transparencia, acceso a la información pública y buen gobierno. El Consejo de Transparencia y Buen Gobierno: Real Decreto 615/2024, de 2 de julio, por el que se aprueba el Estatuto del Consejo de Transparencia y Buen Gobierno, A.A.I. Funciones.
Segunda parte
Tema 1. La configuración constitucional de la sanidad en España: el derecho a la protección de la salud. Las competencias sanitarias del Estado y de las Comunidades Autónomas. Las transferencias sanitarias. Coordinación general sanitaria. El Consejo Interterritorial del Sistema Nacional de Salud.
Tema 2. Normativa básica en materia de Sanidad (I). Ley 14/1986, de 25 de abril, General de Sanidad. Estructura. Fundamentos básicos. Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud.
Tema 3. Normativa básica en materia de Sanidad (II). Ley 33/2011, de 4 de octubre, General de Salud Pública. Ley 44/2003, de 21 de noviembre, de ordenación de las profesiones sanitarias. Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
Tema 4. El Sistema Nacional de Salud español. Organización y financiación. Modelos sanitarios. Estudio comparativo con sistemas sanitarios de otros países.
Tema 5. La asistencia sanitaria en el Sistema Nacional de Salud. El aseguramiento sanitario. La ordenación de las prestaciones sanitarias. Los niveles asistenciales en el Sistema Nacional de Salud: Asistencia primaria y asistencia especializada.
Tema 6. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
Tema 7. Real Decreto Legislativo 1/2007, de 16 de noviembre, por el que se aprueba el texto refundido de la Ley General para la Defensa de los Consumidores y Usuarios y otras leyes complementarias. Competencias de las administraciones públicas en materia de consumo. El derecho de los consumidores a la información. Ley 28/2015, de 30 de julio, para la defensa de la calidad alimentaria.
Tema 8. El Ministerio de Sanidad. Estructura y competencias. El Ministerio de Derechos Sociales, Consumo y Agenda 2030. Estructura y competencias.
Tema 9. La Organización Nacional de Trasplantes. Estructura y funciones.
Tema 10. La Agencia Española de Medicamentos y Productos Sanitarios. Estructura, funciones y normativa básica.
Tema 11. La Agencia Española de Seguridad Alimentaria y Nutrición. Estructura, funciones y normativa básica. Ley 17/2011, de 5 de julio, de Seguridad Alimentaria y Nutrición.
Tema 12. La Unión Europea. Antecedentes. Objetivos y naturaleza jurídica. Los tratados originarios y modificativos.
Tema 13. Las Instituciones de la Unión Europea. El Consejo de la Unión Europea y el Consejo Europeo, el Parlamento Europeo, la Comisión Europea, el Tribunal de Justicia y el Tribunal de Cuentas. Composición y atribuciones. Funcionamiento y relaciones institucionales.
Tema 14. Ordenamiento jurídico en la Unión Europea. Fuentes del Derecho Comunitario. La eficacia directa y la primacía del Derecho Comunitario. Relaciones entre el Derecho Comunitario y el ordenamiento jurídico de los Estados Miembros. El procedimiento por incumplimiento del Derecho Comunitario. La comitología. Actos delegados y de ejecución.
Tema 15. La libre circulación de mercancías. La libre circulación de trabajadores. La libertad de establecimiento y la libre prestación de servicios. La libre circulación de capitales. Prevención de barreras técnicas al comercio. Directiva (UE) 2015/1535. La proyección exterior de la Unión Europea. Política exterior y de seguridad común de la Unión Europea. Cooperación en los ámbitos de justicia e interior.
Tema 16. La salud pública en los Tratados de la Unión Europea. Las Normas Comunitarias y la libre circulación de medicamentos, productos sanitarios y cosméticos en la Unión Europea. Programa de salud de la Unión Europea.
Tema 17. Economía de la salud. Conceptos, tipos de estudios y su aplicación en las intervenciones de Salud Pública. Plan de Recuperación, Transformación y Resiliencia: Componente 18.
Tema 18. La Agencia Europea de Medicamentos. Base jurídica, estructura y funciones. Coordinación con las autoridades de los Estados miembros. Bases de datos de la Agencia Europea de Medicamentos. Comités y grupos de trabajo de la Comisión Europea relacionados con medicamentos.
Tema 19. Real Decreto 951/2005, de 29 de julio, por el que se establece el marco general para la mejora de la calidad en la Administración General del Estado. El marco común de evaluación (Common Assessment Framework-CAF) como herramienta de gestión de la calidad total en el sector público: aspectos generales.
Tema 20. Norma ISO 9001:2015 Sistemas de gestión de calidad. La certificación de los sistemas de gestión de calidad. Organismos internacionales y nacionales.
Tema 21. La lucha contra las resistencias a los antibióticos: el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN): consideraciones generales, objetivos, líneas estratégicas. Otros planes de acción frente a la resistencia a los antimicrobianos (Europa y Global Action Plan de la OMS).
Tercera parte
Área de Evaluación de sustancias y mezclas químicas
Tema 1. La reglamentación sobre comercialización de las sustancias y mezclas químicas en la Unión Europea. Modelo legislativo. Reglamento (CE) n.º 1907/2006 (REACH). Obligaciones generales.
Tema 2. La Agencia Europea de sustancias y mezclas químicas (ECHA). Cometidos. Composición y organización: Comités y Foro de intercambio de información relativa al cumplimiento de la normativa.
Tema 3. El procedimiento de registro conforme al Reglamento (CE) n.º 1907/2006 (REACH). Disposiciones generales. Exenciones al registro y sustancias que se consideran registradas. Puesta en común de datos.
Tema 4. Requisitos de información a presentar en la solicitud de registro conforme al Reglamento (CE) n.º 1907/2006 (REACH). Requisitos de información conforme a los anexos VI a X. Adaptación del régimen estándar de ensayo establecido en los anexos VII a X.
Tema 5. Reglamento (CE) n.º 1907/2006 (REACH): Evaluación de la seguridad química y elaboración del Informe de Seguridad Química.
Tema 6. Información en la cadena de suministro de las sustancias y mezclas químicas conforme al Reglamento (CE) n.º 1907/2006 (REACH). Actores implicados. Las fichas de datos de seguridad de las sustancias y mezclas químicas peligrosas.
Tema 7. Procedimiento de evaluación conforme al Reglamento (CE) n.º 1907/2006 (REACH). Evaluación del expediente y evaluación de las sustancias.
Tema 8. El procedimiento de autorización conforme al Reglamento (CE) n.º 1907/2006 (REACH). Disposiciones generales. Identificación de sustancias de alta peligrosidad y procedimiento de inclusión en el Anexo XIV.
Tema 9. Solicitudes de autorización y procedimiento de concesión de autorizaciones.
Tema 10. Restricciones a la fabricación, comercialización y uso de determinadas sustancias y mezclas peligrosas. Proceso de restricción conforme al Reglamento (CE) n.º 1907/2006 (REACH).
Tema 11. Normativa europea para la clasificación, etiquetado y envasado de sustancias y mezclas. Reglamento (CE) n.º 1272/2008 (CLP). Obligaciones generales.
Tema 12. Criterios de clasificación de las sustancias conforme el Reglamento (CE) n.º 1272/2008 (CLP). Identificación y examen de la información. Evaluación de la información sobre el peligro y decisión respecto a la clasificación.
Tema 13. Criterios de clasificación de las mezclas conforme el Reglamento (CE) n.º 1272/2008 (CLP). Identificación y examen de la información. Evaluación de la información sobre el peligro y decisión respecto a la clasificación.
Tema 14. Obligaciones de etiquetado y envasado de las sustancias y mezclas conforme el Reglamento (CE) n.º 1272/2008 (CLP). Información relativa a la respuesta sanitaria en caso de urgencia.
Tema 15. Procedimiento de armonización de la clasificación y el etiquetado de sustancias y catálogo de clasificación y etiquetado conforme el Reglamento (CE) n.º 1272/2008 (CLP).
Tema 16. Ley 8/2010 sobre régimen sancionador del Reglamento (CE) n.º 1907/2006 (REACH) y Reglamento (CE) n.º 1272/2008 (CLP).
Tema 17. Vigilancia y control de productos químicos. Herramientas: SIRIPQ e ICSMS.
Tema 18. Control oficial de los productos químicos. Proyectos europeos y/o nacionales de inspección y cumplimiento. Estrategias y criterios en su elaboración.
Tema 19. Evaluación del riesgo químico. Concepto. Determinación de la peligrosidad, estimación de la exposición y caracterización del riesgo.
Tema 20. Protección de animales de experimentación. Principio de las 3R. Métodos alternativos.
Tema 21. Propiedades físico-químicas que afectan a la peligrosidad de sustancias y mezclas químicas. Métodos de ensayo y criterios de clasificación.
Tema 22. Toxicocinética. Absorción, distribución, metabolismo y eliminación de xenobióticos. Métodos de ensayo.
Tema 23. Toxicidad aguda oral. Métodos reglamentarios de determinación de la DL50. Criterios de evaluación y de clasificación.
Tema 24. Toxicidad aguda dérmica. Métodos reglamentarios de determinación de la DL50. Criterios de evaluación y de clasificación.
Tema 25. Toxicidad oral aguda por inhalación. Métodos reglamentarios para la determinación de la CL50. Tamaño de partícula, respirabilidad y atmósfera generada.
Tema 26. Corrosión/Irritación ocular y cutánea. Métodos de ensayo y criterios de clasificación.
Tema 27. Sensibilización cutánea e inhalatoria. Métodos de ensayo y criterios de clasificación.
Tema 28. Toxicidad específica en determinados órganos-exposición única (STOT SE). Ensayos y criterios de clasificación.
Tema 29. Toxicidad específica en determinados órganos-exposición repetida (STOT RE). Ensayos y criterios de clasificación.
Tema 30. Genotoxicidad. Ensayos para evaluar el potencial mutágeno de sustancias químicas. Estrategia de evaluación y criterios de clasificación.
Tema 31. Carcinogénesis. Ensayos para evaluar el potencial carcinógeno de sustancias químicas. Criterios de clasificación y ensayos para su evaluación.
Tema 32. Toxicidad para la reproducción, para el desarrollo. Criterios de clasificación y ensayos para su evaluación.
Tema 33. Toxicidad para la reproducción, para la fertilidad. Criterios de clasificación y ensayos para su evaluación.
Tema 34. Disrupción endocrina. Criterios de clasificación y ensayos para su evaluación.
Tema 35. Neurotoxicidad aguda y retardada. Neurotoxicidad para el desarrollo. Métodos de ensayo y criterios de evaluación.
Tema 36. Determinación de parámetros toxicológicos para la evaluación de riesgos para la salud humana de sustancias químicas (NOEL, NOAEL, LOAEL, DNEL, DMEL).
Tema 37. Agrupación de sustancias y extrapolación de datos. Metodología.
Tema 38. Modelos de relación estructura-actividad (SAR), y de relación cuantitativa entre estructura y actividad (QSAR).
Tema 39. Aspectos relacionados con los nanomateriales en la legislación europea de productos químicos (Reglamentos REACH y biocidas). Guías EFSA sobre la evaluación de riesgos de nanomateriales en la cadena alimentaria, focalizando en fitosanitarios.
Tema 40. La reglamentación de los biocidas en la Unión Europea. Reglamento (UE) n.º 528/2012. Definición de biocida. Condiciones de aprobación de sustancias activas y criterios de exclusión. Sustancias candidatas a sustitución.
Tema 41. Procedimiento para la aprobación de sustancias activas biocidas. Datos exigidos. Modificación del Anexo I del Reglamento (UE) n.º 528/2012.
Tema 42. Principios generales relativos a la autorización de biocidas de acuerdo al Reglamento (UE) n.º 528/2012.
Tema 43. Programa de trabajo para el examen sistemático de sustancias activas existentes. Reglamento Delegado (UE) n.º 1062/2014.
Tema 44. Procedimientos europeos de autorización de biocidas: Autorizaciones nacionales. Procedimientos de Reconocimiento mutuo.
Tema 45. Procedimiento de autorización simplificado de biocidas. Autorizaciones de la Unión.
Tema 46. Autorización de un mismo biocida: Reglamento de Ejecución (UE) n.º 414/2014.
Tema 47. Cambios en las autorizaciones de productos biocidas: Reglamento de Ejecución (UE) n.º 354/2013. Artículos tratados.
Tema 48. Confidencialidad y puesta en común de datos de acuerdo con el Reglamento (UE) n.º 528/2012. Etiquetado de biocidas.
Tema 49. Medidas transitorias relativas a la comercialización de biocidas: artículos 89, 93 y 95 del Reglamento (UE) n.º 528/2012.
Tema 50. Información obligatoria respecto a los biocidas (Anexo III del Reglamento (UE) n.º 528/2012). Normas generales para la adaptación de los requisitos de datos.
Tema 51. Principios comunes para la evaluación de expedientes de biocidas. Tipos de productos biocidas. Desinfectantes. Conservantes. Plaguicidas. Otros.
Tema 52. La reglamentación de plaguicidas en España: Real Decreto 3349/1983, de 30 de noviembre. Registro de plaguicidas de la Dirección General de Salud Pública y Equidad en Salud.
Tema 53. Registro de plaguicidas de uso en higiene personal y desinfectantes de ambientes clínicos y quirúrgicos. Registro de plaguicidas en el ámbito ganadero (zoosanitarios). Biocidas no sometidos a registro de acuerdo con la Disposición Transitoria segunda del Real Decreto 1054/2002 de 11 de octubre.
Tema 54. Capacitación requerida para realizar tratamientos con biocidas. Real Decreto 830/2010, de 25 de junio. Cualificaciones profesionales. Figura del responsable técnico.
Tema 55. Registro Oficial de Establecimientos y Servicios biocidas. Orden SCO/3269/2006. Libro Oficial de Movimientos.
Tema 56. Autoridades competentes en relación con la vigilancia, inspección y control de biocidas. Infracciones y sanciones: Real Decreto 1054/2002 de 11 de octubre. Subgrupo del Foro de la ECHA sobre el Reglamento de Biocidas (BPRS).
Tema 57. La reglamentación de los productos fitosanitarios en la Unión Europea. Reglamento (CE) n.º 1107/2009. Definición de producto fitosanitario. Requisitos y condiciones de aprobación de las sustancias activas. Procedimiento de aprobación de las sustancias activas. Renovación y revisión de la aprobación de una sustancia activa.
Tema 58. Sustancias activas fitosanitarias de bajo riesgo. Sustancias básicas con acción fitosanitaria. Sustancias activas fitosanitarias candidatas a sustitución. Protectores y sinergistas. Coformulantes en los productos fitosanitarios. Adyuvantes.
Tema 59. Autorización de productos fitosanitarios. Requisitos y contenido. Procedimiento.
Tema 60. Reconocimiento mutuo de las autorizaciones de productos fitosanitarios. Renovación, retirada y modificación de las autorizaciones de productos fitosanitarios.
Tema 61. Productos fitosanitarios de bajo riesgo. Productos fitosanitarios que contengan un organismo modificado genéticamente. Comercialización de semillas tratadas.
Tema 62. Evaluación comparativa de productos fitosanitarios que contengan sustancias candidatas a la sustitución. Usos menores. Comercio paralelo. Situaciones de emergencia en materia fitosanitaria.
Tema 63. Investigación y desarrollo en materia de productos fitosanitarios. Utilización e información de los productos fitosanitarios. Protección de datos y puesta en común de datos relacionados con fitosanitarios. Acceso público a la información. Envasado, etiquetado y publicidad de fitosanitarios y adyuvantes. Controles y emergencias en materia de productos fitosanitarios.
Tema 64. Requisitos comunitarios sobre los datos aplicables a la evaluación de sustancias activas de uso fitosanitario. Reglamento (UE) n.º 283/2013 de la Comisión, de 1 de marzo de 2013.
Tema 65. Requisitos generales sobre datos aplicables para el registro de productos fitosanitarios. Reglamento (UE) n.º 284/2013 de la Comisión, de 1 de marzo de 2013.
Tema 66. Principios Uniformes para la evaluación y autorización de productos fitosanitarios. Reglamento (UE) n.º 546/2011 de la Comisión, de 10 de junio de 2011.
Tema 67. Requisitos de etiquetado de los productos fitosanitarios. Reglamento (UE) n.º 547/2011 de la Comisión, de 8 de junio de 2011.
Tema 68. Uso sostenible de productos fitosanitarios. Normativa nacional y de la Unión Europea.
Tema 69. Procedimiento de evaluación de productos fitosanitarios a nivel nacional. Real Decreto 971/2014, de 21 de noviembre.
Tema 70. Establecimiento y determinación de parámetros toxicológicos para la evaluación el riesgo de productos fitosanitarios. Determinación de la Ingesta Diaria Admisible (IDA). Límite de exposición permitido aceptable al operario (AOEL y AAOEL).
Tema 71. Absorción dérmica. Métodos in vivo e in vitro para calcular la absorción dérmica de una sustancia. Métodos B.44 y B.45. Documento Guía de EFSA para evaluar la absorción dérmica.
Tema 72. Exposición aguda y crónica a productos fitosanitarios. Definición de grupos de riesgo. Métodos de estimación de la exposición de operarios, trabajadores, residentes y circunstantes. Medidas de mitigación de riesgos.
Tema 73. Estimación de la exposición acumulativa a más de una sustancia activa de uso fitosanitario: exposición combinada. Documento Guía de EFSA sobre Criterios científicos para agrupar sustancias químicas en grupos de evaluación para la evaluación del riesgo humano de exposición combinada a múltiples sustancias químicas.
Tema 74. Evaluaciones de la exposición a alto nivel (higher tier) a productos fitosanitarios: estudios de medición de la exposición y estudios de residuos foliares desprendibles (Dislodgeable Foliar Residue).
Tema 75. La Autoridad Europea de Seguridad Alimentaria (EFSA). Misión y valores. Composición y organización.
Área de Evaluación clínica y preclínica de medicamentos
Tema 1. Estadística descriptiva. Tipos de variable. Escalas de medida de las variables. Representación gráfica de datos. Estadísticos de centralización y de dispersión.
Tema 2. Análisis estadístico de datos (I): estimación de una población a partir de una muestra. Estimación de una media. Estimación de un porcentaje. Significación estadística. Contraste de hipótesis. Intervalos de confianza.
Tema 3. Análisis estadístico de datos (II): análisis de variables cualitativas y cuantitativas.
Tema 4. Ensayos clínicos con medicamentos. Fases de la investigación clínica con fármacos. Estudios post-autorización.
Tema 5. Investigación clínica: Fundamentos y requisitos éticos en los ensayos clínicos. La Declaración de Helsinki y otras normas internacionales. Las Normas de Buena Práctica Clínica. Comités Éticos de Investigación Clínica. Regulación, composición, organización, funciones y principios de actuación.
Tema 6. Bases legales de la investigación con seres humanos o con materiales de procedencia humana en España. La Ley de Investigación Biomédica. Ley Orgánica de protección de datos.
Tema 7. Metodología del ensayo clínico: Tipos de diseños. Control del error aleatorio y prevención de sesgos. Uso del placebo.
Tema 8. Ensayos clínicos (I): interpretación de resultados. Análisis por intención de tratar. Análisis por protocolo. Análisis de sensibilidad.
Tema 9. Ensayos clínicos (II): Variables de eficacia clínicas y subrogadas, variables combinadas. Las medidas de calidad de vida relacionadas con la salud.
Tema 10. Análisis de supervivencia. Análisis por subgrupos. Ajuste por covariables. Multiplicidad. Missing data.
Tema 11. Ensayos de superioridad y no-inferioridad. Elección del margen de no-inferioridad. Diseños adaptativos.
Tema 12. Consideraciones estadísticas durante la realización de un ensayo clínico: ajuste del tamaño muestral, análisis intermedios, criterios de parada.
Tema 13. Evaluación de pruebas diagnósticas. Concepto de sensibilidad, especificidad y valor predictivo. Cribado poblacional.
Tema 14. Síntesis de la evidencia científica. Metanálisis y revisiones sistemáticas.
Tema 15. Medicina basada en la evidencia. Bases conceptuales y método. Estrategia de búsqueda y valoración crítica de la evidencia.
Tema 16. Estructura y contenido del dossier de registro de un medicamento.
Tema 17. Procedimiento centralizado de autorización de medicamentos. Tipos de autorización. El Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos.
Tema 18. Procedimiento de reconocimiento mutuo y procedimiento descentralizado. El Grupo de Coordinación de procedimientos de reconocimiento mutuo y descentralizado. Estructura y funciones.
Tema 19. Procedimiento nacional de autorización de medicamentos. El Comité de Evaluación de Medicamentos de Uso Humano. Estructura y funciones.
Tema 20. Balance beneficio-riesgo de un medicamento. Conceptos de efectividad y eficiencia. Posicionamiento terapéutico de medicamentos.
Tema 21. Contenido y evaluación del dossier de registro en función de la base legal solicitada. Tipos de expedientes completos y abreviados.
Tema 22. Contenido y evaluación del dossier de registro en las modificaciones de la autorización de comercialización. Modificaciones de importancia menor (IA y IB) y de importancia mayor (II).
Tema 23. Regulación de medicamentos pediátricos. Plan de investigación pediátrico. Comité de medicamentos pediátricos.
Tema 24. Evaluación de medicamentos: contenido de la ficha técnica del medicamento. Grupo asesor del resumen de características del producto de la Agencia Europea de Medicamentos.
Tema 25. Etiquetado y prospecto de medicamentos. Consultas a pacientes y usuarios: test de legibilidad.
Tema 26. Medicamentos para enfermedades raras. Reglamento de Medicamentos Huérfanos. Comité de medicamentos huérfanos.
Tema 27. Medicamentos en situaciones especiales. Anulaciones y suspensiones de medicamentos.
Tema 28. Medicamentos de origen biológico y biotecnológico. Terapias avanzadas (terapia génica, terapia celular e ingeniería de tejidos).
Tema 29. Biosimilares. Concepto. Requerimientos para su autorización.
Tema 30. Uso racional de los medicamentos: fuentes de información sobre medicamentos. Estudios de utilización de medicamentos.
Tema 31. Farmacoeconomía. Análisis de minimización de costes. Análisis coste-efectividad. Análisis coste-utilidad. Análisis coste-beneficio. Aplicación de los estudios de evaluación económica en la toma de decisiones.
Tema 32. Farmacovigilancia. Concepto, objetivos y organización de la farmacovigilancia en España. El Sistema Español de Farmacovigilancia. Buenas Prácticas de Farmacovigilancia.
Tema 33. Informes periódicos de seguridad. El Plan de Gestión de Riesgos. Medidas de minimización. Comunicación de riesgos.
Tema 34. Mecanismos generales de acción de los medicamentos. Interacciones fármaco-receptor. Dianas y mecanismos moleculares.
Tema 35. Farmacocinética. Definición de los parámetros farmacocinéticos básicos. Factores intrínsecos y extrínsecos que afectan la biodisponibilidad de los medicamentos.
Tema 36. Bioequivalencia en productos de liberación inmediata de acción sistémica. Bioexenciones.
Tema 37. Bioequivalencia en productos de liberación modificada de acción sistémica. Bioequivalencia en productos de acción local.
Tema 38. Interacciones de medicamentos: farmacocinéticas y farmacodinámicas. Implicaciones terapéuticas.
Tema 39. Evaluación clínica de medicamentos para poblaciones especiales. Uso de medicamentos en geriatría y pediatría. Uso de medicamentos en embarazo y lactancia.
Tema 40. Utilización terapéutica de medicamentos antidepresivos. Evaluación clínica y consideraciones metodológicas.
Tema 41. Utilización terapéutica de medicamentos antipsicóticos. Evaluación clínica y consideraciones metodológicas.
Tema 42. Utilización terapéutica de medicamentos para las enfermedades neurodegenerativas y las demencias. Evaluación clínica y consideraciones metodológicas.
Tema 43. Utilización terapéutica de medicamentos para el tratamiento del dolor. Evaluación clínica de analgésicos y consideraciones metodológicas.
Tema 44. Utilización terapéutica de medicamentos antiarrítmicos. Evaluación clínica y consideraciones metodológicas.
Tema 45. Utilización terapéutica de medicamentos antianginosos. Evaluación clínica y consideraciones metodológicas.
Tema 46. Utilización terapéutica de medicamentos para el tratamiento de la hipertensión arterial esencial. Evaluación clínica y consideraciones metodológicas.
Tema 47. Utilización terapéutica de medicamentos para el tratamiento de la hipertensión arterial pulmonar. Evaluación clínica y consideraciones metodológicas.
Tema 48. Utilización terapéutica de medicamentos para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa. Evaluación clínica y consideraciones metodológicas.
Tema 49. Utilización terapéutica de medicamentos para el control del peso y para los trastornos de la motilidad digestiva. Evaluación clínica y consideraciones metodológicas.
Tema 50. Utilización terapéutica de medicamentos para el tratamiento del asma y la enfermedad pulmonar obstructiva crónica. Evaluación clínica y consideraciones metodológicas.
Tema 51. Utilización terapéutica de hormonas sexuales. Evaluación clínica de anticonceptivos y consideraciones metodológicas.
Tema 52. Utilización terapéutica de medicamentos para los trastornos del metabolismo de la glucosa. Evaluación clínica de antidiabéticos orales y consideraciones metodológicas.
Tema 53. Utilización terapéutica de medicamentos para el tratamiento de las dislipemias. Evaluación clínica y consideraciones metodológicas.
Tema 54. Principios generales de la terapéutica antimicrobiana. Clasificación. Mecanismos de acción.
Tema 55. Criterios de selección y asociaciones de antibióticos. Estudio de la sensibilidad a los antimicrobianos. Mecanismo de resistencia a los antibióticos.
Tema 56. Evaluación clínica de los antimicrobianos. Diseño de los estudios y consideraciones metodológicas.
Tema 57. Utilización terapéutica de medicamentos antivirales. Evaluación clínica y consideraciones metodológicas.
Tema 58. Utilización terapéutica de medicamentos antineoplásicos (I): antineoplásicos activos sobre ADN, antimetabolitos, antineoplásicos activos sobre reguladores celulares (inhibidores de tirosina cinasas, inhibidores selectivos de mTOR, retinoides, alcaloides de la vinca, taxanos).
Tema 59. Utilización terapéutica de medicamentos antineoplásicos (II): antineoplásicos activos sobre factores hormonales, antineoplásicos biológicos (anticuerpos monoclonales, proteínas recombinantes, citocinas).
Tema 60. Evaluación clínica de los medicamentos antineoplásicos. Diseño de los estudios y consideraciones metodológicas.
Tema 61. Utilización terapéutica de medicamentos antitrombóticos: anticoagulantes, antiagregantes plaquetarios y trombolíticos. Evaluación clínica de medicamentos para síndrome coronario agudo y tromboembolismo venoso. Consideraciones metodológicas.
Tema 62. Utilización terapéutica de medicamentos para el tratamiento de enfermedades autoinmunes. Evaluación clínica de medicamentos para la artritis reumatoide y consideraciones metodológicas.
Tema 63. Utilización de medicamentos para el tratamiento de las citopenias y déficits de la coagulación. Evaluación clínica y consideraciones metodológicas.
Tema 64. Radiofármacos. Utilización terapéutica. Evaluación clínica de medicamentos de diagnóstico por imagen.
Tema 65. Uso terapéutico de medicamentos para las enfermedades del sistema músculo-esquelético. Artrosis. Osteoporosis. Evaluación clínica y consideraciones metodológicas.
Tema 66. Evaluación preclínica de la farmacología de seguridad de los medicamentos. Evaluación preclínica de la inmunotoxicidad de los medicamentos.
Tema 67. Evaluación de la toxicidad a dosis única y repetida. Diseño de los estudios y duración de los mismos para la autorización y el registro de un medicamento de uso humano. Margen de seguridad.
Tema 68. Evaluación preclínica del potencial genotóxico de los medicamentos.
Tema 69. Evaluación preclínica del potencial carcinogénico de los medicamentos.
Tema 70. Evaluación preclínica de la toxicidad de los medicamentos sobre la reproducción. Estudios de fertilidad, embriotoxicidad y teratogenia. Estudios peri-postnatales.
Tema 71. Evaluación preclínica de la fotoseguridad de los medicamentos.
Tema 72. Evaluación de la seguridad pre-clínica para la realización de ensayos clínicos en humanos.
Tema 73. Evaluación preclínica de productos biológicos y biotecnológicos.
Tema 74. Evaluación preclínica de los medicamentos de terapias avanzadas.
Tema 75. Evaluación del riesgo medio-ambiental de los medicamentos.
Área de Productos sanitarios y cosméticos
Tema 1. Evolución del enfoque legislativo de los productos sanitarios en la Unión Europea: de las directivas a los reglamentos. Estructuras para la gobernanza de la legislación europea: órganos de la Comisión Europea y Comités y Grupos de Trabajo relacionados con productos sanitarios. Grupo de autoridades competentes en productos sanitarios. Papel de los Comités científicos.
Tema 2. La regulación de los productos sanitarios implantables activos en la Unión Europea. Directivas y Reglamentos comunitarios.
Tema 3. La regulación de los productos sanitarios en la Unión Europea. Directivas y Reglamentos comunitarios.
Tema 4. La regulación de los productos sanitarios para diagnóstico in vitro en la Unión Europea. Directivas y Reglamentos comunitarios.
Tema 5. La reglamentación española de los productos sanitarios implantables activos. Aplicación de las medidas comunitarias en España. Aspectos adicionales contemplados en la reglamentación española. Competencias de las administraciones públicas.
Tema 6. La reglamentación española de los productos sanitarios. Aplicación de las medidas comunitarias en España. Aspectos adicionales contemplados en la reglamentación española. Competencias de las Administraciones Públicas.
Tema 7. La reglamentación española de los productos sanitarios para diagnóstico in vitro. Aplicación de las medidas comunitarias en España. Aspectos adicionales contemplados en la reglamentación española. Competencias de las administraciones públicas.
Tema 8. Concepto de producto sanitario. Las fronteras entre productos sanitarios, medicamentos y otros productos. Directrices y manuales europeos sobre frontera en productos sanitarios.
Tema 9. Concepto de producto sanitario para diagnóstico in vitro. Las fronteras entre productos sanitarios para diagnóstico in vitro, productos sanitarios y otros productos. Directrices y manuales europeos sobre frontera en productos sanitarios para diagnóstico in vitro.
Tema 10. La clasificación de los productos sanitarios. Diferencias entre las directivas y los reglamentos: Reglas y criterios. Directrices y manuales europeos sobre clasificación.
Tema 11. La clasificación de los productos sanitarios para diagnóstico in vitro. Diferencias entre las directivas y los reglamentos: Reglas y criterios. Directrices y manuales europeos sobre clasificación.
Tema 12. Requisitos de seguridad y funcionamiento de los productos sanitarios y de los productos sanitarios implantables activos: requisitos generales, requisitos relativos al diseño y a la fabricación, requisitos relativos a la información proporcionada con el producto.
Tema 13. Requisitos de seguridad y funcionamiento de los productos sanitarios para diagnóstico in vitro: requisitos generales, requisitos relativos al funcionamiento, al diseño y a la fabricación, requisitos relativos a la información proporcionada con el producto. Especificaciones comunes.
Tema 14. Los Organismos Notificados. Actuaciones de los organismos notificados. Proceso de designación de los organismos notificados para productos sanitarios: criterios para su designación y control. Situación en la Unión Europea y en España.
Tema 15. Condiciones para la colocación del marcado CE en los productos sanitarios y los productos sanitarios implantables activos. Procedimientos de evaluación de la conformidad aplicables en función del tipo de producto, su clasificación y sus riesgos. Diferencias entre directivas y reglamentos.
Tema 16. Condiciones para la colocación del marcado CE en los productos sanitarios para diagnóstico in vitro. Procedimientos de evaluación de la conformidad aplicables en función del tipo de producto, su clasificación y sus riesgos. Diferencias entre directivas y reglamentos.
Tema 17. Análisis y gestión de riesgos en productos sanitarios y productos sanitarios implantables activos. Técnicas específicas para el análisis de riesgos.
Tema 18. Análisis y gestión de riesgos en productos sanitarios para diagnóstico in vitro. Técnicas específicas para el análisis de riesgos.
Tema 19. El diseño y producción de productos sanitarios estériles y productos que requieren condiciones asépticas. Áreas clasificadas y áreas controladas. Técnicas de validación y control de áreas y procesos.
Tema 20. Métodos de esterilización industrial de productos sanitarios: vapor, óxido de etileno, irradiación y otros. Diseño de procesos, validación y controles de rutina.
Tema 21. Productos sanitarios fabricados por procesos asépticos. Diseño de procesos, validación y controles de rutina.
Tema 22. Limpieza, desinfección y esterilización de productos sanitarios reutilizables. Métodos, validación de procesos y controles. Factores que limitan la reutilización y riesgos derivados. El reprocesamiento de productos sanitarios de un solo uso.
Tema 23. Seguridad biológica de productos sanitarios. Criterios para la selección de ensayos. Ensayos aplicables.
Tema 24. Productos sanitarios elaborados con materiales de origen animal. Riesgos específicos. Control de procesos.
Tema 25. Productos sanitarios fabricados a base de polímeros: características de sus procesos de fabricación y control. Aplicaciones médicas.
Tema 26. Productos sanitarios fabricados a base de materiales textiles: características de sus procesos de fabricación y control. Aplicaciones médicas.
Tema 27. Productos sanitarios implantables fabricados con materiales metálicos y cerámicos: características de sus procesos de fabricación y control. Aplicaciones médicas.
Tema 28. Equipos médicos. Seguridad eléctrica y compatibilidad electromagnética. Mantenimiento de equipos. Aplicaciones médicas.
Tema 29. Software médico y aplicaciones para plataformas móviles. Criterios para su cualificación como producto sanitario. Clasificación. Diferencias entre directivas y reglamentos. Aplicaciones médicas.
Tema 30. Productos sanitarios para diagnóstico in vitro. Metodologías y fundamentos de las técnicas analíticas utilizadas en bioquímica clínica y microbiología clínica.
Tema 31. Productos sanitarios para diagnóstico in vitro. Metodologías y fundamentos de las técnicas analíticas utilizadas en banco de sangre y en test genéticos.
Tema 32. Las investigaciones clínicas de los productos sanitarios en la Unión Europea. Diferencias entre directivas y reglamentos. Directrices europeas sobre investigaciones clínicas en productos sanitarios. Reglamentación española. Competencias de las Administraciones Públicas.
Tema 33. Las garantías de información de los productos sanitarios: Etiquetado, instrucciones de utilización, etiquetado electrónico. Terminología, nomenclatura y símbolos utilizados en productos sanitarios.
Tema 34. La trazabilidad de los productos sanitarios. Sistema de identificación única de productos sanitarios (UDI): Objetivos y estructura. Registros europeos de productos sanitarios. Base de Datos Europea de Productos Sanitarios (EUDAMED). Diferencias entre directivas y reglamentos.
Tema 35. La publicidad y la promoción de los productos sanitarios en España. Demostraciones y exhibiciones. Venta de productos sanitarios. Venta de productos que requieren adaptación individualizada. Venta a distancia. Competencias de las administraciones públicas.
Tema 36. El Sistema de Vigilancia de Productos Sanitarios en la Unión Europea. Diferencias entre directivas y reglamentos. Su aplicación y funcionamiento en España. Redes de alerta de productos sanitarios de ámbito nacional, europeo e internacional. Directrices europeas sobre vigilancia. La tarjeta de implante.
Tema 37. Requisitos para la fabricación, importación y distribución de los productos sanitarios en España. Competencias de las administraciones públicas. Obligaciones de los agentes económicos en la reglamentación española y en los reglamentos europeos.
Tema 38. La certificación de los sistemas de garantía de calidad. Organismos internacionales y nacionales. Requisitos exigibles a los organismos de certificación. Analogías y diferencias entre certificación voluntaria y certificación reglamentaria. Requisitos de los sistemas de garantía de calidad en la reglamentación de productos sanitarios. Papel de la norma UNE-EN-ISO 13485.
Tema 39. El enfoque legislativo de los productos cosméticos en la Unión Europea. Estructuras para la gobernanza de la legislación europea: órganos de la Comisión Europea y Comités y Grupos de Trabajo relacionados con productos cosméticos. Papel de los Comités científicos.
Tema 40. La regulación de los productos cosméticos en la Unión Europea. Reglamento comunitario sobre productos cosméticos.
Tema 41. El control analítico de los productos cosméticos. Métodos oficiales de análisis de productos cosméticos. Estructuras europeas para análisis y ensayos de productos cosméticos.
Tema 42. La regulación de los productos cosméticos en España. Aspectos adicionales contemplados en la regulación española. Competencias de las administraciones públicas.
Tema 43. Concepto de producto cosmético. Las fronteras entre productos cosméticos, medicamentos, productos sanitarios, biocidas y otros productos. Directrices y manuales europeos sobre frontera en productos cosméticos.
Tema 44. Etapas en el diseño y desarrollo de los productos cosméticos. Elección de las materias primas. Formulación cosmética. Sistema conservante. Estabilidad. El envase cosmético.
Tema 45. Tecnologías de fabricación y control de productos cosméticos que se presentan en forma de emulsiones, suspensiones y geles. Ensayos de calidad.
Tema 46. Tecnologías de fabricación y control de productos cosméticos que se presentan en forma de polvos, soportes impregnados y envases presurizados. Ensayos de calidad.
Tema 47. Tecnologías de fabricación y control de esmaltes de uñas y de colonias y perfumes. Ensayos de calidad.
Tema 48. Cosméticos para el cuidado e higiene de la piel. Cosmética antienvejecimiento. Protección solar.
Tema 49. Cosméticos para el cuidado e higiene del cabello. Tintes capilares. Productos para el rizado y desrizado. Cosmética masculina: productos para afeitado.
Tema 50. Cosméticos para la higiene y el cuidado bucal y dental. Cosmética decorativa.
Tema 51. Requisitos para la fabricación e importación de productos cosméticos en España. Obligaciones de los agentes económicos en España en relación con los productos cosméticos.
Tema 52. Buenas Prácticas de Fabricación de productos cosméticos. Papel de la norma UNE-EN-ISO 22716. Certificación de Buenas Prácticas de Fabricación.
Tema 53. Calidad microbiológica de los cosméticos. Límites microbiológicos en función del tipo de producto. Criterios para la evaluación del riesgo de contaminación microbiológica.
Tema 54. Técnicas de prevención de la contaminación y técnicas de conservación en cosméticos.
Tema 55. Seguridad de los cosméticos. Ensayos de seguridad aplicables a productos cosméticos.
Tema 56. Criterios de evaluación del riesgo en productos cosméticos. Margen de seguridad. El informe de seguridad.
Tema 57. Procedimientos y exigencias particulares en cosméticos con especiales perfiles de seguridad: tintes capilares, cosméticos con nanomateriales, cosméticos que contienen sustancias carcinógenas, mutágenas o tóxicas para la reproducción.
Tema 58. Procedimientos y exigencias particulares en cosméticos con especiales perfiles de seguridad: cosméticos destinados a niños pequeños, perfumes y fragancias, cosméticos que pueden ser inhalados.
Tema 59. Eficacia de los cosméticos. Ensayos de eficacia. Estudios en humanos. Eficacia de los protectores solares.
Tema 60. La experimentación animal con productos cosméticos. Métodos alternativos aplicables a cosméticos. El Centro Europeo de Validación de Métodos Alternativos.
Tema 61. El expediente de información y la documentación técnica de productos cosméticos. Estructura y contenido. Requisitos de lengua y accesibilidad.
Tema 62. Las garantías de información de los productos cosméticos: Etiquetado e instrucciones de utilización. Nomenclatura de ingredientes cosméticos. Símbolos utilizados en el etiquetado de cosméticos.
Tema 63. Reivindicaciones de los productos cosméticos. Reglamentación sobre criterios de las reivindicaciones y su aplicación.
Tema 64. Efectos no deseados de productos cosméticos. Criterios de evaluación de la causalidad. El Sistema europeo para la notificación de efectos no deseados de cosméticos. Sistema Español de Cosmetovigilancia.
Tema 65. Riesgos para la salud de productos cosméticos. El sistema europeo para el intercambio de información sobre riesgos con cosméticos. Su aplicación en España. Organismos competentes y mecanismos de coordinación.
Tema 66. La reglamentación española de los productos de cuidado personal. Ámbito. Aspectos regulados. El expediente administrativo y la documentación técnica de los productos de cuidado personal: estructura y contenido. Garantías de Información. Garantías de seguridad. Competencias de las Administraciones Públicas.
Tema 67. Requisitos para la fabricación e importación de productos de cuidado personal en España. Obligaciones de los agentes económicos en España en relación con los productos de cuidado personal.
Tema 68. Productos de higiene y estética que tienen la consideración de productos de cuidado personal. Pediculicidas.
Tema 69. Legislación europea sobre sustancias y mezclas químicas peligrosas. Criterios para la clasificación, etiquetado y envasado de las sustancias y mezclas peligrosas.
Tema 70. Legislación europea sobre biocidas. Registro de productos biocidas por procedimientos europeos. Evaluación de la eficacia, frente a los organismos diana, de los biocidas destinados a aplicarse sobre el cuerpo humano y en el área sanitaria.
Tema 71. Reglamentación española vigente sobre biocidas. El expediente administrativo y la documentación técnica de los plaguicidas de uso en higiene personal y los desinfectantes de ambientes clínicos y quirúrgicos. Estructura y contenido. Competencias de las Administraciones Públicas.
Tema 72. Registro Oficial de Establecimientos y Servicios Biocidas. Competencias administrativas. Requisitos para la fabricación, almacenaje e importación de los plaguicidas de uso en higiene personal y los desinfectantes de ambientes clínicos y quirúrgicos.
Tema 73. Productos empleados para la desinfección de la piel sana y de ambientes clínicos y quirúrgicos. Repelentes de insectos. Ensayos de eficacia.
Tema 74. Los Organismos de Normalización. El papel de las normas armonizadas y las monografías de la Farmacopea Europea en productos sanitarios. El papel de las normas armonizadas en la legislación europea de productos cosméticos. Normas europeas y nacionales de cosméticos.
Tema 75. Comercio exterior de productos sanitarios, cosméticos, productos de cuidado personal y biocidas de uso clínico y personal. Actuaciones de la Inspección Farmacéutica en frontera en la importación de los productos.
Área de Farmacovigilancia
Tema 1. Farmacovigilancia: fundamentos y generalidades.
Tema 2. Reacción adversa: concepto, mecanismos y clasificaciones.
Tema 3. Interacciones de medicamentos: mecanismos farmacocinéticos y farmacodinámicos e implicaciones en farmacovigilancia.
Tema 4. Utilidad de la farmacogenómica en farmacovigilancia.
Tema 5. Legislación europea y española de farmacovigilancia.
Tema 6. Obligaciones de los titulares de la autorización de comercialización de los medicamentos en materia de farmacovigilancia.
Tema 7. Guías de Buenas Prácticas de Farmacovigilancia Europeas.
Tema 8. Fuentes de información de utilidad en farmacovigilancia.
Tema 9. Programa de notificación espontánea de sospechas de reacciones adversas. Organización en España y en la Unión Europea. Bases de datos de sospechas de reacciones adversas.
Tema 10. Requisitos para la notificación y trasmisión de sospechas de reacciones adversas.
Tema 11. Terminologías, clasificaciones y estándares de uso en farmacoepidemiología y farmacovigilancia.
Tema 12. Evaluación de casos individuales de sospechas de reacción adversa.
Tema 13. Identificación de riesgos. Concepto de señal y métodos para su detección.
Tema 14. Procedimiento de gestión de señales en la Unión Europea.
Tema 15. Arbitrajes derivados de datos de farmacovigilancia.
Tema 16. Informes periódicos de seguridad.
Tema 17. Planes de gestión de riesgos: concepto, contenido y procedimiento de evaluación.
Tema 18. Procedimiento de toma de decisiones en farmacovigilancia. Comité para la Evaluación de Riesgos en Farmacovigilancia europeo (PRAC) y del Comité de Seguridad de Medicamentos de Uso Humano (CSMH).
Tema 19. Comunicación de riesgos: generalidades, estrategias, métodos y procedimientos.
Tema 20. Medidas de minimización de riesgos y evaluación de su efectividad.
Tema 21. Programas de prevención de embarazo y otras medidas de minimización de riesgo en el embarazo.
Tema 22. Farmacovigilancia de vacunas.
Tema 23. Farmacovigilancia de medicamentos de origen biológico.
Tema 24. Farmacovigilancia en pediatría.
Tema 25. Farmacovigilancia en geriatría.
Tema 26. Errores de medicación. Definición e impacto en farmacovigilancia. Fuentes de errores de medicación y prevención.
Tema 27. Evaluación de la relación beneficio-riesgo posautorización. Generalidades, métodos y estrategias.
Tema 28. Inspecciones y auditorías en farmacovigilancia.
Tema 29. Normativa española sobre estudios observacionales con medicamentos.
Tema 30. Estudios posautorización de seguridad: concepto y bases legales.
Tema 31. Estudios observacionales de efectividad de medicamentos. Estudios de efectividad comparada: Objetivos, diseño, y bases legales.
Tema 32. Farmacoepidemiología: conceptos generales y tipos de diseño.
Tema 33. Metodología del ensayo clínico: Tipos de diseños. Control del error aleatorio y prevención de sesgos.
Tema 34. Ensayos clínicos: Definición de acontecimientos de interés de eficacia y de seguridad. Variables clínicas y subrogadas, variables combinadas. Utilidad del ensayo clínico en farmacovigilancia.
Tema 35. Ensayos clínicos de superioridad y no-inferioridad de eficacia y seguridad. Elección del margen de no-inferioridad. Análisis por protocolo y por intención de tratar. Efecto arrastre.
Tema 36. Fuentes de información para la realización de estudios farmacoepidemiológicos: Fuentes primarias y secundarias. Características y criterios de selección.
Tema 37. Bases de datos sanitarias informatizadas. Tipos de bases de datos. Utilidad en farmacoepidemiología y en farmacovigilancia. Consideraciones al seleccionar la base de datos.
Tema 38. Las bases de datos de historias clínicas electrónicas en Europa y España. La base de datos BIFAP.
Tema 39. Registros de pacientes. Tipos, características y utilidad en farmacoepidemiología.
Tema 40. Estudios de cohortes. Definición, tipos, ventajas, limitaciones, planificación y diseño, sesgos, análisis estadístico.
Tema 41. Estudios de casos y controles. Definición, ventajas, limitaciones, planificación y diseño, sesgos, análisis estadístico.
Tema 42. Estudios híbridos: estudios de casos y controles anidado, estudio caso-cohorte. Definición, ventajas, limitaciones, planificación y diseño, sesgos, análisis estadístico.
Tema 43. Estudios observacionales de solo casos: Estudios de series de casos autocontrolados. Estudios caso-cruzado. Intervalo de riesgo autocontrolado. Definición, ventajas, limitaciones, planificación y diseño, sesgos, análisis estadístico.
Tema 44. Estudios de utilización de medicamentos: Objetivos, fuentes de información, diseños y análisis.
Tema 45. Estudios ecológicos en farmacoepidemiología.
Tema 46. Revisiones sistemáticas y meta-análisis.
Tema 47. Precisión, validez y generalización en los estudios farmacoepidemiológicos.
Tema 48. Sesgos en los estudios farmacoepidemiológicos: tipos y técnicas de detección y control. Factores de confusión. Concepto. Estrategias para controlar el efecto de los factores de confusión en el diseño del estudio y en el análisis.
Tema 49. Evaluación de pruebas diagnósticas. Concepto de sensibilidad, especificidad y valor predictivo. Cribado poblacional.
Tema 50. Buenas Prácticas de Farmacoepidemiología (I). Elaboración de protocolos. Guías internacionales.
Tema 51. Buenas Prácticas de Farmacoepidemiología (II): Preparación de informes finales y publicación de resultados. Guías internacionales.
Tema 52. Medidas de frecuencia de la enfermedad. Razones, proporciones y tasas.
Tema 53. Medidas de asociación e impacto. Medidas de efecto relativo y de efecto absoluto. Medidas de efecto estandarizadas.
Tema 54. Estadística descriptiva. Tipos de variable. Escalas de medida de las variables. Representación gráfica de datos. Estadísticos de centralización y de dispersión.
Tema 55. Análisis estadístico de datos (I): estimación de una población a partir de una muestra. Estimación de una media. Estimación de un porcentaje. Significación estadística. Contraste de hipótesis. Intervalos de confianza.
Tema 56. Análisis estadístico de datos (II): análisis de variables cualitativas y cuantitativas. Análisis de supervivencia. Modelos multivariables.
Tema 57. Reacciones adversas de hipersensibilidad tipo I, II, III, IV. Descripción y ejemplos de fármacos implicados.
Tema 58. Reacciones adversas cutáneas. Descripción y ejemplos de fármacos implicados.
Tema 59. Reacciones adversas autoinmunes. Descripción y ejemplos de fármacos implicados.
Tema 60. Reacciones adversas digestivas. Úlcera gastrointestinal, trastornos del tracto gastrointestinal, daño esofágico, pancreatitis, alteraciones bucofaríngeas. Descripción y ejemplos de fármacos implicados.
Tema 61. Reacciones adversas hepáticas. Descripción y ejemplos de fármacos implicados.
Tema 62. Reacciones adversas respiratorias. Edema pulmonar, fibrosis pulmonar, asma y broncoespasmo. Descripción y ejemplos de fármacos implicados.
Tema 63. Reacciones adversas hematológicas. Eventos tromboembólicos, trombocitopenia, neutropenia, agranulocitosis, anemia. Descripción y ejemplos de fármacos implicados.
Tema 64. Reacciones adversas endocrinas (I). Trastornos metabólicos de la glucosa. Síndrome metabólico y dislipemia. Aumento de peso y obesidad. Descripción y ejemplos de fármacos implicados.
Tema 65. Reacciones adversas endocrinas (II). Enfermedades relacionadas con el eje hipotálamo-hipofisario: Síndrome de Cushing e Insuficiencia adrenal. Hiperprolactinemia. Diabetes insípida y Síndrome de secreción inadecuada de ADH. Alteraciones del tiroides. Disfunción sexual, ginecomastia. Pubertad precoz y alteraciones del crecimiento. Descripción y ejemplos de fármacos implicados.
Tema 66. Reacciones adversas cardiovasculares (I). Hipertensión e hipotensión. Insuficiencia cardíaca. Valvulopatías cardíacas. Descripción y ejemplos de fármacos implicados.
Tema 67. Reacciones adversas cardiovasculares (II). Isquemia miocárdica y síndrome coronario agudo. Descripción y ejemplos de fármacos implicados.
Tema 68. Reacciones adversas cardiovasculares (III). Miocarditis y pericarditis. Trastornos del ritmo cardíaco. Descripción y ejemplos de fármacos implicados.
Tema 69. Reacciones adversas renales. Descripción y ejemplos de fármacos implicados.
Tema 70. Reacciones adversas neurológicas (I). Cefalea, accidentes cerebrovasculares, convulsiones, encefalopatía, leucoencefalopatía. Descripción y ejemplos de fármacos implicados.
Tema 71. Reacciones adversas neurológicas (II). Síndromes extrapiramidales. Síndrome de Guillain Barré y otras neuropatías. Síndrome serotoninérgico. Síndrome neuroléptico maligno. Trastornos neuromusculares. Enfermedades inflamatorias del sistema nervioso. Descripción y ejemplos de fármacos implicados.
Tema 72. Reacciones adversas psiquiátricas. Depresión, psicosis, alteraciones conductuales, alteraciones cognitivas. Reacciones psiquiátricas por retirada del fármaco. Descripción y ejemplos de fármacos implicados.
Tema 73. Reacciones adversas musculo-esqueléticas. Osteoporosis y osteomalacia, osteonecrosis, fracturas atípicas, tendinitis, miopatía. Descripción y ejemplos de fármacos implicados.
Tema 74. Reacciones adversas oftalmológicas y auditivas. Descripción y ejemplos de fármacos implicados.
Tema 75. Efectos de los fármacos sobre el embrión y el feto. Efectos neonatales derivados de la exposición materna a fármacos durante la gestación.
Área de Medicamentos Veterinarios
Tema 1. El Reglamento (UE) 2019/6 del Parlamento Europeo y del Consejo, de 11 de diciembre de 2018, sobre medicamentos veterinarios y por el que se deroga la Directiva 2001/82/CE: consideraciones generales y aspectos que regula.
Tema 2. Real Decreto 1157/2021, de 28 de diciembre, por el que se regulan los medicamentos veterinarios fabricados industrialmente.
Tema 3. Definición de: medicamento veterinario, principio activo, excipiente, forma farmacéutica, fórmula magistral, preparado oficinal, autovacuna, ensayo clínico veterinario, producto en fase de investigación clínica, balance beneficio/riesgo y farmacovigilancia.
Tema 4. El Departamento de Medicamentos Veterinarios: estructura, organización, funciones y relaciones con otros departamentos de la AEMPS.
Tema 5. Comités de apoyo al Departamento de Medicamentos Veterinarios de la AEMPS.
Tema 6. Organismos internacionales relacionados con los medicamentos veterinarios: Agencia Europea de Medicamentos (EMA), Codex Alimentarius, Organización Mundial de Sanidad Animal (OIE), Cooperación internacional sobre armonización de requisitos técnicos para el registro de medicamentos veterinarios (VICH). La Farmacopea Europea.
Tema 7. El procedimiento de autorización: objetivos, admisión a trámite y validación; evaluación y finalización del procedimiento; causas de denegación, suspensión o revocación de la autorización de comercialización. Garantías de confidencialidad.
Tema 8. Los procedimientos para la autorización y registro de medicamentos veterinarios en la Unión Europea y en España (I): Procedimiento centralizado.
Tema 9. Los procedimientos para la autorización y registro de medicamentos veterinarios en la Unión Europea y en España (II): Procedimiento nacional.
Tema 10. Los procedimientos para la autorización y registro de medicamentos veterinarios en la Unión Europea y en España (III): Procedimiento descentralizado y de reconocimiento posterior. Procedimiento de revisión.
Tema 11. Los procedimientos para la autorización y registro de medicamentos veterinarios en la Unión Europea y en España (IV): Procedimiento de reconocimiento mutuo y de reconocimiento posterior. Procedimiento de revisión.
Tema 12. Las solicitudes de autorización de comercialización de medicamentos veterinarios: clases de solicitud y requisitos.
Tema 13. Protección de la documentación técnica en el Reglamento (UE) 2019/6: Características, periodos de protección, y prolongación y periodos adicionales de protección de la documentación técnica.
Tema 14. Armonización de los resúmenes de características de los medicamentos autorizados a nivel nacional según el Reglamento (UE) 2019/6 sobre medicamentos veterinarios: alcance, procedimientos en los medicamentos de referencia y en los genéricos e híbridos, documentación relativa a la seguridad medioambiental y evaluación de los riesgos para el medio ambiente de determinados medicamentos veterinarios.
Tema 15. Mecanismos de información sobre los medicamentos veterinarios implantados en la AEMPS y disponibilidad de los datos para los usuarios. Base de datos europea de medicamentos veterinarios.
Tema 16. Resumen de las características del medicamento, prospecto y etiquetado: garantías de información y contenido de los mismos.
Tema 18. Procedimiento de registro simplificado especial: descripción del procedimiento general para el registro, diferencias según los tipos de medicamentos a los que se aplica, base legal aplicable en cada caso y términos de la autorización.
Tema 19. Comercio paralelo: base legal, requisitos del distribuidor y sus obligaciones, requisitos del medicamento, procedimiento de autorización y resolución. Suspensión, revocación y modificación de las autorizaciones de comercio paralelo.
Tema 20. Medicamentos veterinarios con disposiciones particulares, medicamentos de terapia avanzada, radiofármacos, medicamentos con sustancias psicoactivas, medicamentos de plantas medicinales y homeopáticos.
Tema 21. La distribución de medicamentos veterinarios en España: marco legal, características generales, requisitos, autorización y exigencias de funcionamiento de los mayoristas. Depósitos reguladores.
Tema 22. La dispensación de medicamentos en España: marco legal, características generales. Entidades autorizadas para dispensar medicamentos veterinarios: requisitos, autorización y exigencias de funcionamiento. Venta a distancia de medicamentos veterinarios.
Tema 23. La prescripción de medicamentos veterinarios: marco legal, obligaciones y tipos de prescripción. La receta veterinaria: características y tipos de recetas. El ejercicio profesional del veterinario clínico en materia de medicamentos.
Tema 24. Prescripción y dispensación de medicamentos veterinarios estupefacientes y psicotrópicos: aspectos regulatorios. Control de estupefacientes en veterinaria. Convención Única de 1961 sobre estupefacientes y Convenio de 1971 sobre sustancias psicotrópicas.
Tema 25. Uso de medicamentos al margen de los términos de la autorización de comercialización según el Reglamento (UE) 2019/6 sobre medicamentos veterinarios en especies animales no productoras y productoras de alimentos. Tiempos de espera para medicamentos utilizados al margen de los términos de la autorización de comercialización.
Tema 26. La farmacovigilancia veterinaria: Normativa aplicable, concepto y objetivos. Organización de la farmacovigilancia veterinaria en España. Sistema Español de Farmacovigilancia de Medicamentos Veterinarios. Agentes, obligaciones y funciones de los distintos agentes del sistema.
Tema 27. La farmacovigilancia veterinaria: Fuentes de información, sistema de notificación y bases de datos. Notificación de casos individuales. Obligaciones de notificación. Formatos de notificación.
Tema 28. Archivo maestro del sistema de farmacovigilancia. Responsable de farmacovigilancia. Inspección de los sistemas de farmacovigilancia de los titulares.
Tema 29. Acontecimientos adversos: tipos y clasificación de las reacciones adversas; evaluación de los acontecimientos adversos; adopción de medidas reguladoras en farmacovigilancia veterinaria.
Tema 30. Detección de señales: concepto, características y métodos de análisis de las señales.
Tema 31. La farmacovigilancia veterinaria en la Unión Europea: organización y funciones de la EMA en el ámbito de la farmacovigilancia veterinaria; sistema de alertas de farmacovigilancia veterinaria.
Tema 32. Defectos de calidad de los medicamentos veterinarios: consideraciones generales; aspectos regulatorios; alertas por defectos de calidad.
Tema 33. Sustancias activas de uso farmacéutico. Procedimientos de presentación de la documentación relativa al control de la calidad de las sustancias activas en el expediente de autorización de comercialización de medicamentos veterinarios no biológicos.
Tema 34. Especificaciones y métodos de control de los medicamentos veterinarios no biológicos. Validación de métodos analíticos de control.
Tema 35. Requisitos generales de calidad de los medicamentos veterinarios no biológicos en el expediente de autorización de comercialización.
Tema 36. Fabricación de los medicamentos veterinarios no biológicos. Validación de los métodos de fabricación y controles en el proceso.
Tema 37. Esterilización de medicamentos farmacológicos veterinarios. Tipos, requisitos y normas.
Tema 38. Estudios de estabilidad de los medicamentos farmacológicos veterinarios. Tipos. Diseño de protocolos. Estudios con diseño reducido.
Tema 39. Biodisponibilidad y bioequivalencia. Criterios biofarmacéuticos aplicables durante el desarrollo de medicamentos veterinarios farmacológicos. Clasificación biofarmacéutica. Bioexenciones.
Tema 40. Consideraciones generales sobre la evaluación de la seguridad de los medicamentos veterinarios farmacológicos en sus aspectos de seguridad para el consumidor, para el usuario y para el medio ambiente.
Tema 41. Fundamentos de los estudios toxicológicos agudos, subcrónicos y crónicos requeridos para la evaluación de los efectos tóxicos de los medicamentos veterinarios. Determinación de parámetros toxicológicos para la evaluación de riesgos sanitarios (NOEL, NOAEL, LOAEL, IDA). Utilización de datos toxicológicos en la evaluación de medicamentos veterinarios.
Tema 42. Reglamento (CE) n.º 470/2009, del Parlamento Europeo y del Consejo, de 6 de mayo de 2009, por el que se establecen procedimientos comunitarios para la fijación de los límites de residuos de las sustancias farmacológicamente activas en los alimentos de origen animal. Fijación de los límites máximos de residuos (LMR) y clasificación de las sustancias.
Tema 43. Evaluación de la seguridad en los consumidores: estudios de eliminación de los residuos y fijación de los tiempos de espera. Procedimientos de evaluación de los riesgos y medidas de gestión.
Tema 44. Evaluación del riesgo para los usuarios (profesionales y no profesionales) de los medicamentos veterinarios farmacológicos y medidas de gestión del riesgo: procedimientos de evaluación de los riesgos y medidas de gestión.
Tema 45. Evaluación del riesgo del uso de medicamentos veterinarios farmacológicos para el medio ambiente: procedimientos de evaluación de los riesgos y medidas de gestión.
Tema 46. Evaluación de la seguridad y de los residuos en medicamentos farmacológicos destinados a especies menores. Extrapolación de límites máximos de residuos y de los tiempos de espera.
Tema 47. Riesgos ambientales de los medicamentos veterinarios: El Plan Estratégico de Medicamentos en el Medio Ambiente de la Unión Europea; Resistencias a antimicrobianos en el medio ambiente. Evaluación del Riesgo Ambiental (ERA) de medicamentos farmacológicos: Principios del análisis de riesgos de sustancias químicas; metodología y armonización internacional de la ERA; medidas de mitigación de riesgos.
Tema 48. La estadística. La variabilidad en las ciencias biológicas. Conceptos de población y muestra. Tipos y métodos de muestreo. La probabilidad. Distribución normal, binomial y de Poisson. Estadística analítica. La inferencia estadística. Métodos de estimación. El contraste de hipótesis y el valor de «p». La distribución Chi-cuadrado. La correlación lineal. La regresión lineal.
Tema 49. Estadística descriptiva. Variables continuas y discretas. Distribución de frecuencias. Representación gráfica. Medidas de centralización y de dispersión.
Tema 50. Epidemiología: conceptos generales. Antecedentes históricos. Objetivos. Epidemiología general de las enfermedades trasmisibles. Precisión, validez y generalización en los estudios epidemiológicos. Sesgos: Concepto, prevención y control.
Tema 51. El Plan Nacional para la Investigación de Residuos en animales vivos y sus productos (PNIR). Ejecución y valoración. Normativa aplicable.
Tema 52. Consideraciones generales sobre la evaluación de la eficacia de los medicamentos veterinarios en su procedimiento de autorización.
Tema 53. Evaluación del margen de seguridad en la dosificación de un medicamento veterinario en la especie de destino. Tolerancia sistémica y local en las diferentes especies animales.
Tema 54. Los ensayos clínicos con medicamentos veterinarios: objetivos, metodología, interpretación de resultados, requisitos para su realización y normas de buenas prácticas clínicas (BPC). Productos en fase de investigación clínica veterinaria.
Tema 55. Conceptos de inmunidad innata y adquirida, humoral y celular. Aplicación en el desarrollo de productos biológicos inmunológicos y no inmunológicos. Tipos de medicamentos veterinarios biológicos (inmunológicos y no inmunológicos).
Tema 56. Evaluación de la calidad de los medicamentos biológicos (inmunológicos y no inmunológicos) veterinarios. Aspectos técnicos y regulatorios de la fabricación y control.
Tema 57. Adyuvantes, conservantes, métodos de inactivación y métodos de esterilización en los medicamentos inmunológicos veterinarios.
Tema 58. Evaluación de la seguridad de los medicamentos inmunológicos veterinarios inmunológicos. Aspectos técnicos y regulatorios.
Tema 59. Evaluación de la eficacia de los medicamentos inmunológicos veterinarios. Ensayos clínicos veterinarios con medicamentos inmunológicos: características y aspectos regulatorios.
Tema 60. Evaluación de la seguridad y eficacia de los medicamentos veterinarios biológicos no inmunológicos. Aspectos técnicos y regulatorios.
Tema 61. Medicamentos veterinarios a base de organismos modificados genéticamente: aspectos técnicos y regulatorios específicos.
Tema 62. Medicamentos veterinarios para nuevas terapias: tipos; aspectos técnicos y regulatorios específicos.
Tema 63. Los medicamentos veterinarios antimicrobianos: clasificación; principios generales para la evaluación de la eficacia; mecanismos de acción; principales mecanismos de resistencia y principales problemas relacionados con ellas.
Tema 64. Principales líneas estratégicas en sanidad animal desarrolladas en el marco del el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN): consideraciones generales y objetivos.
Tema 65. Comunicación de ventas y uso de antimicrobianos: obligaciones, modos de comunicación y calendarios, según se establece en el Reglamento (UE) 2019/6, Reglamentos Delegados (UE) 2021/578 y (UE) 2022/209 y Real Decreto 666/2023.
Tema 66. Programas de reducción del uso de antibióticos en sanidad animal. Objetivos de los programas de reducción de antibióticos por especies. Planes sanitarios preventivos que permitan la reducción del uso de los antibióticos. Concepto de bioseguridad.
Tema 67. El Reglamento (UE) 2019/4 del Parlamento Europeo y del Consejo, de 11 de diciembre de 2018, relativo a la fabricación, la comercialización y el uso de piensos medicamentosos y por el que se derogan el Reglamento (CE) n.º 183/2005 del Parlamento Europeo y del Consejo y la Directiva 90/167/CEE del Consejo: consideraciones generales y aspectos que regula.
Tema 68. Las premezclas medicamentosas y los medicamentos veterinarios administrados por vía oral. Requisitos técnicos de calidad. Aspectos científicos y regulatorios.
Tema 69. Autorizaciones de comercialización en mercados limitados y en circunstancias excepcionales en el Reglamento (UE) 2019/6 sobre medicamentos veterinarios: Características, términos de la autorización y validez de la autorización. Su problemática e implicaciones en el sector ganadero. Problemas relativos a la disponibilidad de medicamentos veterinarios.
Tema 70. Medicamentos veterinarios destinados a abejas: características y particularidades sobre la calidad, la seguridad y la eficacia. Terapia en abejas y particularidades relacionadas con su ciclo vital.
Tema 71. Cunicultura, especies cinegéticas y otras producciones alternativas: sistemas de producción, características e importancia económica, características diferenciales con el resto de la Unión Europea. Particularidades de los medicamentos veterinarios destinados a estas especies.
Tema 72. Medicamentos veterinarios destinados a especies acuáticas: características y particularidades sobre la calidad, la seguridad y la eficacia. Uso en acuicultura marina y acuicultura continental.
Tema 73. Desabastecimiento de los medicamentos veterinarios: marco legal, procedimiento de comunicación y actuaciones administrativas de la Agencia Española de Medicamentos y Productos Sanitarios. Implicaciones en el sector ganadero.
Tema 74. Comercio exterior de los medicamentos veterinarios: Consideraciones generales. Normativa. Actuaciones de la Agencia Española de Medicamentos y Productos Sanitarios en materia de comercio exterior.
Tema 75. Salud Pública. Conceptos básicos. Veterinaria de Salud Pública. Concepto «One Health».
Área de Inspección y control de medicamentos
Tema 1. Laboratorios farmacéuticos y fabricantes de principios activos. Régimen de autorización, inspecciones y certificación, procedimientos y formatos de la Unión Europea. Sistema de calidad de servicios de inspección.
Tema 2. Normas de correcta fabricación de medicamentos de la Unión Europea (I): Requisitos básicos para los medicamentos: Sistema de calidad farmacéutico, Personal, Documentación, Reclamaciones, defectos de calidad y retiradas. Autoinspección.
Tema 3. Normas de correcta fabricación de medicamentos de la Unión Europea (II): Requisitos básicos para los medicamentos: Locales y Equipos, Producción, Control de calidad y actividades subcontratadas.
Tema 4. Normas de correcta fabricación aplicables a la fabricación de medicamentos estériles. Procesos de esterilización.
Tema 5. Normas de correcta fabricación de sustancias activas biológicas y medicamentos biológicos de uso humano.
Tema 6. Normas de correcta fabricación de radiofármacos. Normas de correcta fabricación de medicamentos a base de plantas.
Tema 7. Normas de correcta fabricación de medicamentos veterinarios. Inmunológicos y no inmunológicos.
Tema 8. Normas de correcta fabricación de gases medicinales. Tecnologías empleadas en su producción y control de calidad.
Tema 9. Toma de muestras de materiales de partida y de acondicionamiento. Muestras de referencia y muestras de retención. Control de materiales de partida y cadena de suministro.
Tema 10. Normas de correcta fabricación de líquidos, cremas y pomadas. Normas de correcta fabricación de medicamentos en aerosol presurizado con dosificador para inhalación.
Tema 11. Sistemas informatizados y las normas de correcta fabricación. Validación de los sistemas informatizados e integridad de datos. Normas de referencia.
Tema 12. Uso de las radiaciones ionizantes en la fabricación de medicamentos. Normas de referencia.
Tema 13. Normas de correcta fabricación de medicamentos en investigación.
Tema 14. Normas de correcta fabricación de medicamentos derivados de la sangre o el plasma humano. Normativa de calidad aplicable a la extracción, tratamiento y distribución de componentes de sangre destinados a fabricación de medicamentos.
Tema 15. Cualificación y validación aplicables a las instalaciones, los equipos, los servicios y los procesos utilizados para la fabricación de medicamentos.
Tema 16. Certificación por la persona cualificada y liberación de lotes. Normas de correcta fabricación sobre importación de medicamentos
Tema 17. Ensayos de liberación a tiempo real y liberación paramétrica. Tecnología Analítica de Procesos y Calidad por diseño. Fabricación en continuo de medicamentos y principios activos.
Tema 18. Sistema de calidad farmacéutico. ICH Q10. Gestión del conocimiento. Gestión de riesgos para la calidad. ICH Q9.
Tema 19. Convenio de Cooperación de Inspección Farmacéutica (PIC/S). Estructura, misión y actividades. Procedimiento de adhesión. Guías y otros documentos. Acuerdos de reconocimiento mutuo.
Tema 20. Fabricación de distintos medicamentos en instalaciones compartidas. Riesgos asociados y medidas de control de riesgo. Validación de la limpieza.
Tema 21. Normas de correcta fabricación de principios activos de la Unión Europea.
Tema 22. Buenas prácticas de distribución de principios activos de la Unión Europea.
Tema 23. Directrices para la evaluación del riesgo para determinar las normas de correcta fabricación apropiadas para excipientes para medicamentos de uso humano.
Tema 24. Inspecciones y certificación de cumplimiento de normas de correcta fabricación. Directrices sobre los principios aplicables a las inspecciones: Recopilación de procedimientos de la Unión Europea sobre inspecciones e intercambio de información. Sistema de calidad de inspección y cualificación de inspectores. Bases de datos de la Agencia Europea de Medicamentos.
Tema 25. Las fórmulas magistrales y preparados oficinales. El Formulario Nacional. Normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales.
Tema 26. La distribución de medicamentos en la Unión Europea y su regulación en España. Normativa aplicable. Distribuidores de medicamentos y su autorización.
Tema 27. Buenas prácticas de distribución de medicamentos de la Unión Europea.
Tema 28. Comercio exterior de medicamentos y principios activos empleados en la fabricación de medicamentos.
Tema 29. Medicamentos e Internet: regulación de la venta de medicamentos a distancia a través de servicios de la sociedad de la información. Venta ilegal de medicamentos a través de Internet.
Tema 30. La lucha frente a los medicamentos falsificados en la Unión Europea y en España. Normativa para la prevención de la entrada de medicamentos falsificados en la cadena de suministro legal. El Reglamento Delegado (UE) 2016/161 de la Comisión y normativa adicional aplicable. El sistema de repositorios de dispositivos de seguridad.
Tema 31. Los procedimientos para la autorización y registro de medicamentos en la Unión Europea y en España.
Tema 32. Desarrollo y fabricación de sustancias activas. ICH Q11. Gestión del ciclo de vida del medicamento. ICH Q12.
Tema 33. Titulares de autorización de comercialización y sus obligaciones: garantías de abastecimiento de medicamentos en el mercado. Investigación de defectos de calidad de medicamentos y medidas derivadas. Problemas de suministro y actuaciones europeas y nacionales.
Tema 34. La autorización de medicamentos con condiciones especiales respecto a su prescripción y dispensación. Disponibilidad de medicamentos en situaciones especiales.
Tema 35. Los medicamentos veterinarios. Rasgos diferenciales en la reglamentación europea y española respecto de los medicamentos de uso humano. Límites máximos de residuos. Regulación europea.
Tema 36. Los medicamentos hemoderivados. Los medicamentos inmunológicos. Los medicamentos radiofármacos. Los medicamentos huérfanos. Normativa y aspectos diferenciales.
Tema 37. Los medicamentos de terapias avanzadas. Normativa aplicable. Directrices sobre normas de correcta fabricación de medicamentos de terapia avanzada.
Tema 38. La Farmacopea Europea. Aplicación al control de medicamentos y sustancias de uso farmacéutico. Otras Farmacopeas.
Tema 39. Agua para uso farmacéutico, tecnologías y procesos de producción. Normativa aplicable.
Tema 40. Validación de métodos analíticos. Nomenclatura y metodología. Normas de referencia aplicables a medicamentos.
Tema 41. Estudios de estabilidad de sustancias activas y medicamentos. Tipos. Diseño de protocolos. Estudios con muestreo reducido. Análisis estadístico de resultados. Normativa de referencia. Estabilidad en curso.
Tema 42. Sistemas transdérmicos y de implantación: Desarrollo y tecnologías de elaboración. Especificaciones. Métodos de control.
Tema 43. Medicamentos para inhalación. Desarrollo y tecnologías de elaboración. Validación del proceso de producción. Especificaciones. Métodos de control.
Tema 44. Tecnologías aplicadas a la obtención de formas sólidas. Desarrollo. Validación del proceso de producción. Especificaciones. Métodos de control.
Tema 45. Desarrollo y fabricación de medicamentos parenterales y oftálmicos. Normas de referencia. Especificaciones. Métodos de control.
Tema 46. Formas semisólidas y líquidas: desarrollo y tecnologías de elaboración. Especificaciones. Métodos de control.
Tema 47. El envase primario y material de acondicionamiento. Materiales de partida. Control de calidad. Normativa de referencia.
Tema 48. Técnicas analíticas utilizadas para la identificación y cuantificación de componentes en medicamentos y en sustancias de uso farmacéutico.
Tema 49. Control de la esterilidad de los medicamentos. Calidad microbiológica de los medicamentos no estériles. Métodos de control según Farmacopea Europea.
Tema 50. Inspección y control de medicamentos y sustancias estupefacientes. Normativa aplicable.
Tema 51. Inspección y control de medicamentos y sustancias psicotrópicas. Normativa aplicable.
Tema 52. La prescripción y dispensación de medicamentos y sustancias estupefacientes. Real Decreto 1675/2012, de 14 de diciembre, por el que se regulan las recetas oficiales y los requisitos especiales de prescripción y dispensación de estupefacientes para uso humano y veterinario.
Tema 53. Métodos recomendados por la Oficina de las Naciones Unidas contra la Droga y el Delito (ONUDD) para el muestreo, identificación y análisis de drogas procedentes del tráfico ilícito. Actuaciones periciales en el análisis de sustancias procedentes de tráfico ilícito: recepción, muestreo, análisis, custodia y destrucción de alijos.
Tema 54. Organismos nacionales e internacionales encargados del control y la fiscalización de sustancias y medicamentos estupefacientes y psicótropos. La Comisión de Estupefacientes y la Junta Internacional de Fiscalización de Estupefacientes (JIFE).
Tema 55. El Plan Nacional sobre Drogas y el Sistema Español de Alerta Temprana. Nuevas sustancias psicoactivas.
Tema 56. Los servicios periféricos de inspección farmacéutica: organización y funciones. El Comité de Coordinación de Servicios Farmacéuticos Periféricos.
Tema 57. Seguimiento de la calidad del medicamento comercializado, toma de muestras y análisis. Actuaciones ante defectos de calidad.
Tema 58. Buenas prácticas de laboratorio. Calidad de los estudios no clínicos de seguridad sanitaria.
Tema 59. Estudios preclínicos de medicamentos. Estudios de farmacología y farmacocinética. Estudios de toxicología. Toxicidad a dosis única y repetida. Estudios de genotoxicidad, carcinogenicidad y toxicidad en la reproducción.
Tema 60. Bases legales de la investigación con seres humanos o con materiales de procedencia humana en España. La Ley de Investigación Biomédica.
Tema 61. Los ensayos clínicos con medicamentos: normativa aplicable y sistemas de información. Comités de Ética de la Investigación con medicamentos; normativa y acreditación.
Tema 62. Aspectos metodológicos de los ensayos clínicos en sujetos sanos y pacientes. Diseño, desarrollo y evaluación de ensayos clínicos. Novedades metodológicas en ensayos clínicos. Elementos descentralizados.
Tema 63. Las Normas de Buena Práctica Clínica. ICH E6 R2. Coordinación en la Unión Europea y con otros organismos internacionales en materia de buena práctica clínica. Gestión de incumplimientos graves.
Tema 64. Inspecciones de ensayos clínicos: objetivos y procedimientos de inspección.
Tema 65. Inspección de los aspectos clínicos y analíticos de los ensayos de Fase I de bioequivalencia.
Tema 66. Inspecciones de sistemas electrónicos utilizados en ensayos clínicos. Cuadernos de recogida de datos electrónicos y base de datos. Validación.
Tema 67. Farmacovigilancia: Concepto y objetivos. Estructura, organización y funcionamiento de la farmacovigilancia en España. Normativa aplicable. Coordinación en la Unión Europea y con otros organismos internacionales en materia de farmacovigilancia. Obligaciones en farmacovigilancia de los titulares de autorización de comercialización.
Tema 68. Buenas Prácticas de Farmacovigilancia Europeas. Inspecciones de farmacovigilancia: objetivos, criterios de priorización del riesgo. Procedimientos de inspección.
Tema 69. Archivo maestro de farmacovigilancia. Definición y estructura, componentes. Informes periódicos de seguridad: concepto y contenido.
Tema 70. Gestión de sospechas de reacciones adversas. Bases de datos.
Tema 71. Planes de gestión de riesgos, concepto y contenido.
Tema 72. Ficha técnica y prospecto: actualizaciones por motivos de seguridad.
Tema 73. Obligaciones en farmacovigilancia de los titulares de autorización de comercialización.
Tema 74. Estudios postautorización de seguridad y de eficacia: concepto y bases legales.
Tema 75. Inspecciones de farmacovigilancia: objetivos, criterios de priorización del riesgo. Procedimientos de inspección.
Área de Química y Tecnología Farmacéutica
Tema 1. Estructura y contenido del módulo 3 del expediente de registro de un medicamento.
Tema 2. Procedimiento centralizado de autorización de medicamentos. Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos. Estructura y funciones.
Tema 3. Procedimiento de reconocimiento mutuo y procedimiento descentralizado de autorización de medicamentos. El Grupo de Coordinación de procedimientos de reconocimiento mutuo y descentralizado. Estructura y funciones.
Tema 4. Procedimiento nacional de autorización de medicamentos. El Comité de Medicamentos de Uso Humano de la Agencia Española de Medicamentos y Productos Sanitarios. Estructura y funciones.
Tema 5. Procedimiento de modificación de las autorizaciones de comercialización de medicamentos de uso humano. Procedimientos de modificación de importancia mayor y de importancia menor. Agrupación de modificaciones. Extensiones de la autorización de comercialización.
Tema 6. Consejo Internacional para la Armonización de Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH). Historia, estructura y procesos de armonización.
Tema 7. Guías de calidad europeas (CHMP) e ICH. Importancia en la regulación de medicamentos.
Tema 8. Farmacopea Europea. Aplicación al control de medicamentos y sustancias de uso farmacéutico. Otras Farmacopeas. Armonización.
Tema 9. Procedimiento ASMF. Utilización en solicitudes de autorización de comercialización de medicamentos de uso humano. Normativa aplicable.
Tema 10. Certificado de Conformidad con las monografías de la Farmacopea Europea (CEP). Utilización en solicitudes de autorización de comercialización de medicamentos de uso humano. Normativa aplicable.
Tema 11. Procesos de fabricación de sustancias activas de uso farmacéutico. Materiales de partida, reactivos, disolventes y catalizadores. Identificación de los pasos críticos de un proceso de fabricación. Intermedios de reacción.
Tema 12. Normas de correcta fabricación de medicamentos de la Unión Europea. Parte I: Requisitos básicos para medicamentos. Parte II: Requisitos básicos para sustancias activas.
Tema 13. Péptidos y oligonucleótidos. Síntesis, caracterización y control de impurezas
Tema 14. Isomería estructural y estereoisomería. Tipos. Selección en función de su actividad terapéutica. Técnicas para su separación e identificación.
Tema 15. Polimorfismo, pseudopolimorfismo. Técnicas para su identificación. Relevancia en la fabricación de medicamentos.
Tema 16. Especificaciones de sustancias activas de uso farmacéutico: Definición, establecimiento y justificación de los criterios de aceptación y selección de los métodos de ensayo.
Tema 17. Impurezas en las sustancias activas de uso farmacéutico y medicamentos. Clasificación de impurezas. Normativa. Métodos de control.
Tema 18. Impurezas mutagénicas en medicamentos. Clasificación. Control. Nitrosaminas. Exigencias regulatorias
Tema 19. Clasificación biofarmacéutica. Relevancia en el desarrollo, producción y control de calidad de medicamentos.
Tema 20. Estudios de preformulación y desarrollo farmacéutico.
Tema 21. Calidad por diseño. Guías ICH Q8, Q9, Q10 y Q11.
Tema 22. Biodisponibilidad y bioequivalencia. Concepto. Tipos de estudios. Correlaciones in vivo-in vitro. Criterios aplicables al diseño y evaluación de la calidad de medicamentos.
Tema 23. Esterilización de medicamentos, sustancias activas, excipientes y envase primario en el ámbito farmacéutico.
Tema 24. Calidad microbiológica de medicamentos no estériles. Métodos de control. Ensayo de eficacia del conservante.
Tema 25. Excipientes de uso farmacéutico. Normativa aplicable.
Tema 26. Agua para uso farmacéutico. Normativa aplicable.
Tema 27. Fórmulas magistrales y preparados oficinales. El Formulario Nacional. Normativa aplicable.
Tema 28. Especificaciones de medicamentos. Definición, establecimiento y justificación de los criterios de aceptación y selección de los procedimientos de ensayo.
Tema 29. Validación de métodos analíticos. Nomenclatura y metodología. Normas de referencia aplicables a medicamentos.
Tema 30. El envase primario. Tipos de envases. Control de calidad. Normativa de referencia. Dispositivos para la administración de medicamentos.
Tema 31. Estudios de estabilidad de sustancias activas y medicamentos. Tipos. Diseño de protocolos. Estudios con muestreo reducido. Análisis estadístico de resultados. Normativa de referencia.
Tema 32. Formas farmacéuticas sólidas orales de liberación inmediata. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 33. Formas farmacéuticas sólidas orales de liberación modificada. Tipos. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 34. Formas farmacéuticas semisólidas y líquidas no estériles. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 35. Medicamentos parenterales y oftálmicos. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 36. Sistemas transdérmicos e implantes. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 37. Medicamentos para inhalación. Desarrollo. Fabricación. Validación de proceso de fabricación. Especificaciones.
Tema 38. Liposomas. Soluciones micelares. Nanopartículas. Desarrollo. Fabricación. Especificaciones.
Tema 39. Radiofármacos. Desarrollo farmacéutico. Fabricación. Control de calidad. Estabilidad. Normativa de referencia.
Tema 40. Gases medicinales. Tipos. Normativa aplicable.
Tema 41. Calidad de medicamentos y su relación con la seguridad y eficacia. Factores determinantes. Normas de referencia.
Tema 42. Calidad de medicamentos a base de plantas medicinales. Normativa específica aplicable.
Tema 43. Calidad de los medicamentos en investigación. Requisitos de la documentación química-farmacéutica para los ensayos fase I, fase II y fase III. Modificaciones relevantes. Normativa aplicable.
Tema 44. Ficha Técnica y prospecto: secciones relacionadas con la información del módulo 3 del dossier de registro. Términos estándar. Excipientes de declaración obligatoria. Normativa aplicable.
Tema 45. Red Europea de Laboratorios Oficiales de Control de Medicamentos. Principales actividades. Programas de control de medicamentos comercializados en Europa.
Tema 46. Requisitos generales relativos a la competencia de los laboratorios de ensayo y calibración. La norma UNE EN ISO/IEC/17025. Laboratorios de ensayo acreditados. Entidad Nacional de Acreditación (ENAC).
Tema 47. Seguridad en el laboratorio de ensayo. Riesgos específicos en agentes químicos y su prevención. Criterios para la evaluación de riesgos. Información del etiquetado.
Tema 48. Proceso de evaluación del cumplimiento de los requisitos de acreditación, por parte de ENAC. Definición y clasificación de «No conformidades» Elaboración del plan de acciones correctivas.
Tema 49. Gestión de equipos en el sistema de calidad del laboratorio de ensayo. Actividades de calibración, mantenimiento y verificación de equipos. Planes y programas para la realización y control de estas actividades.
Tema 50. Cualificación de equipos: Calibración. Normativa aplicable.
Tema 51. Materiales de referencia. Terminología y definiciones. Trazabilidad. Requerimientos y uso.
Tema 52. Requisitos de validación aplicables a los métodos analíticos utilizados en un Laboratorio Oficial de Control, según recomendaciones de la Dirección Europea de Calidad del Medicamento (EDQM).
Tema 53. Estimación y aplicación de incertidumbres en medidas analíticas. Evaluación e informe de resultados de ensayos. Criterios de aceptación y rechazo. Normativa aplicable.
Tema 54. Aseguramiento de la validez de los resultados de ensayo: intercomparaciones. Aspectos a evaluar en la participación de ejercicios de intercomparación. Actuaciones ante la obtención de resultados no satisfactorios.
Tema 55. Técnicas analíticas utilizadas para la identificación y cuantificación de sustancias activas en medicamentos.
Tema 56. Medicamentos ilegales. Estrategia analítica y técnicas a utilizar. Validación analítica en relación con el objetivo del ensayo.
Tema 57. Ensayos farmacotécnicos y su utilización en el control de medicamentos.
Tema 58. Ensayo de disolución: Desarrollo y validación. Aplicaciones al diseño de fármacos. Especificaciones. Normativa aplicable.
Tema 59. Métodos potenciométricos de análisis. Tipos de electrodos. Determinación del pH. Valoraciones potenciométricas.
Tema 60. Electroforesis e isoelectroenfoque. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 61. Análisis térmico diferencial. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 62. Calorimetría diferencial de barrido Fundamento y aplicación en el control de medicamentos.
Tema 63. Análisis termogravimétrico. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 64. Técnicas analíticas de rayos-X. Fluorescencia y difracción. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 65. Técnicas analíticas de fluorescencia molecular. Tipos. Fundamento y aplicación en el control de medicamentos.
Tema 66. Espectrometría de absorción atómica. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 67. Espectrometría de emisión de plasma. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 68. Métodos cromatográficos de análisis. Principios generales. Parámetros fundamentales. Aplicación en el control de medicamentos.
Tema 69. Cromatografía líquida de alta resolución. Componentes básicos de los equipos. Aplicaciones al análisis cualitativo y cuantitativo de medicamentos.
Tema 70. Cromatografía de gases. Componentes básicos de los equipos. Aplicación en el control de medicamentos.
Tema 71. Espectrofotometría ultravioleta y visible. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 72. Espectrofotometría de infrarrojo. Tipos. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Tema 73. Espectrofotometría de infrarrojo cercano (NIR). Componentes básicos de los equipos. Desarrollo, calibración y validación. Fundamento y aplicación en el control de medicamentos.
Tema 74. Espectrometría de masas. Componentes básicos de los equipos. Espectro de masas. Análisis cuantitativo y cualitativo. Aplicación en el control de medicamentos.
Tema 75. Espectroscopia de Resonancia Magnética Nuclear. Tipos. Componentes básicos de los equipos. Fundamento y aplicación en el control de medicamentos.
Área de Medicamentos biológicos
Tema 1. Clonaje de genes. Estrategias, identificación, aislamiento.
Tema 2. Ácidos nucleicos, el código genético y la síntesis de macromoléculas.
Tema 3. Membrana Celular. Organización subcelular de células eucarióticas y procariotas.
Tema 4. El genoma humano: genes y cromosomas.
Tema 5. Plasma rico en plaquetas: aspectos científicos y regulatorios.
Tema 6. Métodos de transferencia de genes a células de mamífero.
Tema 7. PCR. Técnicas y Áreas científicas de utilización.
Tema 8. Animales y plantas transgénicos.
Tema 9. Aplicaciones biotecnológicas de los animales y plantas transgénicos.
Tema 10. Regulación de la respuesta inmune.
Tema 11. El sistema linfoide.
Tema 12. Reconocimiento antigénico.
Tema 13. Inmunidad humoral y celular.
Tema 14. Inmunidad e infección.
Tema 15. Inmunidad frente a virus.
Tema 16. Cáncer. Aspectos biológicos básicos.
Tema 17. Cáncer y sistema inmune.
Tema 18. Inmunogenicidad de proteínas terapéuticas.
Tema 19. Anticuerpos monoclonales. Aplicaciones terapéuticas.
Tema 20. Fraccionamiento industrial del plasma.
Tema 21. Inmunoglobulinas intravenosas producción, especificaciones y uso.
Tema 22. Factores de coagulación obtenidos por fraccionamiento y por ingeniería genética.
Tema 23. Características desde el punto de vista de la calidad de los productos biotecnológicos evaluados en los procedimientos Centralizados hasta la actualidad. El caso de los anticuerpos monoclonales.
Tema 24. Características desde el punto de vista de la calidad de los productos biotecnológicos evaluados en los procedimientos Centralizados hasta la actualidad. El caso de los interferones.
Tema 25. Características desde el punto de vista de la calidad de los productos biotecnológicos evaluados en los procedimientos Centralizados hasta la actualidad. El caso de las vacunas.
Tema 26. Características desde el punto de vista de la calidad de los productos biotecnológicos evaluados en los procedimientos Centralizados hasta la actualidad. El caso de los productos de terapia génica.
Tema 27. Medicamentos biotecnológicos. Producción y control de calidad. Aspectos regulatorios.
Tema 28. Regulación de terapias avanzadas. Ensayos clínicos.
Tema 29. Regulación de terapias avanzadas. Autorización de comercialización para medicamentos de fabricación industrial.
Tema 30. Regulación de terapias avanzadas. Autorización de comercialización para medicamentos de fabricación no industrial.
Tema 31. Terapia génica. Aspectos científicos.
Tema 32. Terapia génica. Aspectos regulatorios.
Tema 33. Terapia celular somática e ingeniería de tejidos. Productos combinados. Aspectos científicos y regulatorios.
Tema 34. Medicamentos basados en células modificadas genéticamente. Aspectos de calidad.
Tema 35. Organismos modificados genéticamente.
Tema 36. Evaluación de riesgo ambiental de los medicamentos modificados genéticamente.
Tema 37. Producción de medicamentos biotecnológicos en plantas. Aspectos científicos y regulatorios.
Tema 38. Control de calidad de medicamentos biotecnológicos. Validación de procesos de producción. Especificaciones.
Tema 39. Medicamentos biosimilares. Aspectos regulatorios.
Tema 40. Estudios de comparabilidad de medicamentos biotecnológicos. Aspectos científicos y regulatorios.
Tema 41. Estabilidad de medicamentos biotecnológicos.
Tema 42. Encefalopatías espongiformes transmisibles. Aspectos científicos y regulatorios.
Tema 43. Materiales susceptibles de transmitir encefalopatías espongiformes. Regulación en su utilización en la fabricación de medicamentos.
Tema 44. Seguridad de materiales de origen biológico empleados en la fabricación de medicamentos.
Tema 45. Seguridad viral de los medicamentos. Diseño y realización de los estudios de seguridad viral para la autorización de los medicamentos. Aspectos técnicos, científicos y regulatorios.
Tema 46. Seguridad viral de productos biotecnológicos. Aspectos científicos, técnicos y regulatorios.
Tema 47. Seguridad viral de productos biotecnológicos en fase de ensayos clínicos. Aspectos científicos, técnicos y regulatorios.
Tema 48. Vacunas antigripales estacionales: Composición, uso y aspectos regulatorios de autorización y actualización anual.
Tema 49. Aspectos biológicos y farmacéuticos de vacunas combinadas.
Tema 50. Criterios de calidad y seguridad de sangre humana y componentes.
Tema 51. Plasma Master File. Aspectos técnicos, científicos y regulatorios.
Tema 52. Autorización de Hemoderivados. Aspectos científicos, técnicos y regulatorios. Seguridad Viral.
Tema 53. Enfermedad de Creutzfeldt-Jakob, variante de Creutzfeldt-Jakob y hemoderivados. Aspectos técnicos, científicos y regulatorios.
Tema 54. Tipos y utilización de vacunas de uso humano empleadas en calendarios de vacunación. El caso de la polio.
Tema 55. Tipos y utilización de vacunas de uso humano empleadas en calendarios de vacunación. El caso de las vacunas de la rubeola, sarampión, parotiditis.
Tema 56. Tipos y utilización de vacunas de uso humano empleadas en calendarios de vacunación. El caso de las vacunas de tétanos, difteria y tos ferina.
Tema 57. Tipos y utilización de vacunas de uso humano utilizadas en el calendario de vacunación. El caso de la vacuna de meningitis C.
Tema 58. Tipos y utilización de vacuna de uso humano empleadas en calendario de vacunación. El caso de la vacuna de la hepatitis B.
Tema 59. Liberación previa de lotes de vacunas. El papel de la red de Laboratorios Oficiales de control.
Tema 60. Liberación previa de lotes de hemoderivados. El papel de la red de Laboratorios Oficiales de control.
Tema 61. Elementos esenciales en la organización de un Laboratorio Oficial de Control referidos a su sistema de Garantía de Calidad.
Tema 62. Regulación de medicamentos de uso humano a base de alérgenos.
Tema 63. Control de la esterilidad de los medicamentos. Métodos de control según Farmacopea Europea.
Tema 64. Calidad microbiológica de los medicamentos no estériles. Métodos de control según Farmacopea Europea: métodos de recuento de microorganismos, métodos de investigación de microorganismos específicos.
Tema 65. Detección de endotoxinas en medicamentos. Métodos de control según Farmacopea Europea.
Tema 66. Procedimiento de evaluación de aspectos Químicos y Farmacéuticos (documentación de calidad, correspondiente a Módulo3) de trámites de registro y variaciones de medicamentos antimicrobianos, elaborados a partir de principios activos obtenidos por fermentación. Aspectos más relevantes. Normas y directrices de referencia.
Tema 67. Procedimiento de evaluación de aspectos Químicos y Farmacéuticos (documentación de calidad, correspondiente a Módulo3) de Registros y Variaciones de autorización de medicamentos antimicrobianos, elaborados a partir de principios activos obtenidos mediante síntesis química. Aspectos más relevantes. Normas y directrices de referencia.
Tema 68. Procedimiento de evaluación de aspectos Químicos y Farmacéuticos (documentación de calidad, correspondiente a Módulo3) de medicamentos antimicrobianos empleados en ensayos clínicos. Aspectos más relevantes. Normas y directrices de referencia.
Tema 69. Desarrollo y fabricación de medicamentos parenterales y oftálmicos con antimicrobianos. Aspectos más relevantes. Selección de procesos de esterilización. Validación. Liberación paramétrica. Normas y directrices de referencia.
Tema 70. Desarrollo y fabricación de medicamentos orales con antimicrobianos. Aspectos más relevantes. Validación. Normas y directrices de referencia.
Tema 71. Desarrollo y fabricación de medicamentos antimicrobianos de administración/uso local. Tecnologías aplicadas a la obtención de formas semisólidas de antimicrobianos. Aspectos más relevantes. Normas y directrices de referencia.
Tema 72. El envase primario. Aspectos más relevantes. Materiales de partida. Control de calidad. Normas y directrices de referencia. Estudios de estabilidad con principios activos y medicamentos de antimicrobianos. Aspectos más relevantes. Normas y directrices de referencia.
Tema 73. Validación y transferencia de procedimientos de ensayo (fisicoquímicos y microbiológicos) de antimicrobianos. Aspectos más relevantes del control de materias primas y medicamentos de antimicrobianos. Normas y directrices de referencia.
Tema 74. Aspectos generales de calidad de las vacunas frente a la enfermedad COVID-19 aprobadas hasta la fecha en la Unión Europea.
Tema 75. Vacunas mRNA de uso humano. Diseño, fabricación y experiencia de uso.
Área de Vigilancia en Salud Pública, Sistemas de Información Sanitaria y Cartera Común
Tema 1. Las Encuestas Nacionales de Salud y otras encuestas relacionadas con la salud en España. Principales contenidos y utilidades.
Tema 2. Demografía y Salud Pública. Fuentes de información demográficas. Modelos de población y proyecciones.
Tema 3. Sistema de Información Sanitaria en España. Principios rectores. Características y objetivos en la Ley de cohesión y calidad del SNS.
Tema 4. Plan Estadístico Nacional. Finalidad y características básicas. Las estadísticas sanitarias y sobre drogas y adicciones en el PEN. Ley 12/1989, de 9 de mayo, de la Función Estadística Pública. Secreto estadístico.
Tema 5. Diagnóstico de Salud. Conceptos generales. Utilidad y aplicaciones en la planificación. Informe del estado de salud de la población: objetivos, estructura, fuentes de información e indicadores. Estrategia de Salud Pública. Concepto «One Health».
Tema 6. Medidas de frecuencia de la enfermedad. Razones, proporciones y tasas. Incidencia, prevalencia y mortalidad. Medidas de efecto y de impacto. Mortalidad. Tasas brutas y específicas.
Tema 7. Estadísticas básicas de Atención Primaria y Atención Especializada. El Sistema de Información de Atención Primaria (SIAP). El Sistema de Información de Atención Especializada (SIAE).
Tema 8. Conocimiento de la morbilidad atendida en Atención Primaria. Base de Datos Clínica de Atención Primaria. Características y contenidos principales.
Tema 9. Conocimiento de la morbilidad atendida en Atención Especializada. RAE-CMBD. Características y contenidos principales. Indicadores de atención a las adicciones en el OEDA.
Tema 10. La medida de la accesibilidad a la atención sanitaria. Indicadores principales. Sistema de Información sobre las listas de espera en el Sistema Nacional de Salud.
Tema 11. La estadística. La variabilidad en las ciencias biológicas. Conceptos de población y muestra. Tipos y métodos de muestreo. La probabilidad.
Tema 12. Estadística descriptiva y analítica. Distribución de frecuencias. Representación gráfica. Medidas de centralización y de dispersión. La inferencia estadística.
Tema 13. Metodología de investigación. Aspectos éticos de la investigación epidemiológica. Comités de ética. Precisión, validez y generalización en los estudios epidemiológicos. Sesgos: concepto, prevención y control. Factores de confusión.
Tema 14. Determinantes sociales de la salud. Equidad en Salud y Desigualdades Sociales en Salud. Salud en todas las políticas. Evaluación del impacto en salud.
Tema 15. Calidad asistencial. Conceptos básicos. Evaluación de la calidad asistencial: justificación, metodología y herramientas. Análisis de resultados del sistema sanitario: efectividad.
Tema 16. Los Indicadores Clave del SNS (INCLA-SNS): concepto, características, organización.
Tema 17. Medición de la opinión y las expectativas de los ciudadanos sobre el sistema sanitario. Barómetro Sanitario. Características principales.
Tema 18. E-salud: historia clínica digital interoperable en el Sistema Nacional de Salud. Características principales y utilidad. Receta electrónica. Interoperable en el Sistema Nacional de Salud. Características principales y utilidad.
Tema 19. Principales estadísticas sanitarias internacionales: Eurostat, OCDE y OMS.
Tema 20. Seguridad del Paciente: conceptos generales. Magnitud e impacto de los efectos adversos. Prácticas seguras para prevenirlos. Evaluación de la seguridad del paciente. Sistemas de notificación de incidentes por seguridad.
Tema 21. Educación para la salud. Concepto, objetivos y líneas de intervención. Métodos directos e indirectos. La promoción de la salud. Evolución histórica, conceptos y principales líneas de intervención. El concepto actual de Salud, Salud Pública y Salud Comunitaria. El binomio salud-enfermedad.
Tema 22. La planificación sanitaria. Definición y concepto. Tipos de planificación. Las etapas del proceso de planificación.
Tema 23. La vigilancia epidemiológica de enfermedades transmisibles en España: Concepto, actividades y aplicaciones. Normativa legal vigente.
Tema 24. Vigilancia epidemiológica de las enfermedades transmisibles en Europa. Centro Europeo para la prevención y control de las enfermedades (ECDC).
Tema 25. Reglamento Sanitario Internacional: emergencias de Salud Pública de Importancia Internacional. Conceptos y actuaciones. Los comités de emergencias y de revisión.
Tema 26. Alertas en salud pública. Sistema de Alerta precoz y respuesta rápida en el ámbito europeo y estatal.
Tema 27. Vigilancia de las infecciones relacionadas con la asistencia sanitaria. Vigilancia y control de microorganismos multirresistentes o de especial relevancia clínicoepidemiológica.
Tema 28. Evaluación de pruebas diagnósticas. Concepto de sensibilidad, especificidad y valor predictivo. Fundamentos de la Prevención secundaria.
Tema 29. Metodología de la recogida de información epidemiológica. Diseño de cuestionarios de salud. Metodología de investigación cualitativa en salud pública.
Tema 30. Estudios de cohortes. Estudio de casos y controles. Estudios experimentales.
Tema 31. Promoción de estilos de vida saludables y de entornos saludables. La Estrategia de Promoción de la Salud y prevención en el Sistema Nacional de Salud.
Tema 32. Tabaco y salud. Normativa reguladora; Ley 28/2005, de 26 de diciembre, de medidas sanitarias frente al tabaquismo y de la venta, el suministro, el consumo y la publicidad de los productos del tabaco y Real Decreto 579/2017, de 9 de junio, por el que se regulan determinados aspectos relativos a la fabricación, presentación y comercialización de los productos del tabaco y los productos relacionados. Convenio Marco de la OMS para el Control del Tabaco (CMCT OMS): Estrategia MPOWER. Estrategias de Prevención y Control del Tabaquismo en España y Europa).
Tema 33. El alcohol y la salud. Estrategias y métodos de prevención y promoción de la salud. Políticas de la Unión Europea y OMS sobre alcohol.
Tema 34. Alimentación y salud pública. Estrategia NAOS. Actividad física y salud. Recomendaciones para la población sobre actividad física y reducción del sedentarismo.
Tema 35. Sanidad Exterior: Real Decreto 1418/1986, de 13 de junio, sobre funciones del Ministerio de Sanidad y Consumo en materia de sanidad exterior. Control y vigilancia higiénico-sanitaria de puertos, aeropuertos de tráfico internacional y puestos fronterizos, control sanitario de personas, cadáveres o restos humanos; control de zoonosis.
Tema 36. Promoción de la salud en el ámbito local: Red Española de Ciudades Saludables e implementación local de la Estrategia de Promoción de la Salud y Prevención en el Sistema Nacional de Salud.
Tema 37. Epidemiología de las lesiones intencionales y no intencionales y su prevención.
Tema 38. La salud y el género. Concepto de género. Determinantes de género. Desigualdades de género en salud. Protocolo común para la actuación sanitaria ante la violencia de género.
Tema 39. Promoción de envejecimiento saludable. Prevención de fragilidad, caídas y edadismo en las personas mayores.
Tema 40. Programas de cribado y de salud pública. Bases y criterios del cribado. Programas de cribado poblacional del Sistema Nacional de Salud. Documento Marco sobre cribado poblacional.
Tema 41. Estrategia de enfermedades crónica del Sistema Nacional de Salud.
Tema 42. Estrategia de cáncer del Sistema nacional de salud.
Tema 43. Estrategia de diabetes mellitus del Sistema nacional de salud.
Tema 44. Bases inmunitarias de las vacunaciones. Seroepidemiología. Estudios de Seroprevalencia. Inmunidad colectiva o de grupo. Reacciones adversas y efectos secundarios. Contraindicaciones.
Tema 45. Las vacunas y la salud pública. Políticas de vacunación en España. Calendario de vacunación a lo largo de toda la vida. Planificación de los programas de vacunaciones, evaluación de su eficacia y efectividad. Criterios de evaluación para fundamentar modificaciones en el programa de vacunación en España.
Tema 46. Vacunación en adultos y grupos de riesgo. Calendario de vacunación acelerado
Tema 47. Erradicación de la poliomielitis. Estrategia mundial y Plan de acción en España para la erradicación de la poliomielitis.
Tema 48. Eliminación de sarampión y rubeola. Estrategia mundial y Plan de eliminación del sarampión y la rubeola en España.
Tema 49. Hepatitis víricas (A, B, C, Hepatitis Delta, E). Epidemiología, prevención y situación mundial. Plan Estratégico para el Abordaje de la Hepatitis C en el Sistema Nacional de Salud.
Tema 50. Tuberculosis: Epidemiología, prevención y situación mundial. Plan para la prevención y control de la tuberculosis en España.
Tema 51: Infecciones de Transmisión Sexual (ITS). Epidemiología, estrategias de prevención y diagnóstico precoz. Epidemiología, prevención y Epidemiología y control del SIDA. El Plan Estratégico de prevención y control de VIH y otras ITS.
Tema 52. Vigilancia sanitaria en los puntos de entrada a España. Plan de Vigilancia de sanidad exterior en el control internacional de mercancías
Tema 53. Epidemiología y control de las enfermedades de transmisión hídrica y alimentaria.
Tema 54. Epidemiología y control de las enfermedades de transmisión respiratoria.
Tema 55. Epidemiología y control de las zoonosis. Enfermedades emergentes y transmitidas por vectores.
Tema 56. Salud Laboral. Vigilancia de la Salud Laboral. Enfermedades profesionales.
Tema 57. Epidemiología Ambiental y factores ambientales determinantes de la salud. La dimensión de la Salud Pública en las crisis medioambientales. Exceso de Temperaturas y su impacto en Salud Pública.
Tema 58. El agua y la salud. Legislación sanitaria de agua. Distribución de competencias y responsabilidades. Aguas de baño. Legislación europea y nacional. Criterios de calificación.
Tema 59. Radiaciones ionizantes. Conceptos y tipos. Efectos biológicos. Protección radiológica. Radiaciones no ionizantes. Campos electromagnéticos.
Tema 60. Cartera común de servicios del Sistema Nacional de Salud. Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización. Contenido, características y procedimiento para su actualización. Usos tutelados y estudios de monitorización de técnicas, tecnologías y procedimientos.
Tema 61. Reproducción humana asistida. Normativa estatal y europea. Ley 14/2006, de 26 de mayo, sobre técnicas de reproducción humana asistida. Real Decreto-ley 9/2014, de 4 de julio, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos. Comisión Nacional de Reproducción Humana Asistida. Estructura y funciones.
Tema 62. Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud. Marco regulatorio. Objetivos y funciones. Composición y funcionamiento. Marco europeo de evaluación de tecnologías sanitarias.
Tema 63. Centros, Servicios y Unidades de Referencia en el del Sistema Nacional de Salud. Real Decreto 1302/2006, de 10 de noviembre, por el que se establecen las bases del procedimiento para la designación y acreditación de los centros, servicios y unidades de referencia del Sistema Nacional de Salud. Designación de Centros, Servicios y Unidades: criterios, procedimiento, seguimiento y Comité de designación de CSUR.
Tema 64. Asistencia Sanitaria Transfronteriza: Directiva 2011/24/UE del Parlamento Europeo y del Consejo, de 9 de marzo de 2011, y Real Decreto 81/2014, de 7 de febrero, por el que se establecen normas para garantizar la asistencia sanitaria transfronteriza, y por el que se modifica el Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y órdenes de dispensación. Redes Europeas de Referencia.
Tema 65. Sangre y componentes sanguíneos Sistema Nacional para la Seguridad Transfusional. Estructura y Funcionamiento. Centros y Servicios de Transfusión. Autosuficiencia plasmática. Sistema Estatal de Hemovigilancia.
Tema 66. Estrategia Nacional de Salud Sexual y Reproductiva del Sistema Nacional de Salud.
Tema 67. Estrategia en salud cardiovascular del Sistema Nacional de Salud.
Tema 68. Estrategia en cuidados paliativos del Sistema Nacional de Salud.
Tema 69. Estrategia en salud mental del Sistema Nacional de Salud.
Tema 70. Marco Estratégico para la atención primaria y comunitaria.
Tema 71. La Estrategia Nacional de Adicciones y los Planes de Acción sobre Adiciones.
Tema 72. Reconocimiento de cualificaciones profesionales. El Registro Estatal de Profesionales Sanitarios (REPS). Registro Nacional de Especialistas en Formación (RNEF).
Tema 73. Formación continuada. Alta Inspección en el Sistema Nacional de Salud. Comisión de Recursos Humanos del Sistema Nacional de Salud.
Tema 74. Real Decreto 1723/2012, de 28 de diciembre, por el que se regulan las actividades de obtención, utilización clínica y coordinación territorial de los órganos humanos destinados al trasplante y se establecen requisitos de calidad y seguridad. Orden SSI/2396/2014, de 17 de diciembre, por la que se establecen las bases del Programa marco de calidad y seguridad para la obtención y trasplante de órganos humanos y se establecen los procedimientos de información para su intercambio con otros países.
Tema 75. Prestación farmacéutica en el Sistema Nacional de Salud. Procedimiento de financiación y precio de los medicamentos y criterios fármaco-económicos y acuerdos de sostenibilidad. Precios de referencia y agrupaciones homogéneas.
Área de Seguridad Alimentaria y Nutrición
Tema 1. La Seguridad alimentaria. Principios generales. Análisis del riesgo. Evaluación, gestión y comunicación del riesgo.
Tema 2. Organismos internacionales con competencia en seguridad alimentaria: La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la Organización Mundial de la Salud (OMS), Codex Alimentarius. Estructura. Funciones. Estatus de la Unión Europea en el marco del Codex. Asesoramiento científico.
Tema 3. Instituciones Europeas con competencia en seguridad alimentaria: Autoridad Europea de Seguridad Alimentaria. Dirección General de Salud y Seguridad Alimentaria. Subdirección de sostenibilidad alimentaria.
Tema 4. La Agencia Española de Seguridad Alimentaria y Nutrición. Objetivo, funciones y estructura orgánica.
Tema 5. El Registro General Sanitario de Empresas Alimentarias y Alimentos. Normativa y funcionamiento. Establecimientos alimentarios autorizados según normas de la Unión Europea.
Tema 6. Reglamento (UE) 2017/625 del Parlamento Europeo y del Consejo, de 15 de marzo de 2017, relativo a los controles y otras actividades oficiales. Laboratorios de Referencia de la Unión Europea, Laboratorios Nacionales de Referencia y Laboratorios Oficiales: designación, obligaciones, responsabilidades y tareas.
Tema 7. Norma UNE-EN ISO/IEC 17025: Requisitos generales para la competencia de los laboratorios de ensayo y calibración. Objeto y campo de aplicación. Términos y definiciones. Requisitos: generales, relativos a la estructura, relativos a los recursos, del proceso y del sistema de gestión.
Tema 8. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a la documentación del sistema de gestión, al control de documentos del sistema de gestión y al control de registros. Procedimientos normalizados de trabajo: elaboración y gestión en el laboratorio de ensayos.
Tema 9. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a la revisión de solicitudes, ofertas y contratos en un laboratorio de ensayos, así como a la validación de los métodos de ensayo y a los registros de validación correspondientes (estrategia de validación).
Tema 10. Requisitos y criterios de la Norma UNE-EN ISO/IEC 17025 relativos a la selección, verificación y validación de métodos apropiados para las actividades del laboratorio. Criterios de la Entidad Nacional de Acreditación (ENAC) sobre la selección de métodos de ensayo y demostración de su validez (CGA-ENAC-LEC).
Tema 11. Requisitos y criterios de la Norma UNE-EN ISO/IEC 17025 y del documento CGA-ENAC-LEC relativos a la evaluación de la incertidumbre de la medición. Guía ILAC-G17:01/2021 para la medición de la incertidumbre en ensayos.
Tema 12. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al aseguramiento de la validez de los resultados. Estrategias planificadas para el aseguramiento de la validez de los resultados de los ensayos y categorías de ensayos en un laboratorio de análisis de alimentos (concepto, descripción criterios de aceptación y rechazo, acciones correctivas, etc.). Gráficos de control.
Tema 13. Ensayos de intercomparación: tipos y finalidad. Requisitos y criterios de la Norma UNE-EN ISO/IEC 17025, Nota Técnica NT-03 de ENAC y Guía G-ENAC-14 relativos a la participación en ensayos de intercomparación para evaluar la validez de los resultados del laboratorio de ensayos.
Tema 14. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al equipamiento del laboratorio y a la trazabilidad metrológica de los resultados de sus mediciones. Calibración, verificación y mantenimiento de aparatos de medida del laboratorio. Criterios internacionalmente aceptados (ILAC: Cooperación Internacional de Acreditación de Laboratorios) sobre los Materiales de referencia: tipos, selección y uso.
Tema 15. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al informe de resultados de ensayo en un laboratorio de ensayos (comunes, específicos, declaraciones de conformidad, opiniones e interpretaciones, modificaciones, etc.).
Tema 16. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a los Trabajos No Conformes y las acciones correctivas. Criterios y requisitos de la Nota NO-11 de ENAC sobre No Conformidades y toma de decisión: concepto de No Conformidad, Acción correctiva, Acción de contención y Acción reparadora. Clasificación de No Conformidades. Tratamiento de las No Conformidades.
Tema 17. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a las auditorías internas y a las revisiones por la dirección de un laboratorio de ensayos. Criterios y requisitos a observar en relación con las Acciones para abordar riesgos y oportunidades, así como con la Mejora.
Tema 18. Alcances de acreditación cerrados y flexibles (Categorías de ensayos). Acreditación de categorías de ensayos: Notas Técnicas NT-18 y NT-19 de ENAC (objeto, campo de aplicación, definiciones, alcance de acreditación, requisitos del sistema de gestión, proceso de evaluación).
Tema 19. Criterios específicos de acreditación para los análisis microbiológicos de la Entidad Nacional de Acreditación (CEA-ENAC-20): Objeto y campo de aplicación. Características de funcionamiento de los métodos. Estimación de la incertidumbre. Aseguramiento de la calidad de los resultados de ensayo. Cepas de referencia.
Tema 20. Microbiología de los alimentos para consumo humano: Requisitos generales y guía para el examen microbiológico. Aparatos y equipamiento. Preparación del material de vidrio y del resto del material del laboratorio.
Tema 21. Microbiología de los alimentos para consumo humano: Terminología de los medios de cultivo (clasificación según su composición, su consistencia física, su uso, su método de preparación). Preparación, producción, conservación y ensayos de rendimiento de los medios de cultivo.
Tema 22. Microbiología de los alimentos para consumo humano: Preparación de las muestras de ensayo, suspensión inicial y diluciones decimales para el análisis microbiológico. Recuento de microorganismos.
Tema 23. Zoonosis de origen alimentario. Salmonella. Métodos para el aislamiento e identificación en el control oficial. Reglamentación aplicable.
Tema 24. Zoonosis de origen alimentario. Listeria monocytogenes. Métodos para el aislamiento, identificación y recuento en el control oficial. Reglamentación aplicable.
Tema 25. Zoonosis de origen alimentario. Campylobacter. Métodos para el aislamiento, identificación y recuento en el control oficial. Reglamentación aplicable.
Tema 26. Zoonosis de origen alimentario. Escherichia coli. Métodos para el aislamiento, identificación y recuento en el control oficial. Reglamentación aplicable.
Tema 27. Zoonosis de origen alimentario. Staphylococcus. Métodos para el aislamiento, identificación y recuento en el control oficial. Reglamentación aplicable.
Tema 28. Clostridium botulinum. Características. Métodos de aislamiento e identificación en el control de muestras de alimentos. Toxina botulínica: tipos y características. Métodos para la investigación de toxina botulínica en alimentos.
Tema 29. Parásitos en alimentos. Triquina. Métodos de detección, recuento y tipificación. Legislación aplicable. Anisakiasis y sus agentes causales legislación aplicable. Criptosporidiosis y sus agentes causales. Cisticercosis y sus agentes causales. Toxoplasmosis y sus agentes causales. Métodos de detección.
Tema 30. Microscopía óptica y electrónica. Fundamentos. Tipos. Aplicaciones.
Tema 31. Tecnología del gen. Regulación de la transcripción. Reacción en cadena de la polimerasa. Aplicaciones de la reacción en cadena de la polimerasa. Organismos modificados genéticamente. Especiación de agentes zoonóticos.
Tema 32. Alimentos y piensos modificados genéticamente. Legislación aplicable. Procedimiento de autorización. Etiquetado. Trazabilidad. Identificadores únicos. Métodos de análisis.
Tema 33. Inmunología. Técnicas inmunoenzimáticas: concepto, tipos y métodos de aplicación en alimentos.
Tema 34. Alergias e intolerancias alimentarias. Definición y clasificación. Principales alérgenos en alimentos e intolerancias alimentarias. Métodos de análisis.
Tema 35. Secuenciación de ácidos nucleicos: concepto y tipos. Aplicación en alimentos. Principales elementos de análisis de las secuencias.
Tema 36. Técnicas analíticas de electroforesis. Fundamentos. Componentes básicos del equipo. Mantenimiento y verificación. Análisis cualitativo y cuantitativo. Aplicación en el control de alimentos.
Tema 37. Estadística aplicada a laboratorios. Tipos de distribuciones. Análisis de resultados. Test estadísticos. Análisis de la varianza.
Tema 38. Tipos de errores en análisis instrumental. Regresión y correlación. Recta de regresión. Error de la pendiente y ordenada en el origen de la recta de regresión.
Tema 39. Curvas de calibrado en el análisis físico-químico. Patrón interno. Patrón externo. Método de las adiciones estándar. Materiales de referencia.
Tema 40. Técnicas para la preparación de muestras en análisis físico-químicos de alimentos. Objeto y fundamentos. Representatividad. Homogeneidad. Instrumental y aplicaciones.
Tema 41. Sistemas de extracción: principios generales. Extracción en fase sólida, líquido-líquido, con soxhlet, con microondas, con fluidos supercríticos, destilación. Objeto y aplicaciones.
Tema 42. Análisis gravimétrico y volumétrico. Fundamentos, instrumental y aplicaciones. Errores. Calibración de equipos y material.
Tema 43. Separaciones cromatográficas. Objeto y fundamentos. Principios fundamentales de los equilibrios cromatográficos. Tipos de cromatografías. Parámetros cromatográficos. Resolución, eficacia, selectividad.
Tema 44. Cromatografía de gases. Principios y parámetros fundamentales. Componentes básicos del sistema cromatográfico, incluyendo sistemas de detección. Calibración, verificación y mantenimiento del sistema cromatográfico. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 45. Cromatografía de líquidos de alta eficacia. Principios y parámetros fundamentales. Componentes básicos del sistema cromatográfico, incluyendo sistemas de detección. Calibración, verificación y mantenimiento del sistema cromatográfico. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 46. Cromatografía iónica. Fundamentos, características diferenciales y mecanismos de separación. Componentes básicos del sistema cromatográfico. Calibración, verificación y mantenimiento del sistema cromatográfico. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 47. Espectrometría de absorción molecular ultravioleta y visible. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 48. Espectrometría de fluorescencia molecular. Fosforescencia. Quimioluminiscencia. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 49. Espectrometría de Infrarrojo. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 50. Espectrometría de emisión de plasma. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 51. Espectrometría de absorción atómica de llama. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 52. Espectrometría de absorción atómica con atomización electrotérmica. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cualitativo y cuantitativo. Mantenimiento y verificación. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 53. Espectrometría de masas. Fundamentos. Componentes básicos de los equipos. Espectro de masas. Análisis cualitativo y cuantitativo. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 54. Espectrometría de masas en acoplamiento con otras técnicas: cromatografía de gases, cromatografía de líquidos, espectrometría de emisión de plasma. Fundamentos. Componentes básicos de los equipos. Análisis cualitativo y cuantitativo. Aplicación al análisis de contaminantes y residuos en el control de alimentos.
Tema 55. Materiales destinados a entrar en contacto con los alimentos. Implicaciones en seguridad alimentaria. Legislación y disposiciones aplicables. Ensayos de los materiales en contacto con los alimentos para la evaluación de su conformidad.
Tema 56. Contaminantes agrícolas presentes en los alimentos: micotoxinas y toxinas de las plantas. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 57. Contaminantes del procesado (industriales, medioambientales, etc.) presentes en los alimentos: hidrocarburos aromáticos policíclicos (HAPs), acrilamida, furanos y cloropropanoles (3-MCPD, 2-MCPD, 1,3-DCP, glicidoles, etc.). Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 58. Contaminantes del procesado (industriales y medioambientales, etc.) presentes en los alimentos: Metales pesados y elementos tóxicos. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 59. Contaminantes orgánicos persistentes (COPs) presentes en los alimentos: dioxinas y policlorobifenilos (PCB), sustancias perfluoroalquiladas (PFAS). Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 60. Residuos de medicamentos veterinarios en alimentos. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 61. Residuos de plaguicidas en alimentos. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 62. Biotoxinas marinas producidas por algas tóxicas. Clasificación, efectos, origen y acumulación en moluscos y otros productos del mar. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 63. Alimentos irradiados: normas sanitarias que regulan la elaboración, comercialización e importación de productos alimenticios e ingredientes alimentarios tratados con radiaciones ionizantes. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 64. Ingredientes tecnológicos: aditivos alimentarios. Regulación normativa. Condiciones para su empleo. Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 65. Ingredientes tecnológicos: enzimas, aromas y coadyuvantes. Regulación normativa. Condiciones para su empleo Legislación y disposiciones aplicables. Métodos de muestreo y análisis.
Tema 66. Alimentos destinados a una alimentación especial. Clasificación. Legislación y disposiciones aplicables.
Tema 67. Alimentos destinados a usos médicos especiales. Alimentos destinados a ser utilizados en dietas de bajo valor energético para reducción del peso. Legislación y disposiciones aplicables.
Tema 68. Preparados para lactantes y preparados de continuación. Alimentos elaborados a base de cereales y alimentos infantiles para lactantes y niños de corta edad. Legislación y disposiciones aplicables.
Tema 69. Complementos alimenticios. Alimentos enriquecidos. Legislación y disposiciones aplicables.
Tema 70. Nuevos alimentos y nuevos ingredientes alimentarios. Procedimiento comunitario de evaluación y autorización. Legislación y disposiciones aplicables.
Tema 71. Declaraciones de propiedades nutricionales y de propiedades saludables en los alimentos. Procedimiento de autorización. Legislación y disposiciones aplicables.
Tema 72. Reformulación de productos alimenticios: grasas, sal y azúcares. Legislación y disposiciones aplicables.
Tema 73. Bases de datos de composición de alimentos.
Tema 74. Controles y otras actividades oficiales. Requisitos generales y para la toma de muestras y análisis. Legislación de aplicación.
Tema 75. Redes de alerta alimentaria y asistencia y cooperación administrativa: descripción, niveles de gestión e interrelación. Base legal nacional y europea. El Sistema Coordinado de Intercambio Rápido de Información (SCIRI). La red de alerta y cooperación europea. Red Internacional de Autoridades de Inocuidad de los Alimentos (INFOSAN).
Área de Consumo
Tema 1. La Dirección General de Consumo del Ministerio de Derechos Sociales, Consumo y Agenda 2030. Organización: Estructura y funciones. Competencias de las administraciones públicas en materia de consumo.
Tema 2. Condiciones Generales de Contratación y Cláusulas Abusivas: Regulación, interpretación y control.
Tema 3. Régimen legal de la competencia desleal para la mejora de la protección de las personas consumidoras: prácticas comerciales desleales con las personas consumidoras. Acciones derivadas de la competencia desleal.
Tema 4. Las medidas europeas en el marco de la protección de las personas consumidoras. La legislación y normas de aplicación general y específica. Base jurídica del Tratado de funcionamiento de la Unión Europea que aplica a la protección de las personas consumidoras.
Tema 5. La protección de las personas consumidoras en la Unión Europea: políticas de protección. La Nueva Agenda de Consumo: ámbitos prioritarios de actuación.
Tema 6. La Cooperación Institucional entre las administraciones de consumo: Regulación de la Conferencia Sectorial de Consumo y de la Comisión Sectorial de Consumo.
Tema 7. Garantías en relación con los bienes de naturaleza duradera, y en la prestación de servicios y servicio postventa. El derecho de las personas consumidoras a la reparación por daños y perjuicios.
Tema 8. Regulación de la Unión Europea sobre la protección de los usuarios del transporte aéreo, ferroviario y los pasajeros que viajan por mar y por vías navegables.
Tema 9. Las infracciones en materia de defensa de las personas consumidoras. La calificación de las infracciones y la graduación de las sanciones previstas en texto refundido de la Ley General para la Defensa de los Consumidores y Usuarios y otras leyes complementarias, aprobado por el Real Decreto Legislativo 1/2007, de 16 de noviembre.
Tema 10. Reglamento (UE) 2017/2394 del Parlamento Europeo y del Consejo, de 12 de diciembre de 2017, sobre la cooperación entre las autoridades nacionales responsables de la aplicación de la legislación en materia de protección de las personas consumidoras: autoridades competentes y sus facultades. Mecanismos de investigación y ejecución coordinados para las infracciones generalizadas y las infracciones generalizadas con dimensión en la Unión.
Tema 11. Reglamento (UE) 2016/425 del Parlamento Europeo y del Consejo, de 9 de marzo de 2016, relativo a los equipos de protección individual. Requisitos esenciales de salud y seguridad. Documentación técnica presentada por el fabricante para garantizar su conformidad.
Tema 12. Reglamento (UE) 2019/1020 del Parlamento Europeo y del Consejo, de 20 de junio de 2019, relativo a la vigilancia del mercado y la conformidad de los productos y por el que se modifican la Directiva 2004/42/CE y los Reglamentos (CE) número 765/2008 y (UE) número 305/2011: actividades y obligaciones de las autoridades de vigilancia del mercado y de la oficina de enlace única. Poderes de las autoridades de vigilancia del mercado. Asistencia mutua transfronteriza.
Tema 13. Reglamento (UE) 2023/988 del Parlamento Europeo y del Consejo, de 10 de mayo de 2023, relativo a la seguridad general de los productos, por el que se modifican el Reglamento (UE) n.º 1025/2012 del Parlamento Europeo y del Consejo y la Directiva (UE) 2020/1828 del Parlamento Europeo y del Consejo, y se derogan la Directiva 2001/95/CE del Parlamento Europeo y del Consejo y la Directiva 87/357/CEE del Consejo. Ámbito de aplicación. Aspectos considerados en la evaluación de la seguridad de los productos, presunción de conformidad y elementos adicionales, obligaciones de los operadores económicos y mercados en línea, Sistema de Alerta Rápida «Safety Gate» y portal Business Gateway, aviso y soluciones en caso de recuperación.
Tema 14. Control a la importación de determinados productos respecto a las normas aplicables en materia de seguridad de los productos: Tipo de controles realizados por el Servicio de Inspección SOIVRE. Productos de importación procedentes de terceros países sometidos a control de seguridad previo a su despacho aduanero.
Tema 15. Seguridad de los juguetes: Regulación. Autoridades de vigilancia del mercado. Obligaciones de los agentes económicos. Cláusula de salvaguardia. Régimen sancionador. Ensayos más significativos.
Tema 16. Regulación de los contratos de créditos al consumo: Información y actuaciones previas a la celebración del contrato de crédito. Contratos de crédito vinculados. Derechos ejercitables. Régimen sancionador.
Tema 17. Reglamento (UE) 2017/625 del Parlamento Europeo y del Consejo, de 15 de marzo de 2017, relativo a los controles y otras actividades oficiales realizados para garantizar la legislación sobre alimentos y piensos, y de las normas de salud y bienestar de los animales, sanidad vegetal y productos sanitarios. Laboratorios Europeos de Referencia, Laboratorios Nacionales de Referencia y Laboratorios Oficiales: designación, funciones, obligaciones, responsabilidades y tareas. Excepciones a la condición de acreditación obligatoria para determinados laboratorios oficiales y excepciones temporales a la condición de acreditación obligatoria de los laboratorios oficiales.
Tema 18. El Registro de intermediarios financieros. Normativa y funcionamiento. Régimen sancionador.
Tema 19. La posición de las personas consumidoras en el ordenamiento jurídico español. El texto refundido de la Ley General para la defensa de los consumidores y usuarios: principios generales y ámbito de aplicación. Derechos básicos de las personas consumidoras.
Tema 20. Organismos internacionales con competencia en seguridad alimentaria: La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), La Organización Mundial de la Salud (OMS), Codex Alimentarius. Estructura. Funciones. Estatus de la Unión Europea en el marco del Codex. CCFL Comité del Codex sobre Etiquetado de los Alimentos. Asesoramiento científico.
Tema 21. Organismos internacionales relacionados con las políticas de protección de los consumidores y la seguridad de los productos: La Conferencia de Naciones Unidas sobre el Comercio y el Desarrollo (UNCTAD), la OCDE (Organización para la Cooperación y el Desarrollo Económico) y su Comité sobre Políticas de los Consumidores (CCP). Funciones y estructura.
Tema 22. Norma UNE-EN ISO/IEC 17025: Requisitos generales para la competencia de los laboratorios de ensayo y calibración. Objeto y campo de aplicación. Términos y definiciones. Requisitos: generales, relativos a la estructura, relativos a los recursos, del proceso y del sistema de gestión.
Tema 23. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a la documentación del sistema de gestión, al control de documentos del sistema de gestión y al control de registros. Procedimientos normalizados de trabajo: elaboración y gestión en el laboratorio de ensayos.
Tema 24. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a la revisión de solicitudes, ofertas y contratos en un laboratorio de ensayos, así como a la selección, verificación y validación de métodos apropiados para las actividades del laboratorio. Criterios de la Entidad Nacional de Acreditación (ENAC) sobre la selección de métodos de ensayo y demostración de su validez (CGA-ENAC-LEC).
Tema 25. Requisitos y criterios de la Norma UNE-EN ISO/IEC 17025 relativos a la validación de los métodos de ensayo y a los registros de validación correspondientes (estrategia de validación). Evaluación de la incertidumbre de la medición. Guía ILAC-G17:01/2021 para la medición de la incertidumbre en ensayos.
Tema 26. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al aseguramiento de la validez de los resultados. Estrategias planificadas para el aseguramiento de la validez de los resultados de los ensayos y categorías de ensayos en un laboratorio de análisis de alimentos (concepto, descripción criterios de aceptación y rechazo, acciones correctivas, etc.). Gráficos de control.
Tema 27. Ensayos de intercomparación: tipos y finalidad. Requisitos y criterios de la Norma UNE-EN ISO/IEC 17025, Nota Técnica NT-03 de ENAC y Guía G-ENAC-14 relativos a la participación en ensayos de intercomparación para evaluar la validez de los resultados del laboratorio de ensayos.
Tema 28. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al equipamiento del laboratorio y a la trazabilidad metrológica de los resultados de sus mediciones. Calibración, verificación y mantenimiento de aparatos de medida del laboratorio. Criterios internacionalmente aceptados (ILAC) sobre los Materiales de referencia: tipos, selección y uso.
Tema 29. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos al informe de resultados de ensayo en un laboratorio de ensayos (comunes, específicos, declaraciones de conformidad, opiniones e interpretaciones, modificaciones, etc.).
Tema 30. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a los Trabajos No Conformes, Acciones para abordar riesgos y oportunidades, mejora y acciones correctivas. Criterios y requisitos de la Nota NO-11 de ENAC sobre No Conformidades y toma de decisión: concepto de No Conformidad, Acción correctiva, Acción de contención y Acción reparadora. Clasificación de No Conformidades. Tratamiento de las No Conformidades.
Tema 31. Requisitos de la Norma UNE-EN ISO/IEC 17025 relativos a las auditorías internas y a las revisiones por la dirección de un laboratorio de ensayos.
Tema 32. Alcances de acreditación cerrados y flexibles (Categorías de ensayos). Acreditación de categorías de ensayos: Notas Técnicas NT-18 y NT-19 de ENAC (objeto, campo de aplicación, definiciones, alcance de acreditación, requisitos del sistema de gestión, proceso de evaluación)
Tema 33. Errores en el análisis cuantitativo. Tipos de errores. Consideraciones sobre el manejo de errores sistemáticos y aleatorios en el diseño de un procedimiento analítico.
Tema 34. Parámetros fundamentales de la estadística descriptiva. Población y muestra. Frecuencias. Medidas de centralización y dispersión. La distribución de resultados de medidas repetidas. Intervalos de confianza. Representación gráfica.
Tema 35. Estadística aplicada a los resultados analíticos. Tipos de distribuciones. Análisis de resultados. Contraste de hipótesis y toma de decisiones. Análisis de la varianza.
Tema 36. Tipos de errores en análisis instrumental. Regresión y correlación. Recta de regresión. Error de la pendiente y ordenada en el origen de la recta de regresión.
Tema 37. Métodos de calibración en el análisis instrumental. Patrón interno. Patrón externo. Método de las adiciones estándar. Materiales de referencia.
Tema 38. Técnicas para la preparación de muestras en análisis físico-químicos de alimentos. Objeto y fundamentos. Representatividad. Homogeneidad. Instrumental y aplicaciones.
Tema 39. Sistemas de extracción: principios generales. Extracción en fase sólida, líquido-líquido, con soxhlet, con microondas, con fluidos supercríticos, destilación. Objeto y aplicaciones.
Tema 40. Análisis gravimétrico y volumétrico. Fundamentos, instrumental y aplicaciones. Errores. Calibración de equipos y material.
Tema 41. Separaciones cromatográficas. Consideraciones generales. Principios fundamentales de los equilibrios cromatográficos. Tipos de cromatografías. Parámetros cromatográficos. Resolución, eficacia, selectividad.
Tema 42. Cromatografía en fase gaseosa. Principios y parámetros fundamentales. Componentes básicos del sistema cromatográfico. Mantenimiento y verificación del sistema cromatográfico.
Tema 43. Cromatografía de líquidos de alta resolución. Componentes básicos del sistema cromatográfico. Mecanismos básicos de separación y parámetros fundamentales. Mantenimiento y verificación del sistema cromatográfico.
Tema 44. Cromatografía iónica. Fundamentos, características diferenciales y mecanismos de separación. Componentes básicos del sistema cromatográfico. Mantenimiento y verificación del sistema cromatográfico.
Tema 45. Espectrometría de absorción molecular ultravioleta y visible. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 46. Espectrometría de fluorescencia molecular. Fosforescencia. Quimioluminiscencia. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 47. Espectrometría de Infrarrojo. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 48. Espectrometría de emisión de plasma. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 49. Espectrometría de absorción atómica de llama. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 50. Espectrometría de absorción atómica con atomización electrotérmica. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis cuantitativo. Mantenimiento y verificación.
Tema 51. Espectrometría de resonancia magnética nuclear. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis. Espectrometría de resonancia de spin electrónico. Fundamentos. Componentes básicos de los equipos. Metodología para el análisis.
Tema 52. Espectrometría de masas. Fundamentos. Componentes de los equipos. Espectro de masas. Análisis cualitativo y cuantitativo.
Tema 53. Espectrometría de masas en acoplamiento con otras técnicas: cromatografía de gases, cromatografía de líquidos, espectrometría de emisión de plasma. Fundamentos. Componentes básicos de los equipos. Análisis cualitativo y cuantitativo.
Tema 54. Técnicas analíticas de electroforesis. Fundamentos. Componentes básicos del equipo. Mantenimiento y verificación. Aplicaciones en el control de alimentos.
Tema 55. Técnicas automáticas de análisis. Tipos y fundamentos. Análisis por Inyección de flujo. Mantenimiento y verificación.
Tema 56. Microscopía óptica y electrónica. Fundamentos. Aplicaciones en el laboratorio de análisis de productos alimenticios y otros productos no alimenticios destinados a los consumidores.
Tema 57. Análisis sensorial. Definición y aplicaciones. Paneles de cata. Evaluación organoléptica de los aceites de oliva vírgenes. Atributos para la clasificación de los aceites de oliva vírgenes.
Tema 58. El laboratorio de microbiología. Organización del laboratorio. Preparación de medios de cultivo y reactivos. Control de calidad de medios de cultivo.
Tema 59. Estructura del ADN. Reacción en cadena de la polimerasa (PCR). Técnicas de PCR y su aplicación en el control de alimentos. Secuenciación del ADN. Métodos.
Tema 60. Inmunoquímica. Antígenos y anticuerpos. Técnicas y aplicaciones en el control de alimentos.
Tema 61. Detección de materias extrañas en alimentos. Métodos de detección. Identificación y clasificación de estas.
Tema 62. Ingredientes tecnológicos: aditivos alimentarios. Regulación normativa. Condiciones para su empleo.
Tema 63. Ingredientes tecnológicos: Edulcorantes, colorantes, reguladores pH, antioxidantes. Descripción. Técnicas analíticas de detección y valoración.
Tema 64. Otros Ingredientes tecnológicos. Conservadores. Estabilizantes. Potenciadores del sabor. Técnicas analíticas de detección y valoración.
Tema 65. Materiales destinados a entrar en contacto con los alimentos. Plásticos de uso en la industria alimentaria. Implicaciones en seguridad alimentaria. Estudios de migración en alimentos. Disposiciones aplicables.
Tema 66. Preparados para lactantes y preparados de continuación. Alimentos elaborados a base de cereales y alimentos infantiles para lactantes y niños de corta edad. Legislación aplicable.
Tema 67. Contaminantes presentes en los productos alimenticios: Metales pesados, hidrocarburos aromáticos policíclicos, 3-monocloropropanodiol (3-MCPD) y acrilamida. Legislación aplicable. Métodos de muestreo y análisis.
Tema 68. Productos eléctricos: Normativa aplicable al material eléctrico. Residuos de aparatos eléctricos y electrónicos: Legislación aplicable.
Tema 69. Marcado CE en productos de consumo: significado, requisitos, productos y colocación. Legislación de nuevo enfoque. Proceso de marcado, evaluación de la conformidad, autocertificación, documentación técnica y declaración de conformidad.
Tema 70. La red de alerta nacional: Gestión del Sistema Coordinado de Intercambio rápido de Información (SCIRI). Descripción. Niveles de gestión. Relación con otros sistemas de redes de alerta. La red de alerta comunitaria: Gestión del Rapid Alert System for Food and Feed (RASFF). Base legal. Descripción. Niveles de gestión. Relación con otros sistemas de redes de alerta.
Tema 71. Reglamento (UE) 1169/2011 del Parlamento Europeo y del Consejo, 25 de octubre de 2011, sobre la información facilitada al consumidor en materia de etiquetado.
Tema 70. Información obligatoria que debe figurar en el etiquetado de los productos no alimenticios destinados al consumidor. El Real Decreto 1468/1988, de 2 de diciembre, por el que se aprueba el Reglamento de etiquetado, presentación y publicidad de los productos industriales destinados a su venta directa a los consumidores y usuarios. Productos sujetos a este Real Decreto.
Tema 73. La Seguridad de los Productos. El Real Decreto 1801/2003, de 26 de diciembre, sobre seguridad general de los productos.
Tema 74. Marco general de principios y normas en materia de acreditación y vigilancia del mercado de los productos de consumo no alimenticios. El Reglamento (CE) 765/2008, de 9 de julio de 2008, por el que se establecen los requisitos de acreditación y vigilancia del mercado relativos a la comercialización de los productos.
Tema 75. Real Decreto 579/2017, por el que se regulan determinados aspectos relativos a la fabricación, presentación y comercialización de los productos del tabaco y los productos relacionados. Aspectos generales. Productos del tabaco: etiquetado y envasado. Productos del tabaco novedosos y tabaco de uso oral: requisitos aplicables. Dispositivos susceptibles de liberación de nicotina y envases de recarga: disposiciones relativas a la comercialización.
Las solicitudes de admisión a pruebas selectivas en la Administración Pública y liquidación de tasas de derechos de examen (modelo 790) se cumplimentarán de acuerdo con las siguientes instrucciones y las que figuran en el apartado 4 de esta convocatoria:
En el recuadro de «Ministerio» se especificará «Sanidad».
En el recuadro de «Centro Gestor» se indicará «Subsecretaría de Sanidad».
En el recuadro 15 «Cuerpo o Escala» se consignará «Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo», «código 6000S».
En el recuadro 17 «Forma de acceso» se consignará la letra «L» para las personas aspirantes del sistema general de acceso libre o «P» para las de promoción interna.
En el recuadro 18 «Ministerio/Órgano/Entidad convocante» se consignará «Sanidad».
En el recuadro 19 se consignará la fecha del «Boletín Oficial del Estado» en el que haya sido publicada la convocatoria.
En el recuadro 20 «Provincia de examen» se consignará «Madrid».
En el recuadro 21 «Grado de discapacidad» las personas aspirantes con discapacidad podrán indicar el porcentaje de discapacidad que tengan acreditado y, solicitar, en el recuadro 23 «Adaptación que se solicita (opcional)» las posibles adaptaciones de tiempo y medios para la realización de las pruebas selectivas, incluyendo el curso selectivo. Para ello, se deberá anexar necesariamente el Dictamen Técnico facultativo emitido por el órgano técnico de calificación del grado de discapacidad, acreditando, de forma fehaciente las deficiencias permanentes que han dado origen al grado de discapacidad reconocido, a efectos de que el Tribunal calificador pueda valorar la procedencia o no de la concesión de la adaptación solicitada.
En el recuadro 22 «Reserva» las personas aspirantes con un grado de discapacidad igual o superior al 33 por ciento que deseen participar en el proceso selectivo por el cupo de reserva para personas con discapacidad, deberán indicarlo señalando la opción «Sí, general». En caso de que, no quieran participar por dicho cupo, deberán señalar la opción «No».
En el recuadro 24, en caso de familia numerosa o discapacidad, se deberá indicar la Comunidad Autónoma en la que se reconoce esta condición.
En el recuadro 25 «N.º Título Familia Numerosa», se deberá indicar el número del título de familia numerosa en las Comunidades Autónomas que así lo requieran.
En el recuadro 26 «Títulos académicos oficiales» se consignará «Licenciatura, Grado, Ingeniero/a o Arquitecto/a».
En el recuadro 27 «Datos a consignar según las bases de la convocatoria»:
– En la casilla «Datos A»: las personas candidatas que acceden por el turno libre que deseen que se les conserve la nota del primer ejercicio de la convocatoria 2023 consignarán «conservación de nota del primer ejercicio».
– En la Casilla «Datos B»: las personas candidatas que acceden por el turno de reserva por discapacidad que deseen que se les conserve la calificación de todos los ejercicios de la convocatoria 2023 consignarán «conservación de todas las notas», mientras que si sólo quieren la conservación de la calificación de un determinado ejercicio deberán indicar qué ejercicio.
– En la Casilla «Datos C»: las personas aspirantes deberán consignar la opción de la prueba de idioma, indicando «Presencial» o «Titulación». En caso de optar por «Titulación» deberá anexar obligatoriamente el título de inglés a valorar.
(1) Los anexos V, VI y VII solo se incluirán en el caso de que así corresponda.
Certificado de requisitos y méritos de las pruebas selectivas de acceso, por promoción interna, en la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo
Personal funcionario de carrera

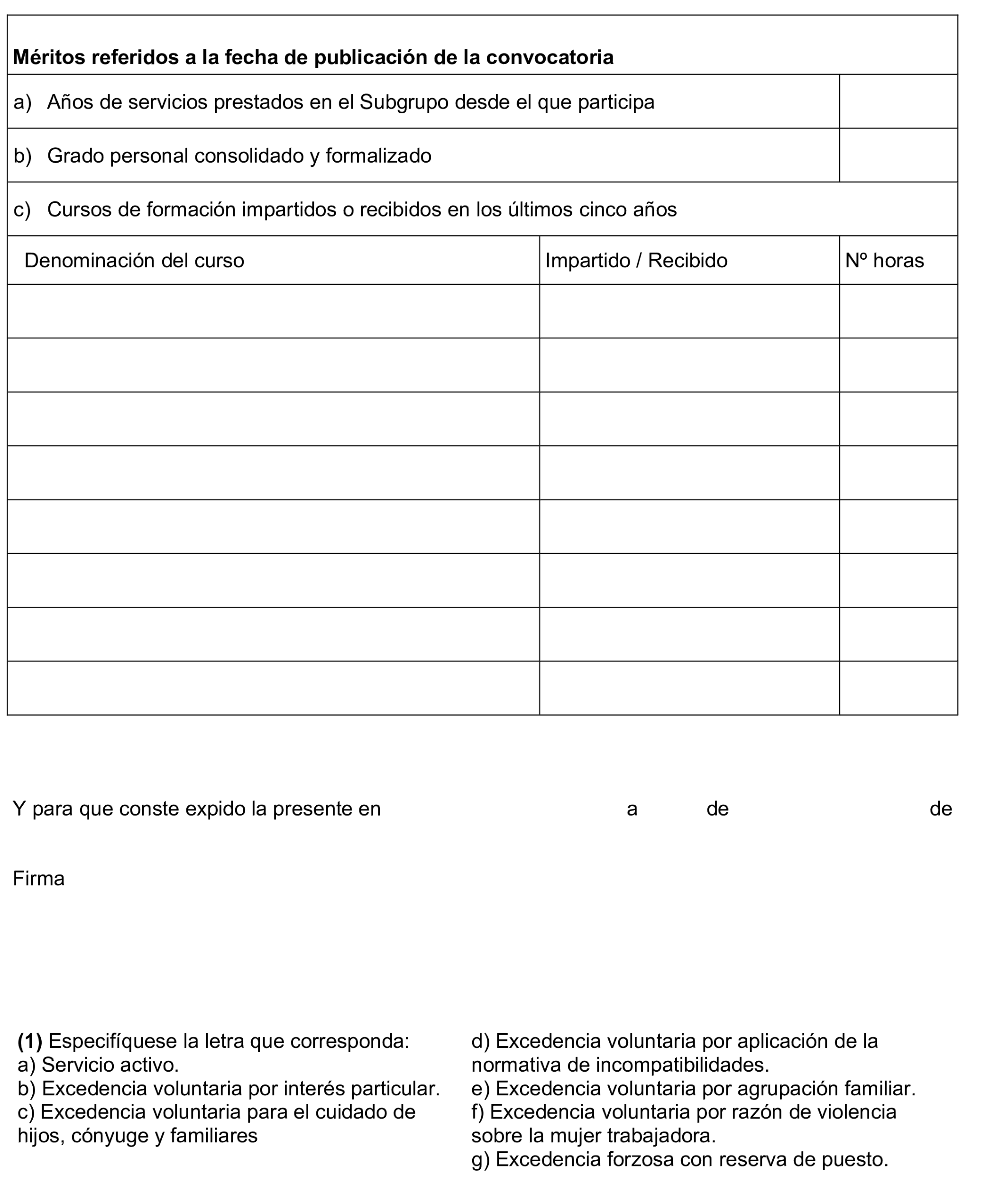
Certificado de requisitos y méritos de las pruebas selectivas de acceso, por promoción interna, en la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo
Personal laboral fijo


Yo, ................................................... (Nombre y apellidos), con NIF ............................
Presto mi conformidad con los datos obrantes en el Registro Central de Personal a los efectos de lo previsto en la Resolución de .................... de ........................ de ......................, por la que se convoca proceso selectivo para ingreso en la Escala Técnica de Gestión de Organismos Autónomos, especialidad Sanidad y Consumo, como únicos méritos a valorar en la fase de concurso de dicho proceso.
Fecha y firma.
Para la modalidad de acreditación de conocimiento de inglés mediante titulación se tendrán en cuenta exclusivamente las titulaciones que se listan a continuación, con las puntuaciones correspondientes, conforme al baremo establecido en las bases y siguiendo el Marco Común Europeo de Referencia para las Lenguas:
– Escuela Oficial de Idiomas:
• Certificación de superación de prueba Nivel Intermedio B2: B2.
• Certificación de superación de prueba Nivel Avanzado C1: C1.
• Certificación de superación de prueba Nivel Avanzado C2: C2.
– Asociación de Centros de Lenguas en la Enseñanza Superior:
• CertAcles B2: B2.
• CertAcles C1: C1.
• CertAcles C2: C2.
– Certificados de Cambridge University:
• First Certificate of English: B2.
• Advanced: C1.
• Proficiency: C2.
• Linguaskill B2: B2.
• Linguaskill C1: C1.
• IELTS (International English Language Testing System). Calificación total 5,5-6,5: B2.
• IELTS (International English Language Testing System). Calificación total 7-8: C1.
• IELTS (International English Language Testing System). Calificación total 8,5-9: C2.
– Education Testing Service (ETS):
• TOEFL Ibt. Calificación total 72-94: B2.
• TOEFL Ibt. Calificación total 95-120: C1.
• TOEIC (Test of English for International Communication). Calificación total en «listening and Reading» y «speaking and writing» entre 1095 y 1344, B2.
• TOEIC (Test of English for International Communication), Calificación total en «listening and Reading» y «speaking and writing» más o igual de 1345, C1.
– APTIS (four skills), certificación del British Council:
• Overall CEFR Grade B2, B2.
• Overall CEFR Grade C, C1.
• Aptis advanced: overall CEFR B2, B2.
• Aptis advanced: overall CEFR C1, C1.
– Capman Testing Solutions 360 LPT (Language Proficiency Test) Four Skills:
• Certificado C1, C1.
• Certificado B2, B2.
– Oxford Test of English B: Certificado B2, B2.
– Certificat de Compétences en Langues de l’Enseignement Supérieur (CLES), Inglés:
• CLES 2, B2.
• CLES 3, C1.
– The European Language Certificates (TELC):
• TELC B2, B2.
• TELC C1, C1.
– University of Michigan (Cambridge Michigan Language Assessments):
• Certificate of Competency in English (ECCE), B2.
• Certificate of Proficiency in English (ECPE), C2.
– Trinity College de Londres:
• Integrated Skills in English II, B2.
• Integrated Skills in English III, C1.
• Integrated Skills in English IV, C2.
– London Test of English (LTE):
• Nivel 3, B2.
• Nivel 4, C1.
• Nivel 5, C2.
– Pearson Test of English:
• General, Level 3, B2.
• General, Level 4, C1.
• General, Level 5, C2.
• Edexcel certificate in ESOL International, Level 1, B2.
• Edexcel certificate in ESOL International, Level 2, C1.
• Edexcel certificate in ESOL International, Level 3, C2.
– Learning Resource Network:
• Certificate in ESOL International Four skills, LRN Level 1, B2.
• Certificate in ESOL International Four skills, LRN Level 2, C1.
• Certificate in ESOL International Four skills, LRN Level 3, C2.
• IELCA General CEF B2, B2.
• IELCA General CEF C1, C1.
• IELCA General CEF C2, C2.
– Anglia ESOL Examinations General:
• Advanced, B2.
• AcCEPT/Proficiency, C1.
• Masters, C2.
– LanguageCert International ESOL:
• Communicator B2, B2.
• Expert C1, C1.
• Mastery C2, C2.
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid