Contingut no disponible en català
 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.[Bloque 1: #pr]
La Orden de 16 de octubre de 1979 regula los efectos y accesorios de la prestación farmacéutica de la Seguridad Social, conforme a lo previsto en el artículo 105.1 del texto refundido de la Ley General de la Seguridad Social, aprobado por Decreto 2065/1974, de 30 de mayo.
El presente Real Decreto, dictado en base a la competencia exclusiva que atribuye al Estado el artículo 149.1.1.ª y 17.ª de la Constitución Española, en desarrollo de los artículos 94.4 y 95 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y de acuerdo con lo previsto en el párrafo segundo del artículo 2.1 y en la disposición adicional tercera de la misma Ley, actualiza la citada normativa y regula la selección de tales productos sanitarios, a efectos de su financiación con fondos de la Seguridad Social o fondos estatales afectos a la sanidad.
Asimismo, y conforme a lo dispuesto en el artículo 149.1.16.ª de la Constitución y en el artículo 2.2 y la disposición adicional tercera.1 de la Ley del Medicamento, se establece la normativa básica sanitaria sobre el uso racional de dichos productos y su régimen de suministro y dispensación a los pacientes ambulatorios en el Sistema Nacional de Salud.
En su virtud, previo informe del Consejo Interterritorial del Sistema Nacional de Salud y de la Comisión Nacional para el Uso Racional del Medicamento, a propuesta de la Ministra de Sanidad y Consumo, previa aprobación del Ministro para las Administraciones Públicas, de acuerdo con el Consejo de Estado y previa deliberación del Consejo de Ministros en su reunión del día 12 de enero de 1996,
D I S P O N G O :
[Bloque 2: #a1]
1. La financiación de los efectos y accesorios, con cargo a los fondos de la Seguridad Social o fondos estatales afectos a la sanidad, dentro del Sistema Nacional de Salud, prescritos y suministrados a los pacientes no hospitalizados, que tengan derecho a ello, queda regulada en los términos que se establecen en este Real Decreto.
2. Quedan excluidos del ámbito de aplicación de este Real Decreto los productos sanitarios que requieran confección o adaptación individualizada para su uso y los demás materiales o aparatos a que se refiere el artículo 108 del texto refundido de la Ley General de la Seguridad Social, aprobado por el Decreto 2065/1974, de 30 de mayo.
[Bloque 3: #a2]
1. A efectos de este Real Decreto, se definen como efectos y accesorios, aquellos productos sanitarios de fabricación seriada que se obtienen en régimen ambulatorio y que están destinados a utilizarse con la finalidad de llevar a cabo un tratamiento terapéutico o ayudar al enfermo en los efectos indeseados del mismo.
2. Tienen el carácter de efecto y accesorio los siguientes productos sanitarios:
a) Materiales de cura.
b) Utensilios destinados a la aplicación de medicamentos.
c) Utensilios para la recogida de excretas y secreciones.
d) Utensilios destinados a la protección o reducción de lesiones o malformaciones internas.
3. Los efectos y accesorios financiados quedan clasificados en grupos, conforme a lo especificado en los anexos I y II del presente Real Decreto. A su vez, estos grupos se desagregarán en tipos de acuerdo con sus características y usos.
[Bloque 4: #a3]
1. Solamente serán financiados con cargo a fondos de la Seguridad Social o fondos estatales afectos a la sanidad los efectos y accesorios citados en el artículo anterior e incluidos en los anexos I y II de este Real Decreto destinados a los pacientes no hospitalizados que tengan derecho a ello.
2. No serán objeto de la financiación a que se refiere este Real Decreto los productos de los que se realice publicidad dirigida en general al público.
[Bloque 5: #a4]
1. Para su financiación con cargo a la Seguridad Social o fondos estatales afectos a la sanidad, el suministro, entrega o dispensación de los productos se efectuará a través de las oficinas de farmacia o mediante entrega directa por los centros o servicios, propios o concertados, de la red asistencial sanitaria o sociosanitaria.
2. La dispensación de los productos por las oficinas de farmacia, exigirá la presentación de la correspondiente receta médica u orden de dispensación, oficiales del Sistema Nacional de Salud debidamente cumplimentada por el profesional sanitario autorizado.
3. La entrega directa a los interesados de los productos por los centros o servicios sanitarios o sociosanitarios, propios o concertados, deberá efectuarse previa orden facultativa de prescripción.
Se modifica el apartado 2 por la disposición adicional 6.2 del Real Decreto 1718/2010, de 17 de diciembre. Ref. BOE-A-2011-1013.
[Bloque 6: #a5]
El Instituto Nacional de la Salud y las Comunidades Autónomas con competencias en materia de asistencia sanitaria de la Seguridad Social podrán adquirir los efectos y accesorios para su entrega por los centros o servicios, propios o concertados, de la red asistencial sanitaria y socio-sanitaria, conforme a la normativa vigente al respecto.
[Bloque 7: #a6]
1. La participación económica de los beneficiarios de la Seguridad Social en la dispensación de los efectos y accesorios a que se refiere el anexo I se fija en el cuarenta por ciento del precio aceptado para su financiación.
2. Dicha participación será del diez por ciento para los efectos y accesorios a que se refiere el anexo II sin que su importe total pueda exceder del límite señalado en cada momento para especialidades farmacéuticas, conforme al artículo 5 del Real Decreto 83/1993, de 22 de enero, por el que se regula la selección de los medicamentos a efectos de su financiación por el Sistema Nacional de Salud.
3. Lo dispuesto en los dos apartados anteriores no será de aplicación a los pensionistas y demás beneficiarios exentos de realizar aportación.
[Bloque 8: #a7]
El Ministerio de Sanidad y Consumo otorgará la autorización de uso de cupón-precinto de la Asistencia Sanitaria de la Seguridad Social (A.S.S.S.) a aquellos efectos y accesorios que, habiendo solicitado a este Organismo su inclusión en la financiación regulada en este Real Decreto, cumplan las condiciones especificadas en el artículo 9. La autorización otorgada será exclusivamente para el suministro, entrega o dispensación por oficinas de farmacia o centros o servicios, propios o concertados, de la red asistencial sanitaria o socio-sanitaria.
Para su dispensación a través de oficina de farmacia, los efectos y accesorios llevarán incorporado el cupón- precinto de la Asistencia Sanitaria de la Seguridad Social (A.S.S.S.), que tendrá que ser adherido a la receta médica u orden de dispensación oficiales, en el momento de su entrega al beneficiario.
Los efectos y accesorios que se obtengan a través de la red asistencial sanitaria y socio-sanitaria deberán llevar debidamente anulado el cupón-precinto.
Se modifica el párrafo segundo por la disposición adicional 6.2 del Real Decreto 1718/2010, de 17 de diciembre. Ref. BOE-A-2011-1013.
[Bloque 9: #a8]
Los efectos y accesorios estarán debidamente acondicionados o envasados según el tipo de producto de que se trate.
Las empresas ofertantes de efectos y accesorios ajustarán su material de acondicionamiento a los siguientes criterios:
a) Los pertenecientes o incluidos en el anexo I llevarán el cupón-precinto normal. (Modelo anexo III).
b) Los pertenecientes o incluidos en el anexo II llevarán el cupón-precinto con el cícero distintivo establecido en el anexo IV.
[Bloque 10: #a9]
1. La inclusión de un efecto y accesorio en la prestación y financiación regulada en este Real Decreto podrá realizarse teniendo en cuenta los criterios señalados en el artículo 94 de la Ley del Medicamento, valorándose, entre otros, los siguientes aspectos:
a) Que el producto sea conforme a la legislación vigente.
b) Que el producto pertenezca a uno de los grupos recogidos en los anexos I y II del presente Real Decreto.
c) Que cumpla con las especificaciones técnicas que para cada tipo de producto haya determinado el Ministerio de Sanidad y Consumo, a efectos de la financiación regulada en este Real Decreto.
d) Que su precio, a efectos de financiación, no supere los precios máximos aceptados por el Ministerio de Sanidad y Consumo para cada tipo de efecto y accesorio de las mismas características.
e) Que no se efectúe publicidad dirigida al público del producto.
2. El procedimiento de inclusión se iniciará mediante solicitud de la empresa ofertante, que estará inscrita en el correspondiente registro, ante la Dirección General de Farmacia y Productos Sanitarios. Para ello, adjuntará los modelos establecidos al efecto, acompañados de la documentación que acredite el cumplimiento de las condiciones de inclusión recogidas en el apartado 1 de este mismo artículo.
Instruido el procedimiento y previa audiencia al interesado se dictará resolución por la Dirección General de Farmacia y Productos Sanitarios en el plazo máximo de seis meses a partir de la iniciación del procedimiento, la cual se notificará al solicitante. La solicitud se entenderá desestimada en el caso de que, habiendo transcurrido dicho plazo, no hubiera recaído resolución expresa.
Contra dicha resolución podrá interponerse recurso ordinario en el plazo de un mes, conforme a lo establecido en el artículo 114 de la Ley de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común.
[Bloque 11: #a1-2]
1. Un efecto y accesorio ya incluido o que se incluya en la prestación y financiación regulada en este Real Decreto podrá ser excluido de la misma, teniendo en cuenta los criterios establecidos en el artículo 94 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y lo dispuesto en este Real Decreto.
2. En caso de existencia de efectos y accesorios ya disponibles y de otras alternativas mejores o iguales para las mismas afecciones a menor precio o inferior coste de utilización se tendrá en cuenta:
a) El efecto o accesorio de referencia debe ser al menos de la misma calidad, seguridad y eficacia y de efecto equivalente.
b) La comparación en función del precio de venta al público se realizará entre efectos y accesorios que sean equiparables.
c) La comparación en función del coste de utilización se realizará entre efectos y accesorios que tengan efecto equivalente.
En ningún caso podrá iniciarse el procedimiento para la exclusión de un producto si no ha transcurrido un año, como mínimo, desde su inclusión en la prestación farmacéutica de la Seguridad Social.
3. El procedimiento de exclusión se iniciará por la Dirección General de Farmacia y Productos Sanitarios cuando en un efecto y accesorio incluido en la prestación farmacéutica de la Seguridad Social concurran las circunstancias previstas en los apartados anteriores y con arreglo a los criterios señalados en los mismos.
4. Una vez iniciado el procedimiento de exclusión del efecto o accesorio se notificará a la empresa ofertante afectada, otorgándole un plazo de treinta días para que formule las alegaciones y, en su caso, efectúe las oportunas modificaciones que pudieran determinar la no exclusión del producto.
5. La Dirección General de Farmacia y Productos Sanitarios solicitará a la Comisión Nacional para el Uso Racional del Medicamento que emita el correspondiente informe en el plazo máximo de un mes.
6. Instruido el procedimiento y previa audiencia del interesado se adoptará la resolución que proceda.
7. La resolución se dictará por la Dirección General de Farmacia y Productos Sanitarios, deberá ser motivada y se notificará al representante legal de la empresa ofertante afectada.
Dicha resolución deberá dictarse en el plazo máximo de seis meses a partir de la iniciación del procedimiento y producirá efectos transcurridos tres meses, a contar desde la notificación al interesado.
8. Contra la resolución de la Dirección General de Farmacia y Productos Sanitarios podrá interponerse recurso ordinario en el plazo de un mes, conforme a lo establecido en el artículo 114 de la Ley de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común.
[Bloque 12: #a1-3]
Cuando el procedimiento de exclusión de un efecto o accesorio de la prestación farmacéutica de la Seguridad Social se inicie a solicitud de la empresa ofertante, la Dirección General de Farmacia y Productos Sanitarios resolverá de acuerdo con los criterios y requisitos contenidos en este Real Decreto.
[Bloque 13: #a1-4]
1. El Ministerio de Sanidad y Consumo mantendrá un Registro actualizado de las empresas ofertantes de efectos y accesorios, a efectos de lo establecido en el artículo 9.2 y concordantes de este Real Decreto.
Dichas empresas deberán facilitar puntualmente la información referente a las modificaciones que puedan producirse en estos aspectos.
2. Se establece el sistema de vigilancia siguiente:
a) Las empresas deberán contar con un sistema de vigilancia mediante el que recojan y evalúen cualquier disfunción, alteración de las características o del rendimiento de un efecto o accesorio, así como cualquier inadecuación del prospecto que pueda o haya podido dar lugar a muerte o al deterioro grave del estado de salud del paciente. Estos hechos serán comunicados inmediatamente a la Dirección General de Farmacia y Productos Sanitarios, donde serán evaluados y registrados. Esta comunicación se realizará sin perjuicio de la que, en su caso, sea exigida por la autoridad sanitaria de la Comunidad Autónoma correspondiente.
b) Igualmente, el ofertante notificará la retirada del mercado de un efecto o accesorio ocasionada por razones de carácter técnico o sanitario relacionadas con alguna de las circunstancias señaladas en el párrafo anterior.
c) En caso de que de la evaluación de los hechos comunicados se deriven medidas que afecten a la oferta, tales medidas serán comunicadas al ofertante.
3. Las empresas ofertantes de efectos y accesorios deberán garantizar el abastecimiento del mercado de aquellos efectos y accesorios aceptados para su financiación por el Sistema Nacional de Salud.
[Bloque 14: #a1-5]
El Instituto Nacional de la Salud y los órganos correspondientes de las Comunidades Autónomas con competencia en materia de asistencia sanitaria de la Seguridad Social controlarán el mantenimiento de las características y calidades de los efectos y accesorios aceptados para la financiación por el Sistema Nacional de Salud, sin perjuicio de las competencias de otros órganos de las Administraciones públicas en materia de productos sanitarios.
[Bloque 15: #a1-6]
1. Será de aplicación a los productos a que se refiere este Real Decreto y a las empresas, que los elaboran y suministran, el régimen de infracciones y sanciones a que se refieren los artículos 32 al 37 de la Ley 14/1986, de 25 de abril, General de Sanidad, y los artículos 105 a 112 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y disposiciones concordantes.
2. Se considerarán infracciones:
a) Infracciones leves:
1.ª El desabastecimiento del mercado de aquellos efectos y accesorios aceptados para su financiación por el Sistema Nacional de Salud.
2.ª La utilización en un efecto y accesorio de un cupón-precinto que no corresponda a su grupo y anexo específico.
3.ª La modificación del precio establecido para la financiación por el Sistema Nacional de Salud de un efecto y accesorio.
4.ª La comercialización de efectos y accesorios con cupón-precinto o cupón-precinto anulado, fuera de los canales establecidos en los artículos 4 y 7.
b) Infracciones graves:
1.ª El incumplimiento del deber de vigilancia a que se refiere el artículo 12.2 del presente Real Decreto.
2.ª La realización de promoción o publicidad que contravenga lo dispuesto en las normas generales y específicas que regulan estos aspectos.
3.ª Comercializar los efectos y accesorios sin observar las especificaciones técnicas que determinaron su inclusión en la financiación del Sistema Nacional de Salud.
c) Infracciones muy graves:
La puesta en el mercado de efectos y accesorios con cupón-precinto sin haber obtenido la autorización de financiación por el Sistema Nacional de Salud.
[Bloque 16: #da]
1. Los artículos 1, 2, 3, 6, 7, 8, 9, 10 y 11, las disposiciones adicionales segunda y tercera y transitoria única del presente Real Decreto se dictan en virtud de la competencia que atribuye al Estado el artículo 149.1.1.ª y 17.ª de la Constitución Española, en desarrollo de los artículos 94.4 y 95 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y de acuerdo con lo previsto en el párrafo segundo del artículo 2.1 y en la disposición adicional tercera de la misma Ley.
2. Los artículos 4, 12, 13 y la disposición adicional cuarta de este Real Decreto tienen el carácter de normativa básica sanitaria, conforme a lo dispuesto en el artículo 149.1.16.ª de la Constitución y en el artículo 2.2 y la disposición adicional tercera.1 de la Ley del Medicamento.
[Bloque 17: #da-2]
La relación de los grupos y tipos de productos a que se refiere el artículo 2 de este Real Decreto será objeto de publicación y actualización periódica por Orden del Ministro de Sanidad y Consumo.
[Bloque 18: #da-3]
El Ministro de Sanidad y Consumo podrá autorizar, con carácter provisional y excepcional, por propia iniciativa o a propuesta de los correspondientes Servicios de Salud, la financiación de efectos y accesorios no contemplados en el presente Real Decreto, en la forma y con las garantías que se consideren oportunas, por un plazo limitado y concreto que finalizará una vez se adopte una decisión acerca de su inclusión definitiva.
[Bloque 19: #da-4]
Sin perjuicio de la competencia propia de las Comunidades Autónomas, el Consejo Interterritorial del Sistema Nacional de Salud podrá establecer criterios de coordinación a efectos de lo previsto en el artículo 4.1.
[Bloque 20: #dt]
Los efectos y accesorios recogidos en los anexos I y II de este Real Decreto que, a la entrada en vigor del mismo, formen parte de la prestación farmacéutica de la Seguridad Social continuarán siendo financiados con cargo a la misma, en las condiciones que fija este Real Decreto, hasta tanto no se proceda a su revisión o exclusión conforme a lo previsto en el mismo.
[Bloque 21: #dd]
Sin perjuicio de lo establecido en las anteriores disposiciones transitorias, quedan derogadas:
a) La Orden de 16 de octubre de 1979 por la que se regulan los efectos y accesorios incluidos como parte de la prestación farmacéutica de la Seguridad Social.
b) Cuantas disposiciones de igual o inferior rango se opongan a lo dispuesto en este Real Decreto.
[Bloque 22: #df]
Se faculta al Ministro de Sanidad y Consumo para dictar las disposiciones necesarias para la ejecución y desarrollo de lo dispuesto en el presente Real Decreto.
[Bloque 23: #df-2]
Se faculta al Ministro de Sanidad y Consumo para adaptar los modelos de cupón-precinto a los avances que se produzcan en sistemas y tecnologías de la información.
[Bloque 24: #fi]
Dado en Madrid a 15 de enero de 1996.
JUAN CARLOS R.
La Ministra de Sanidad y Consumo,
MARÍA ANGELES AMADOR MILLÁN
[Bloque 25: #ai]
Descripción del grupo
1. Algodones.
2. Gasas.
3. Vendas.
4. Esparadrapos.
5. Apósitos.
6. Parches oculares.
7. Tejidos elásticos destinados a la protección o reducción de lesiones o malformaciones internas.
8. Duchas vaginales, irrigadores y accesorios para irrigación.
9. Cánulas rectales y vaginales.
10. Bragueros y suspensorios.
11. Absorbentes para la incontinencia urinaria.
12. Otros sistemas para incontinencia.
[Bloque 26: #ai-2]
Descripción del grupo
1. Aparatos de inhalación (inhaladores, cámaras de inhalación, insufladores).
2. Sondas.
3. Bolsas recogida de orina.
4. Colectores de pene y accesorios.
5. Bolsas de colostomía.
6. Bolsas de ileostomía.
7. Bolsas de urostomía.
8. Accesorios de ostomía.
9. Apósitos de ostomía.
10. Sistemas de irrigación ostomía y accesorios.
11. Sistemas de colostomía continente.
12. Cánulas de traqueotomía y laringectomía.
[Bloque 27: #ai-3]
El cupón-precinto de los efectos y accesorios incluidos en la financiación del Sistema Nacional de Salud constará de dos zonas teóricas, ajustadas al siguiente esquema:
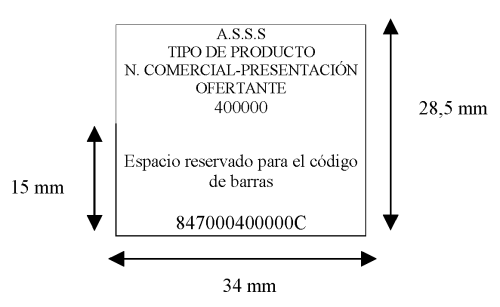
En la parte superior o zona teórica A se imprimirán, en caracteres normales los siguientes datos:
A.S.S.S.
Tipo de producto.
Nombre comercial-presentación (dimensiones, tallajes, número de unidades).
Ofertante.
Código nacional del producto.
En la parte inferior o zona teórica B se colocará el código de barras EAN-13/SF, con las debidas garantías de estandarización:
Seis dígitos que identifican el sector farmacéutico (que serán siempre 847000).
Seis dígitos correspondientes al código nacional del artículo.
Un dígito de control del código EAN-13.
Entre ambas zonas teóricas no existe línea ni señal impresa alguna que las delimite.
Las dimensiones fijadas se considerarán mínimas en lo referente a la altura de la zona A, no pudiendo superar el tamaño total del cupón-precinto el adecuado para garantizar la grabación y procesamiento informático de los datos contenidos en el mismo.
Cada envase estará dotado de un único cupón-precinto, que identificará de forma inequívoca a cada presentación. Este precinto será autoadhesivo, extraíble, de.001modo que pueda ser utilizado como comprobante.001de la dispensación, y estará ubicado en una zona del envase lo más visible posible y colocado de forma que no se impida la lectura óptica.
Además, el cupón será de características tales que, al separarlo, no se produzca deterioro del envase y en el espacio en el que estaba ubicado quede la siguiente frase en Arial, 13, negrita, de color rojo, Pantone 032, y con inclinación de 30, el siguiente texto: «Dispensado al SNS.
El cupón precinto estará dotado de las siguientes medidas de seguridad, que eviten su falsificación, una vez que la empresa ofertante ponga el producto en el mercado:
La zona A llevará como medidas de seguridad:
Leyenda visible únicamente a la luz ultravioleta, que abarque esta zona del precinto, de forma cruzada al texto, en la que figure repetidas veces «SNS», con fuente Time Bold, de 12 puntos, y 45 de inclinación.
Texto en microimpresión situado junto al borde lateral derecho de la zona A, en el que figure la leyenda «SNS» repetida con un cuerpo de 240 micras.
Todo el precinto llevará un fondo de seguridad, en Pantone 2995, con mensaje encriptado con el texto «SNS», que se leerá con una lente decodificadora. Fondo continuo de diseño de línea fina que posibilite la lectura automática de los códigos de barras.
Se modifica por el apartado 1 de la Orden SCO/470/2002, de 20 de febrero. Ref. BOE-A-2002-4458
[Bloque 28: #ai-4]
El cupón-precinto de los efectos y accesorios a los que, según lo dispuesto en el Real Decreto 9/1996, de 15 de enero, les corresponde aportación reducida, será idéntico al cupón-precinto descrito en el punto primero, pero además llevará impreso en su parte superior izquierda, delante de las siglas A.S.S.S., 1 cícero de color negro.
En aquellos productos para cuya dispensación con cargo al Sistema Nacional de Salud se requiera visado de inspección, el cupón precinto tendrá las mismas dimensiones descritas en el punto primero y será diferenciado mediante un recuadro de 1 milímetro de ancho en la parte superior y lateral de la zona A, tal como se detalla en el siguiente esquema:
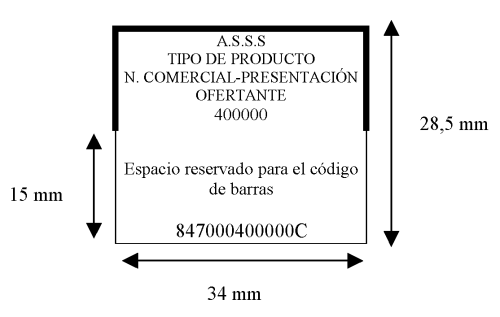
Se modifica por el apartado 2 de la Orden SCO/470/2002, de 20 de febrero. Ref. BOE-A-2002-4458
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agència Estatal Butlletí Oficial de l'Estat
Avda. de Manoteras, 54 - 28050 Madrid