El 4 de diciembre de 2017 se suscribe el Convenio entre el Ministerio de Economía, Industria y Competitividad y el Servicio Andaluz de Salud para el proyecto «Diagnóstico y Tratamiento de Precisión en Enfermedades Infecciosas y Cáncer» cofinanciado con FEDER.
En cumplimiento de lo dispuesto en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, procede la publicación en el «Boletín Oficial del Estado» de dicho convenio.
Madrid, 29 de mayo de 2018.–El secretario General de Ciencia e Innovación, Juan María Vázquez Rojas.
En Madrid, a 4 de diciembre de 2017.
REUNIDOS
De una parte, don Juan María Vázquez Rojas, Secretario General de Ciencia e Innovación, cargo que ostenta en virtud del nombramiento efectuado por el Real Decreto, 569/2016, de 25 de noviembre, actuando en nombre y representación del Ministerio de Economía, Industria y Competitividad, de acuerdo a la delegación de competencias efectuada por Resolución de la Secretaria de Estado de Investigación, Desarrollo e Innovación, de 1 de julio de 2016 («BOE» de 6 de julio de 2016), ratificada por Orden EIC/1828/2016, de 24 de noviembre («BOE» de 30 de noviembre de 2016).
De otra parte, doña Francisca Antón Molina, Directora Gerente del Servicio Andaluz de Salud, nombrada por Decreto 92/2017, de 20 de junio («Boletín Oficial de la Junta de Andalucía» número 117, de 21 de junio) de acuerdo con lo establecido en los artículos 21.5 y 27.21 de la Ley 6/2006, de 24 de octubre, del Gobierno de La Comunidad Autónoma de Andalucía, y 17.3 de la Ley 9/2007, de 22 de octubre, de la Administración de la Junta de Andalucía y en la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
Reconociéndose plena capacidad para celebrar el presente convenio,
EXPONEN
1. Que de acuerdo al Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se establecen disposiciones comunes relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión, al Fondo Europeo Agrícola de Desarrollo Rural y al Fondo Europeo Marítimo y de la Pesca, y por el que se establecen disposiciones generales relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión y al Fondo Europeo Marítimo y de la Pesca, y se deroga el Reglamento (CE) n.º 1083/2006 del Consejo, al Reglamento (UE) n.º 1301/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre el Fondo Europeo de Desarrollo Regional y sobre disposiciones específicas relativas al objetivo de inversión en crecimiento y empleo y por el que se deroga el Reglamento (CE) n.º 1080/2006, los criterios de selección de operaciones cofinanciadas por el Fondo Europeo de Desarrollo Regional se establecen en los correspondientes Comités de Seguimiento de los Programas Operativos aprobados por Decisión de la Comisión Europea.
2. Que corresponde al Estado el «fomento y coordinación general de la investigación científica y técnica», de acuerdo con el artículo 149.1.15 de la Constitución. De forma específica, según el Real Decreto 415/2016, de 3 de noviembre, por el que se reestructuran los departamentos ministeriales, y se crea el Ministerio de Economía, Industria y Competitividad (en adelante MEIC), corresponde a éste la propuesta y ejecución de la política del Gobierno en materia de investigación científica, desarrollo tecnológico e innovación en todos los sectores, y de forma más específica a la Secretaría General de Ciencia e Innovación (en adelante SGCi) le corresponde el impulso de la compra pública innovadora. Todo ello de acuerdo con los objetivos que se concretan en la Estrategia Española de Ciencia y Tecnología y de Innovación 2013-2020 (EECTI) y en el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 junto con las orientaciones de la Comisión Europea sobre construcción del Espacio Europeo de Investigación y las directrices estratégicas comunitarias en materia de cohesión.
La Estrategia Española de Ciencia, Tecnología y de Innovación 2013-2020 (EECTI) constituye el marco estratégico para las políticas de I+D+i estatales y autonómicas y es el marco de referencia del Programa Operativo FEDER de Crecimiento Inteligente 2014-2020 (POCInt), documento en el que se concreta la estrategia y los objetivos de intervención de la Administración General del Estado (AGE) cofinanciadas con el fondo FEDER.
La EECTI recoge cuatro grandes objetivos generales, alineados con los objetivos de la Estrategia UE2020 y de Horizonte 2020 y contempla el desarrollo de las medidas necesarias para corregir las debilidades del Sistema.
A nivel estatal, la EECTI se desarrolla mediante el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 y sus Planes Anuales de Actuación, constituyendo el conjunto el marco estratégico estatal de investigación e innovación para la especialización inteligente (RIS3 estatal).
3. Que la iniciativa emblemática de Europa 2020 «Unión por la innovación» reconoce la importancia del mercado de la contratación pública y su elevado potencial para impulsar la innovación. En este sentido, la contratación pública de productos y servicios innovadores es primordial para mejorar la calidad y la eficiencia de los servicios públicos, especialmente en un contexto de restricciones presupuestarias. La iniciativa establece que las administraciones públicas deben utilizar la contratación pública cofinanciada por los fondos estructurales para aumentar la demanda de productos y servicios innovadores. En el mismo sentido, la Directiva 2014/24/UE del Parlamento Europeo y del Consejo, de 26 de febrero de 2014, sobre contratación pública, establece que la investigación y la innovación son uno de los principales motores del crecimiento futuro, y recomienda a los poderes públicos hacer la mejor utilización estratégica posible de la contratación pública para fomentar la innovación. Asimismo, afirma el papel clave de la adquisición de bienes, obras y servicios innovadores en la mejora de la eficiencia y la calidad de los servicios públicos.
A fin de coordinar las actuaciones recogidas en el POCInt y en los Programas Operativos Regionales dentro del OT1, hay que señalar que el objetivo general del POCInt dentro del OT1 es fortalecer las capacidades en I+D+i que permitan el desarrollo de vínculos y la creación de sinergias entre el sector público y el sector empresarial, así como estimular la inversión empresarial en I+D+i, a través de instrumentos tanto de oferta como de demanda, contribuyendo a mejorar la competitividad empresarial apoyada en la innovación y la creación de empleo de alto valor añadido. En el caso de actuaciones de Compra Pública Innovadora, las actuaciones de la AGE van dirigidas a fomentar y coordinar proyectos en los que participen entidades de las distintas Comunidades Autónomas.
4. Que el Servicio Andaluz de Salud (en adelante SAS) es un organismo de derecho público de acuerdo a la definición contemplada en el art.2.1.4 de la Directiva 2014/24/UE del Parlamento Europeo y del Consejo, de 26 de febrero de 2014, sobre contratación pública y tiene entre sus funciones prestar atención sanitaria a las ciudadanas y ciudadanos andaluces, ofreciendo servicios sanitarios públicos de calidad, asegurando la accesibilidad, equidad y satisfacción de los usuarios, buscando la eficiencia y el aprovechamiento óptimo de los recursos. El Servicio Andaluz de Salud es una agencia administrativa de las previstas en el artículo 65 de la Ley 9/2007, de 22 de octubre, y respecto al régimen de contratación se rige por el Decreto 39/2011, de 22 de febrero, por el que se establece la organización administrativa para la gestión de la contratación de la Administración de la Junta de Andalucía y sus entidades instrumentales y se regula el régimen de bienes y servicios homologados.
5. Que el SAS, en la ejecución de este proyecto, se someterá a lo dispuesto en el Real Decreto Legislativo 3/2011, de 14 de noviembre, que refunde el texto de la Ley de contratos del Sector Público.
6. Que el SAS conoce los Reglamentos Comunitarios y legislación estatal vigentes en materia de I+D+i.
7. Que el SAS cuenta en sus presupuestos con créditos suficientes que permiten asegurar la cofinanciación global del proyecto.
8. Que el MEIC ha analizado el proyecto que responde a las necesidades de desarrollo económico de la Comunidad Autónoma de Andalucía y considera que deben ser objeto de cofinanciación por el FEDER aquellos con mayor capacidad de transformar los resultados de la investigación en productos y servicios de alto valor añadido, nuevos y sensiblemente mejorados, potenciando la transferencia de los resultados de actuaciones científicas y tecnológicas a empresas productoras de bienes o servicios.
9. Que el MEIC valora la contribución del proyecto objeto de ayuda al desarrollo socioeconómico y la competitividad del tejido empresarial del entorno, así como a la integración del sistema ciencia, tecnología, empresa y a la mejora de los servicios públicos mediante la incorporación de bienes o servicios innovadores.
El MEIC, en relación al Proyecto «Diagnóstico y Tratamiento de Precisión en Enfermedades Infecciosas y Cáncer» ha seguido el procedimiento establecido para la selección de operaciones FEDER de la Línea FID-Fomento de la Innovación desde la Demanda y de la Compra Pública Innovadora (Código de actuación DGIC-004 del Programa Operativo Crecimiento Inteligente del FEDER) aprobado el 3 de mayo de 2016.
Igualmente el MEIC ha considerado, dentro de los criterios de selección de operaciones de los Fondos, que el proyecto «Diagnóstico y Tratamiento de Precisión en Enfermedades Infecciosas y Cáncer» se enmarca dentro de los contemplados en el objetivo de difundir el conocimiento y de la cooperación público-privada entre agentes científico-tecnológicos y empresas, apoyando, para ello, a proyectos que estimulen la competitividad empresarial mediante la realización de actividades de I+D+i en las regiones más desarrolladas por parte de la SGCi.
10. Que el SAS manifiesta que la totalidad de las actuaciones irán encaminadas a la mejora de servicios públicos universales, no de mercado y/o que no generen efectos de distorsión de mercado.
11. Que el SAS manifiesta que velará porque las actuaciones impulsen el fomento de la innovación empresarial, a través del empleo de la compra pública innovadora, en coordinación con el MEIC. A tales efectos el SAS procurará maximizar el número de soluciones innovadoras puestas en mercado como resultado del presente convenio de colaboración.
Por todo ello, las partes acuerdan celebrar el presente convenio que se regirá por las siguientes
CLÁUSULAS
El objeto del presente convenio es establecer la colaboración entre las partes para contribuir a la mejora de los servicios públicos, a través del fomento de la innovación empresarial, mediante la selección de las actuaciones y proyectos reflejados en la cláusula segunda para su cofinanciación por el FEDER 2014-2020.
Asimismo mediante el presente convenio se establecen las obligaciones y derechos del SAS, beneficiario de los fondos FEDER, aplicados para la ejecución del antedicho proyecto.
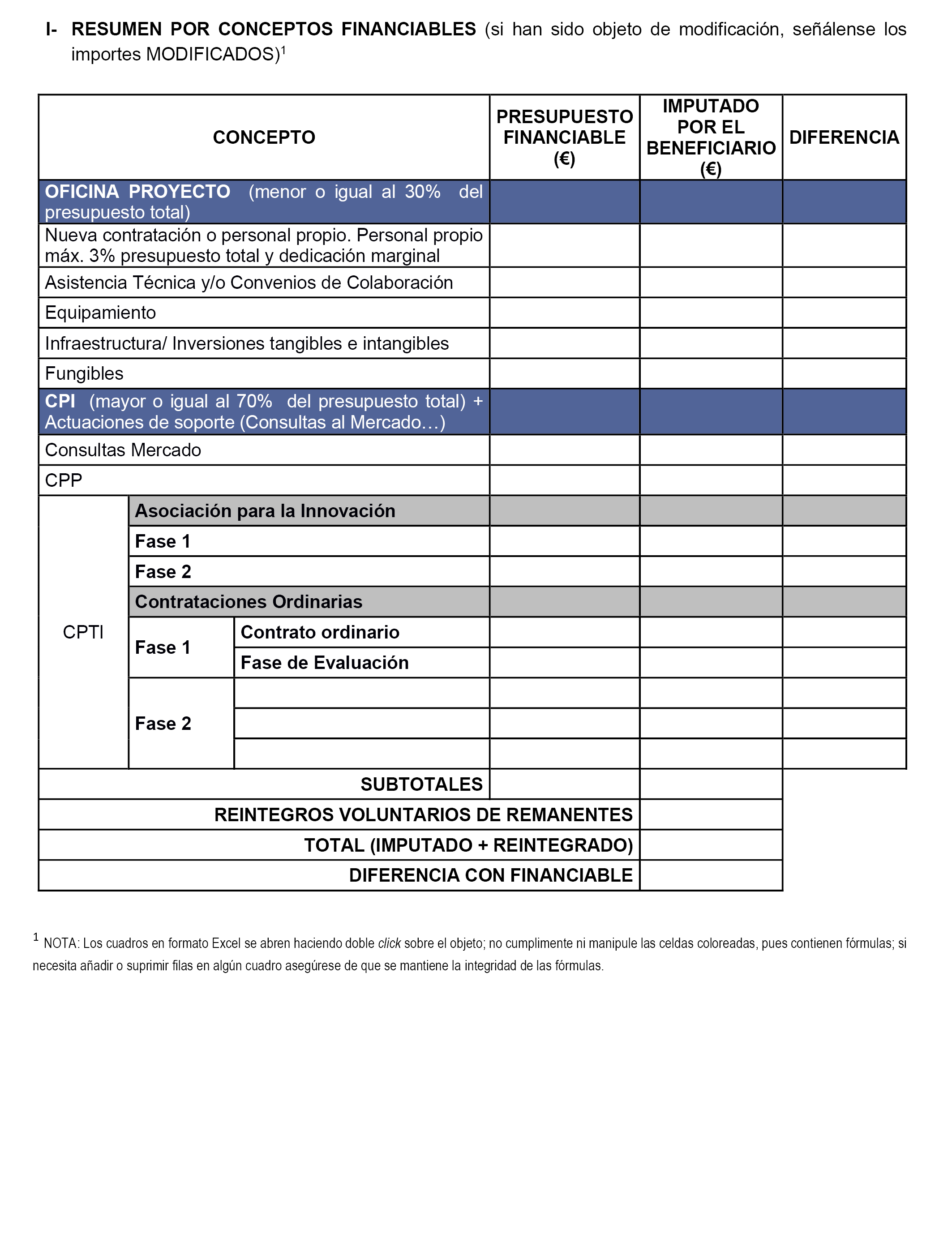
Las actividades relacionadas con el proyecto «Diagnóstico y Tratamiento de Precisión en Enfermedades Infecciosas y Cáncer» que se llevarán a cabo y serán objeto de cofinanciación, en particular por el FEDER 2014-2020, son las señaladas en el Anexo I. Todas las actuaciones quedan sujetas a su correcta realización y justificación en los términos recogidos en este convenio y sus anexos.
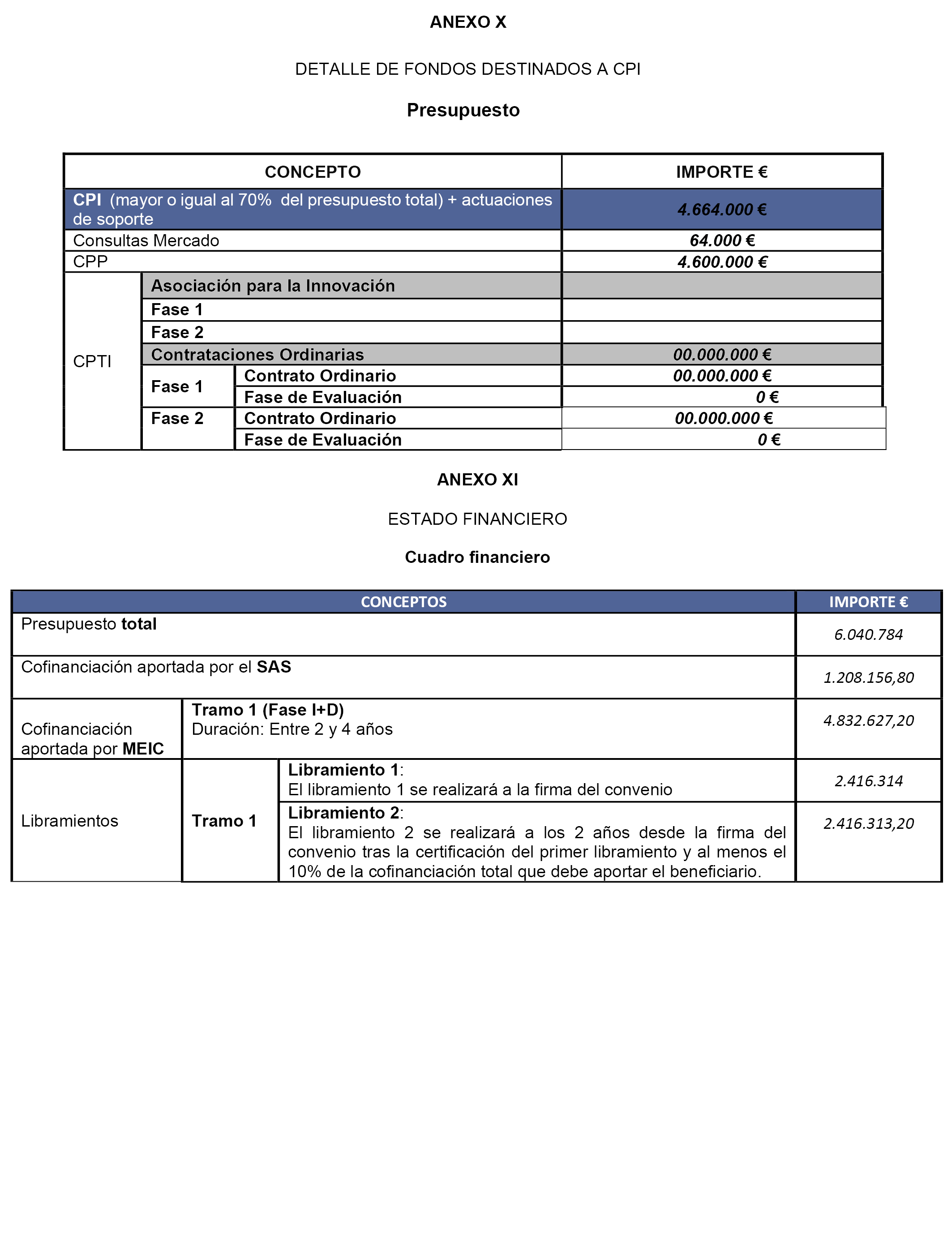
a) El MEIC aportará a SAS la cantidad de cuatro millones ochocientos treinta y dos mil seiscientos veintisiete con veinte euros en concepto de anticipo reembolsable FEDER, con cargo a la aplicación presupuestaria 27.12.463B.823 o la que la sustituya en futuros presupuestos, para ejecutar el proyecto reflejado en la cláusula segunda de acuerdo a la memoria y presupuesto presentados (anexo I), lo que se aportará en los términos reflejados en los anexos X y XI correspondientes al Tramo I o fase de I+D+i:
– El primer libramiento se realizará a la firma del convenio.
– El segundo libramiento se realizará a los 2 años desde la firma del convenio, tras la justificación del primer libramiento y al menos el 10 % de la cofinanciación total que debe aportar el beneficiario según lo establecido en la cláusula quinta (el MEIC, como Organismo Intermedio del Programa Operativo Crecimiento Inteligente del FEDER, certificará anualmente a la Autoridad de Gestión los gastos elegibles justificados y verificados antes del 1 de octubre de cada año por el SAS.
– Los importes correspondientes a cada libramiento son los recogidos en el Anexo XI.
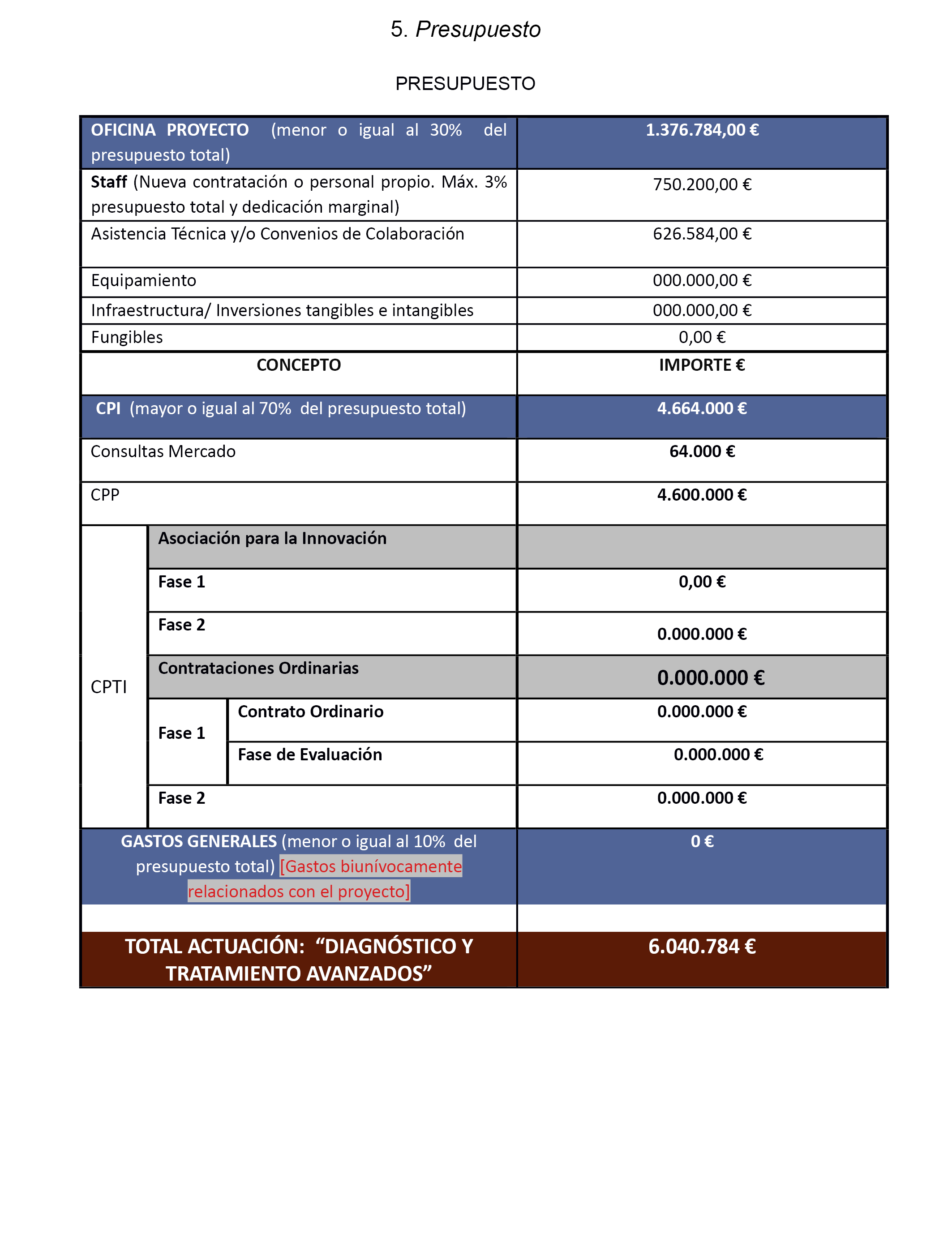
b) El importe total del proyecto asciende a seis millones cuarenta mil setecientos ochenta y cuatro euros, con la siguiente distribución:
|
Fase |
Presupuesto – Euros |
Modalidad |
Presupuesto según modalidad – Euros |
|---|---|---|---|
|
Tramo I (Fase I+D) |
6.040.784 |
||
|
Anticipo reembolsable |
4.832.627,20 |
||
|
Contribución beneficiario |
1.208.157,80 |
||
|
Total (€) |
6.040.784 |
6.040.784,00 |
c) Del importe mostrado en el cuadro anterior correspondiente a la modalidad de anticipo reembolsable, el FEDER financia un 80 %, cuatro millones ochocientos treinta y dos mil seis cientos veintisiete euros con veinte céntimos, y el 20 % restante, un millón doscientos ocho mil ciento cincuenta y seis euros con ochenta céntimos, es la aportación nacional a través de la contraparte SAS.
d) Los libramientos se realizarán mediante transferencia bancaria a la siguiente cuenta y entidad bancaria: IBAN ES28.2100.9166.7122.0002.5198, Banco Caixabank, de conformidad a lo previsto en el anexo XI.
e) El SAS, al encontrarse sujeto al régimen presupuestario público, deberá registrar un ingreso por el importe del anticipo reembolsable recibido, aplicado al capítulo 9 «Pasivos financieros» de su presupuesto.
Cuando se reciban los fondos del FEDER, el Ministerio informará al SAS de esta circunstancia, de modo que podrán reconocer la subvención recibida de la Unión Europea mediante un ingreso en el concepto que corresponda en el artículo 79 «Transferencias de capital del exterior», lo que a su vez permitirá la formalización de la cancelación de la deuda que quedó registrada en el momento del anticipo de fondos por parte del Estado, mediante el correspondiente pago en el capítulo 9 de su presupuesto de gastos.
La cancelación del anticipo reembolsable FEDER se realizará en formalización, sin salida física de fondos. Si el retorno de los fondos FEDER provenientes de la financiación europea no fueran suficientes para amortizar los fondos anticipados, SAS reintegrará la diferencia en el Tesoro Público más los eventuales intereses. En el caso de existir remanentes no aplicados a la actividad financiada, si el reintegro se realizara de forma voluntaria antes del vencimiento del plazo para ejecutar la actividad, se aplicará el interés previsto en el artículo 17 de la Ley 7/2003, de 26 de noviembre, General Presupuestaria, por aplicación del artículo 77 de la misma. Cuando SAS no reintegre de forma voluntaria, el Ministerio procederá con el Acuerdo de Inicio del Procedimiento de Reintegro, aplicándose el interés de demora establecido en el artículo 38.2 de la Ley 38/2003, de 17 de noviembre, General de Subvenciones. El periodo de cálculo de intereses se iniciará desde la fecha de pago hasta la fecha de reintegro voluntario, o hasta la fecha de resolución del procedimiento de reintegro.
f) A los efectos de la certificación y cancelación del Tramo I (anticipo reembolsable FEDER), el MEIC, como Organismo Intermedio del Programa Operativo Crecimiento Inteligente del FEDER, certificará anualmente a la Autoridad de Gestión los gastos elegibles justificados y verificados antes del 1 de octubre de cada año.
Estos retornos alcanzarán una cuantía máxima del 80% del importe del gasto total elegible de las actuaciones presupuestadas para el Tramo I (Fase de I+D) en el anexo I y en el anexo XI que ascienden a seis millones cuarenta mil setecientos ochenta y cuatro euros; por tanto la aportación del feder será de cuatro millones ochocientos treinta y dos mil seiscientos veintisiete euros con veinte céntimos, la de la contraparte SAS será de un millón doscientos ocho mil ciento cincuenta y seis euros con ochenta céntimos, cada uno proporcionalmente a su participación en el presupuesto.
a) El SAS que será beneficiario de las ayudas FEDER, se compromete a realizar las actuaciones y a efectuar los gastos elegibles comprometidos para la finalidad con que aparecen en los anexos I, X y XI del convenio para la fase de I+D (Tramo I), por un importe total de seis millones cuarenta mil setecientos ochenta y cuatro euros, a justificar los mismos ante la SGCi y a ir librando las cantidades correspondientes a la cofinanciación a medida que se vayan realizando las distintas actuaciones del Tramo I (Fase de I+D) de los anexos I y XI.
b) El SAS, en la ejecución de este proyecto, se someterá a lo dispuesto en el Real Decreto Legislativo 3/2011, de 14 de noviembre, que refunde el texto de la Ley de contratos del Sector Público. En particular, ejecutará las actuaciones previstas en la cláusula segunda de acuerdo con lo previsto en el anexo X.
c) El SAS asume la responsabilidad en el estricto cumplimiento de las previsiones establecidas en los artículos 107 y 108 del TFUE y normativa que los desarrolla, en particular en lo referente a las oportunas notificaciones y comunicaciones a la Comisión Europea que en su caso fuesen necesarias.
d) El SAS, de conformidad con el artículo 125.4 b) del Reglamento (CE) 1303/2013, como beneficiario de la ayuda mantendrá un sistema de contabilidad separado para todas las transacciones relacionadas con las operaciones objeto de cofinanciación o, al menos, contará con una codificación contable adecuada que permita identificar claramente dichas transacciones, debiendo distinguir las partidas presupuestarias de la contabilidad nacional y comunitaria. Todo ello, sin perjuicio de las normas de contabilidad nacional.
e) El SAS, de conformidad con lo dispuesto en la disposición adicional segunda b) de la Ley 48/2015, de 29 de octubre, de Presupuestos Generales del Estado para el año 2016, acreditará que se encuentra al corriente del pago de las obligaciones de reembolso de cualesquiera otros préstamos o anticipos concedidos anteriormente con cargo a los Presupuestos Generales del Estado con anterioridad al pago establecido en el presente convenio. Asimismo acreditará que se encuentra al corriente de pago de sus obligaciones tributarias y con la Seguridad Social, y de sus obligaciones por reintegro de subvenciones. Para tal efecto, el beneficiario entregará cumplimentado el modelo establecido en el anexo XII, firmado por persona competente, con anterioridad a la firma del presente convenio de colaboración.
f) El SAS se compromete a informar cuatrimestralmente a la SGCi de la ejecución del convenio en términos de los compromisos adquiridos, los gastos reconocidos y los pagados aportando la correspondiente conciliación bancaria mediante certificación del saldo de la cuenta del proyecto a final del cuatrimestre.
g) El SAS que será beneficiario de las ayudas FEDER, para realizar los procedimientos de contratación pública de innovación deberá realizar consultas previas al mercado, debiendo justificar su realización ante la SGCi. El beneficiario no podrá reservarse la explotación o comercialización con terceros de los resultados de los trabajos realizados, ni directamente ni a través de terceros, ni acometerá acciones que puedan introducir efectos de distorsión de mercado.
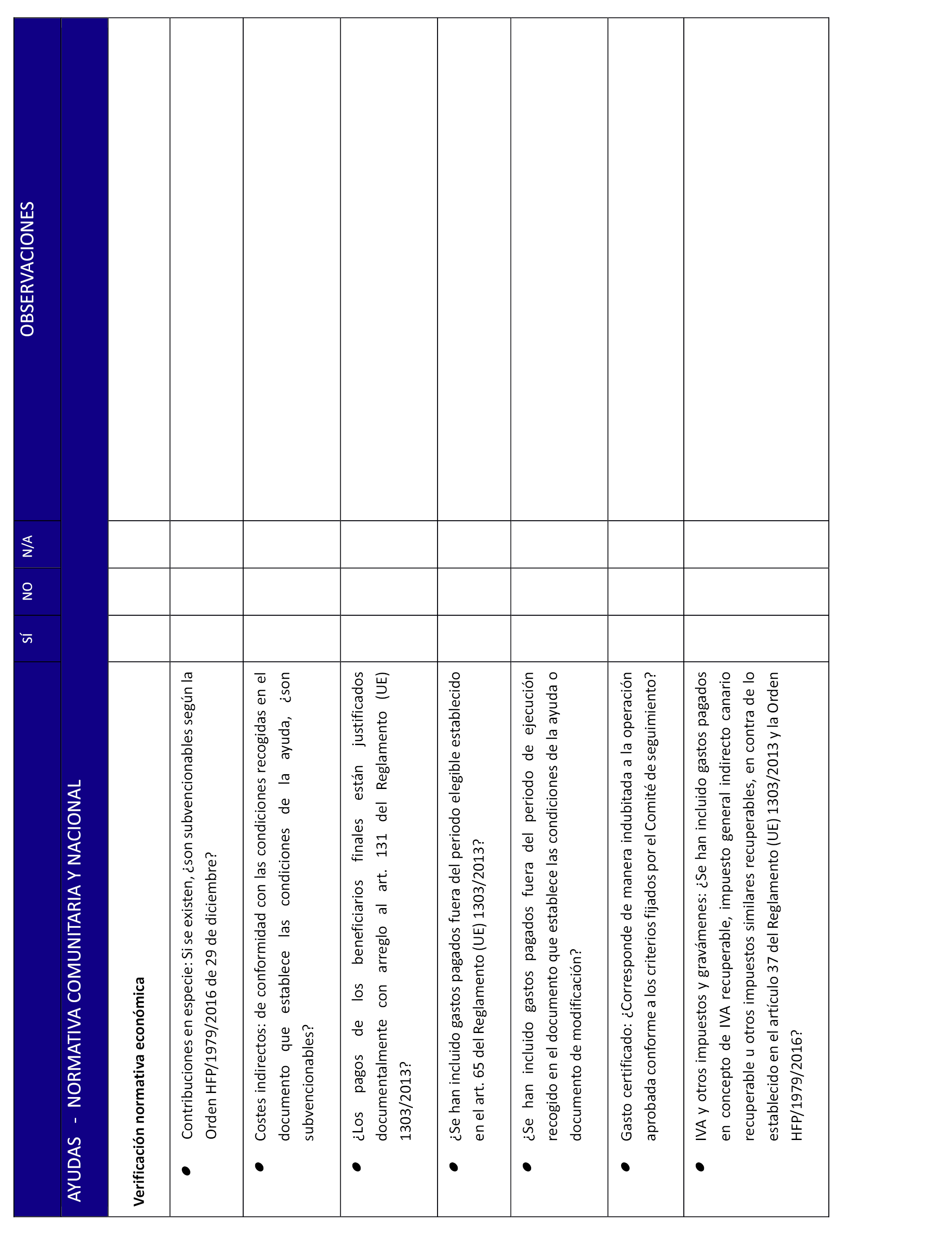
h) Los gastos que se justifiquen al MEIC estarán incluidos entre los considerados elegibles de acuerdo a lo dispuesto en la Orden HFP/1979/2016, de 29 de diciembre, por la que se aprueban las normas sobre los gastos subvencionables de los programas operativos del Fondo Europeo de Desarrollo Regional y del Fondo de Cohesión o norma que la sustituya pudiendo imputarse gastos generales en la medida prevista en ellas. En ningún caso se admitirán gastos generales justificados como cantidades a tanto alzado.
a) El SAS justificará la marcha de las actuaciones presentando una memoria cuatrimestral a la SGCi. Dicha memoria contendrá:
1. Un cuadro que recoja la ejecución presupuestaria de cada línea de actuación, en términos de cantidades comprometidas y efectivamente pagadas por El SAS en el cuatrimestre. Junto con la documentación contable que avale dicho cuadro resumen.
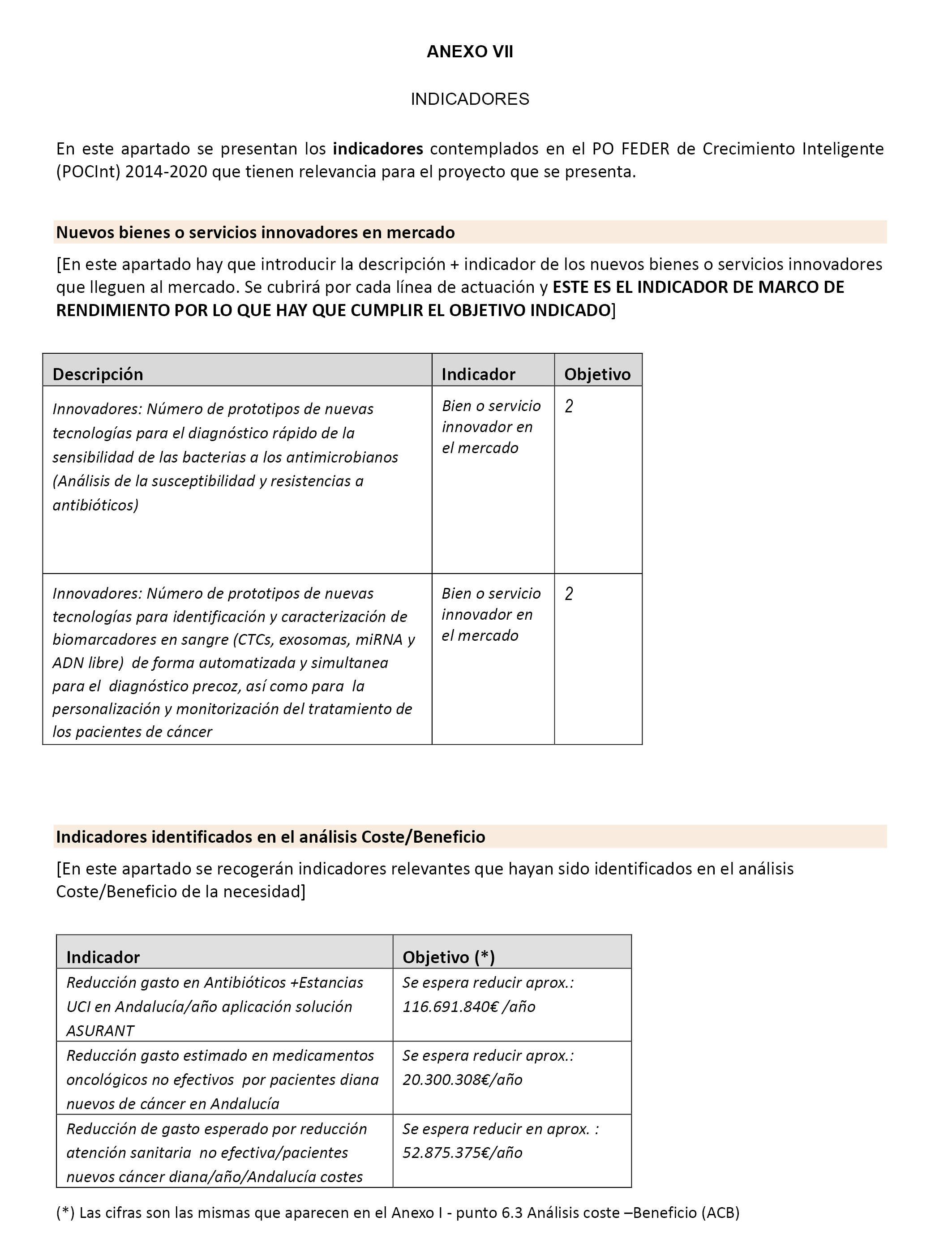
2. Un listado de los principales avances de ejecución y su vinculación con los indicadores del anexo VII.
3. Conciliación bancaria mediante certificación del saldo de la cuenta del proyecto a final del cuatrimestre.
b) Justificación final a la finalización del plazo de ejecución de actuaciones. El SAS tendrá la obligación de justificar a la SGCi los gastos elegibles realizados en la ejecución del proyecto mediante la presentación de una cuenta justificativa consistente en:
1. Certificación por órgano de control independiente del SAS del código contable asignado al proyecto que permita identificar las transacciones relacionadas con el mismo, de la toma de razón contable de la ayuda concedida, de los gastos e inversiones del proyecto, de la salida de fondos para el pago de dichos gastos e inversiones y de la recepción de los bienes financiados. Asimismo se presentará cuenta justificativa completa (con copia de los documentos de gasto y pago).
2. Memoria económica consolidada firmada por el responsable legal del SAS y de los gastos y pagos efectuados según modelo anexo III.
3. Declaración responsable relativa a la financiación de la actividad subvencionada, según anexo IV, que contendrá la relación de todos los ingresos o ayudas que la hayan financiado, con indicación de su importe y procedencia, firmada por el representante legal y con sello del SAS.
4. Declaración responsable, según anexo V, relativa al depósito de la documentación original, con la firma del representante legal del SAS.
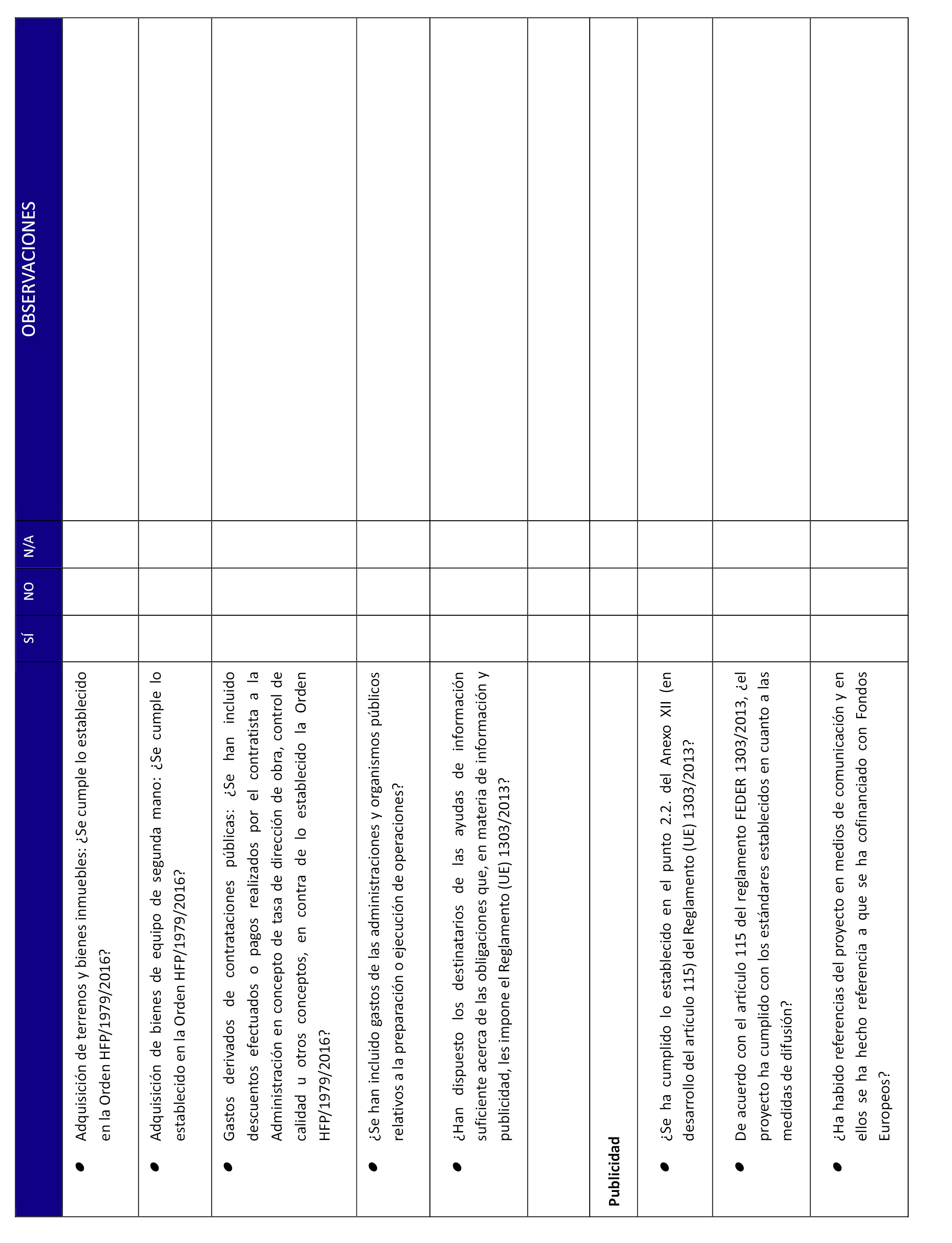
5. Acreditación del cumplimiento de las normas de publicidad. A este efecto se cumplimentará Declaración Responsable según modelo anexo VI. El material gráfico (fotografías, ejemplares de publicaciones,...) que evidencie el cumplimiento de estas normas, se facilitará al Ministerio en formato digital.
6. Cuestionario de los indicadores de resultado de la actividad según modelo del anexo VII.
7. Elaboración por parte del SAS de la lista de control FEDER, según anexo VIII.
8. En el caso de contratos del sector público, certificado del cumplimiento de lo dispuesto en el Real Decreto Legislativo 3/2011, por parte del órgano de control.
9. En el caso de suministro de bienes de equipo y servicios de consultoría y asistencia técnica o prestaciones de análoga naturaleza, cuando el importe no supere la cuantía de 18.000 € (excluido el IVA) para suministros y servicios y de 50.000 € (excluido el IVA) para ejecución de obras, se presentarán, como mínimo, tres ofertas previas de diferentes proveedores. No será necesaria la presentación de dichas ofertas cuando se justifique que no existen en el mercado otras entidades suministradoras.
10. En el caso de bienes inscribibles en un registro público, escritura de inscripción donde conste el importe de la ayuda recibida y el período durante el cual el SAS deberá destinar los bienes al fin concreto para el que se concedió la ayuda que no podrá ser inferior a cinco años. Para el resto de bienes la obligación de destino será de dos años.
11. Memoria de proyecto generador de ingresos de acuerdo con lo previsto en el anexo IX y normativa FEDER aplicable.
12. Memoria técnica justificativa: Se deberá incluir de forma concreta y detallada información sobre el desarrollo y el grado de cumplimiento del proyecto.
Se incluirán los siguientes puntos (en formato libre):
i) Objeto y finalidad del proyecto o actuación.
ii) Contenido y alcance del proyecto. Resultados obtenidos.
iii) Plan de trabajo, con referencia expresa a los hitos del proyecto recogidos en el cuestionario de solicitud.
iv) Descripción detallada y comprensiva de los conceptos imputados cargados en la aplicación de justificación, con referencia a su naturaleza, motivo de imputación y vinculación con el proyecto, así como sus posibles desviaciones respecto a lo presupuestado inicialmente.
v) Justificación de indicadores: Acreditación de los niveles de ejecución de los indicadores recogidos en el anexo VII, firmado por el responsable legal del SAS (formato libre).
c) La justificación final de los gastos deberá realizarse durante los tres meses siguientes a la finalización del periodo de ejecución señalado en la cláusula octava. No obstante lo anterior, el MEIC aceptará una justificación anual para que el SAS pueda acreditar los gastos incurridos hasta la fecha.
d) El impuesto sobre el valor añadido y demás tributos, sólo serán elegibles cuando el beneficiario de la ayuda los haya abonado y no sean susceptibles de recuperación o compensación, lo que deberá acreditarse fehacientemente por el SAS.
A efectos de lo dispuesto en el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo de 17 de diciembre de 2013, el SAS firmarán la declaración responsable recogida como anexo II.
El apoyo a esta actuación será compatible con otras ayudas o subvenciones, cualquiera que sea su naturaleza y la entidad que las conceda, siempre que conjuntamente no superen el coste total de la actuación subvencionada, ni la cofinanciación FEDER supere el 80% el coste financiable y se respeten la intensidad máxima aplicable y las normativas nacional y comunitaria en esta materia, especialmente la incompatibilidad entre diferentes fondos y programas operativos del mismo fondo. Se deberá comunicar, en su caso, a la SGCi y a la Comunidad Autónoma de Andalucía tanto el importe de las mencionadas ayudas como el origen de las mismas.
A esta ayuda le son de aplicación lo dispuesto en el Reglamento (UE) n.º 1301/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre el Fondo Europeo de Desarrollo Regional y sobre disposiciones específicas relativas al objetivo de inversión en crecimiento y empleo y por el que se deroga el Reglamento (CE) n.º 1080/2006; el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se establecen disposiciones comunes relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión, al Fondo Europeo Agrícola de Desarrollo Rural y al Fondo Europeo Marítimo y de la Pesca, y por el que se establecen disposiciones generales relativas al Fondo Europeo de Desarrollo Regional, al Fondo Social Europeo, al Fondo de Cohesión y al Fondo Europeo Marítimo y de la Pesca, y se deroga el Reglamento (CE) n.º 1083/2006 del Consejo; el Reglamento Delegado (UE) n.º 480/2014 de la Comisión, de 3 de marzo de 2014, que complementa el Reglamento (UE) n.º 1303/2013 del Parlamento Europeo y del Consejo.
Para garantizar la correcta ejecución y el seguimiento de la ayuda FEDER asignada en este Convenio se constituirá una Comisión de Seguimiento integrada por seis miembros: tres personas designadas por el MEIC y tres designadas por el SAS. La presidencia de la Comisión corresponde al MEIC a través de la SGCi. La secretaría de la Comisión la ejercerá un representante del SAS.
En el plazo de un mes desde la firma del convenio, las partes designarán a sus representantes y lo comunicarán a las otras partes.
Esta comisión realizará el seguimiento de las actuaciones del convenio y conocerá las dudas y controversias que pudieran surgir en la aplicación e interpretación de las cláusulas del mismo, sin perjuicio de las facultades del MEIC como órgano de control de la ayuda concedida. A fin de poder ejercer sus labores de seguimiento, deberá facilitársele a la comisión en el cuarto trimestre de cada año un estado de la ejecución del proyecto en términos de los compromisos adquiridos, pagados o ejecutados.
Esta comisión de seguimiento no sustituye al órgano concedente en sus competencias conforme a lo establecido en la Ley, 38/2003, de 17 de noviembre, General de Subvenciones.
La comisión de seguimiento se reunirá al menos una vez al año. Con independencia de ello, se reconoce a cada parte firmante la facultad de convocar reuniones de la comisión.
Los miembros de esta comisión no generarán derecho económico alguno por su pertenencia a la misma.
Las posibles modificaciones necesarias para la finalización del proyecto deberán solicitarse, a través de la citada comisión, quien propondrá su aprobación a la SGCi, que será quien deberá resolver expresamente su concesión. Cuando las modificaciones impliquen la alteración de los términos del Convenio, las mismas deberán ser objeto de aprobación por acuerdo de las partes mediante la suscripción de la correspondiente Adenda al presente convenio, previo cumplimiento de todos los trámites y requisitos que resulten preceptivos.
En lo no contemplado por ésta cláusula, sobre el funcionamiento y actuaciones de la comisión, se estará a lo dispuesto por la ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, sobre órganos colegiados.
El plazo de ejecución de actuaciones tendrá una duración máxima de cuatro años contados desde la fecha de entrada en vigor del mismo. Dicho período será destinado íntegra y exclusivamente a las actuaciones previstas en los anexos I, X y XI como tramo I o fase de I+D+i.
El plazo de ejecución de actuaciones podrá ser prorrogado de manera que en ningún caso tenga una duración de más de cuatro años contados desde la fecha de entrada en vigor del convenio.
El plazo de justificación final será de 3 meses contados desde el final del plazo de ejecución.
El presente convenio entrará en vigor en el momento de su firma y su vigencia finalizará cuando se produzca el total cumplimiento de todas las obligaciones asumidas por las partes, entre las que se encuentra el total cumplimiento de la cancelación del anticipo y/o reintegro en su caso de las cantidades debidas. En cualquier caso el periodo de elegibilidad de los gastos se ajustará al periodo de ejecución de actuaciones de cada tramo establecido en la cláusula octava.
De conformidad con el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, el convenio resultará eficaz una vez inscrito en el Registro Electrónico estatal de Órganos e Instrumentos de Cooperación del sector público estatal, al que se refiere la disposición adicional séptima y publicado en el «Boletín Oficial del Estado».
a) En caso de extinción del convenio deberán concluirse las actuaciones iniciadas al amparo de este convenio, realizándose la liquidación económica y administrativa de las obligaciones contraídas hasta el momento.
b) Serán causas de su resolución y revocación, las siguientes:
1. El acuerdo expreso y escrito de las partes.
2. El incumplimiento por alguna de las partes de cualquiera de las prescripciones sustanciales contenidas en este convenio, lo que se comunicará por aquella que la invoque a las otras de manera fehaciente. Se considerarán prescripciones sustanciales los contenidos íntegros de los anexos I (apartados 5 y 6), X y XI.
3. La cancelación total o parcial del proyecto por causas imputables al SAS o a sus contratistas/subcontratistas.
4. La aplicación, por parte del SAS de la financiación a finalidades y actuaciones distintas de las previstas en este convenio y en sus anexos I, X y XI.
5. El incumplimiento de la obligación de justificación cuatrimestral y/o final.
6. El incumplimiento de los indicadores FEDER asociados al marco de rendimiento, de acuerdo con lo establecido en el anexo VII.
7. El incumplimiento por parte del SAS de las obligaciones derivadas de los artículos 107 y 108 del TFUE y normativa que los desarrolla, en particular en lo referente a las oportunas notificaciones y comunicaciones a la Comisión Europea que en su caso fuesen necesarias.
c) En el caso de resolución del convenio según lo establecido en los apartados anteriores procederá el reintegro de los importes correspondientes más los eventuales intereses de demora calculados de acuerdo con lo previsto en el artículo 38.2 de la Ley 38/2003, de 17 de noviembre, General de Subvenciones.
d) En cuanto a la forma en la que habrán de concluirse las actuaciones correspondientes al tramo I, se actuará de acuerdo con las normas específicas reguladoras del FEDER y los Fondos Estructurales.
e) En el caso de existir más de una parte beneficiaria, los distintos beneficiarios responderán solidariamente en caso de resolución total o parcial del convenio.
Las partes firmantes se comprometen a hacer constar la colaboración del MEIC en todas las actividades informativas o de promoción en relación con las actuaciones contempladas en este Convenio. Asimismo, se comprometen a observar estrictamente la normativa aplicable en materia de publicidad de los Fondos Estructurales que cofinancian las actuaciones.
Dado que el proyecto está cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), se realizará la mención correspondiente de acuerdo con lo establecido en el anexo XII, 2.2, del Reglamento (UE) n.º 1303/2013, de 17 de diciembre de 2013 y art. 4 y 5 y anexo II del Reglamento de Ejecución (UE) n.º 821/2014, de 28 de julio de 2014.
El régimen jurídico aplicable será el establecido en la normativa comunitaria relativa a la aplicación de Fondos FEDER, se aplicará supletoriamente el régimen de la Ley 38/2003, de 17 de noviembre, General de Subvenciones, según lo establecido en su artículo 6 y en el artículo 7 de su Reglamento de desarrollo aprobado por R.D. 887/2006, de 21 de julio.
El convenio se rige por lo dispuesto en el capítulo VI del Título preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
En prueba de conformidad, las Partes firman el presente Convenio por duplicado ejemplar y a un solo efecto en el lugar y fecha arriba indicados.–Por el Ministerio de Economía, Industria y Competitividad, Juan María Vázquez Rojas, Secretario General de Ciencia e Innovación.–Por el Servicio Andaluz de Salud (SAS), Mariano Marín Patón, Director Gerente del SAS.
DIAGNÓSTICO Y TRATAMIENTO DE PRECISIÓN EN ENFERMEDADES INFECCIOSAS Y CÁNCER (DyT-PRECISIÓN)
Desarrollo de nuevas soluciones para el diagnóstico avanzado y tratamiento efectivo de enfermedades infecciosas y cáncer
De manera específica se pretende:
– Desarrollar soluciones que resuelvan el reto del manejo efectivo de las resistencias bacterianas a antibióticos mediante la reducción del tiempo de diagnóstico de resistencias.
– Desarrollar soluciones efectivas de diagnóstico oncológico en sangre circulante (biopsia líquida) para la prevención, tratamiento y control de la enfermedad.
La disponibilidad de soluciones rápidas, no invasivas y coste efectivas permitirán mejorar el manejo, prevención y tratamiento de dos grandes problemas de salud como son el cáncer y las infecciones por bacterias resistentes al tratamiento antibiótico, con el consiguiente impacto en la salud de los ciudadanos y la sostenibilidad de los sistemas sanitarios públicos.
Los sistemas existentes y que las soluciones que se buscan pretenden sustituir son costosos y de efectividad clínica limitada, aunque hay mucho trabajo de desarrollo en estas líneas, no existen en el mercado soluciones de aplicación inmediata y generalizada en la práctica asistencial habitual.
Proyecto de Servicio Andaluz de Salud, SAS a la línea de Fomento de la Innovación desde la demanda. Al amparo del Programa Operativo FEDER de I+D+i 2014-2020
Índice
1. Objeto.
2. Entidades que colaboran.
2.1 MEIC.
2.2 Beneficiario/s.
2.2.a. Servicio Andaluz de Salud (SAS).
3. Líneas de actuación.
4. Ejecución del convenio.
4.1 Oficina de proyecto.
4.2 Empleo CPI.
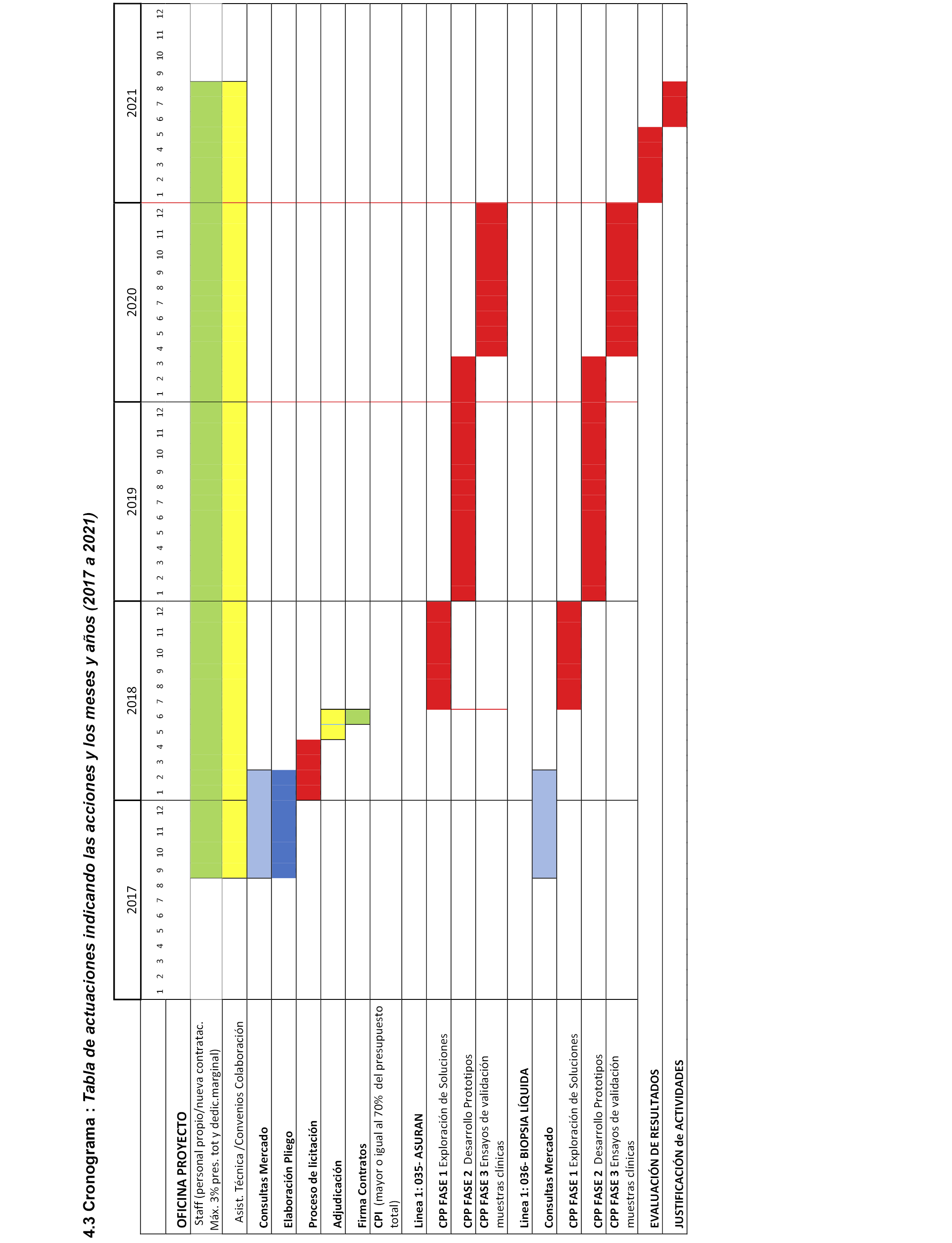
4.3 Cronograma.
5. Presupuesto.
6. Resultados.
6.1 Nuevos bienes o servicios innovadores en mercado.
6.2 Mejoras del servicio público.
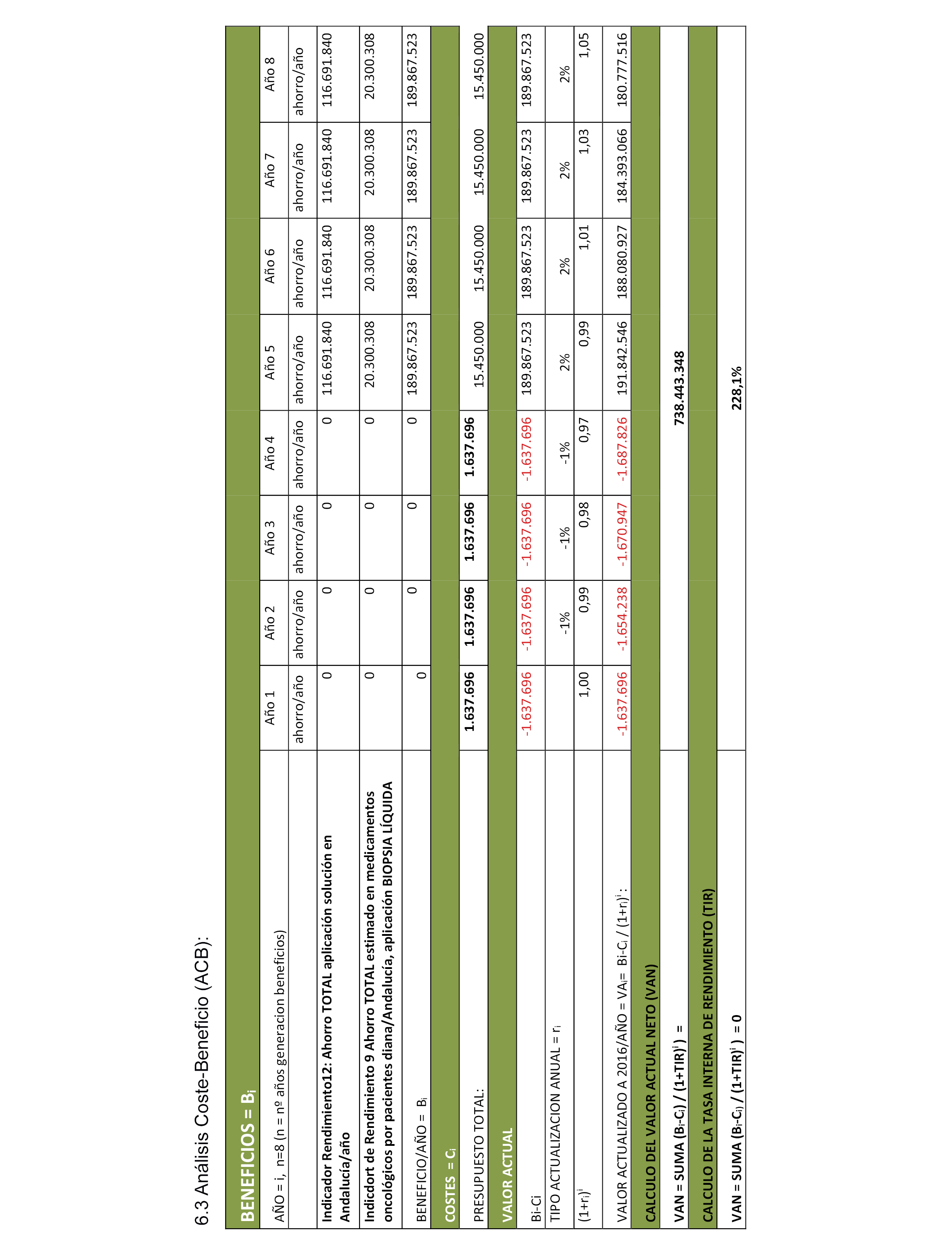
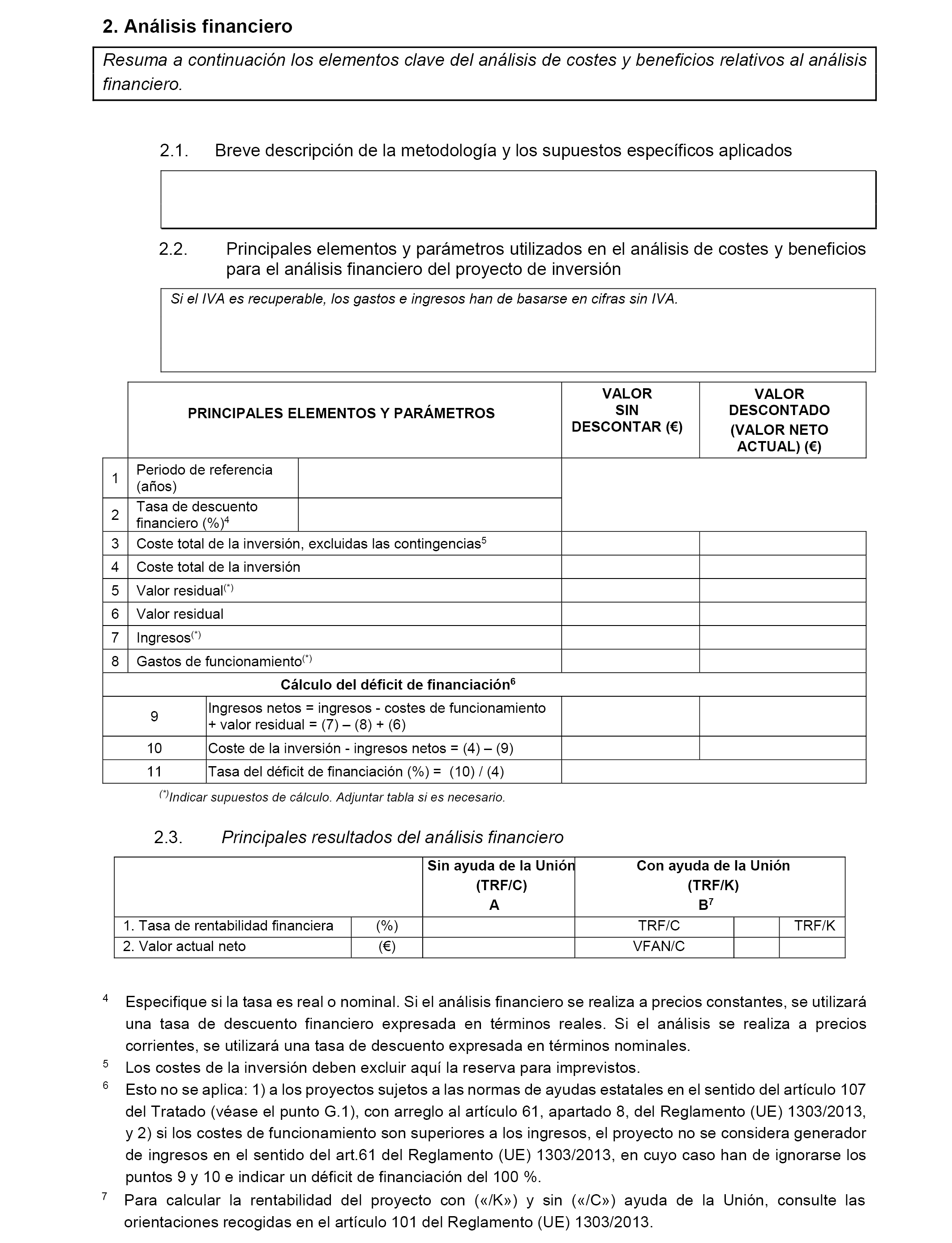
6.3 Análisis Coste-Beneficio (ACB).
1. Objeto
El objeto del presente convenio es la selección de proyectos para su cofinanciación por el FEDER 2014-2020, y más específicamente para el proyecto «Diagnóstico y tratamiento de precisión en enfermedades infecciosas y cáncer» (DyT-Precisión) Asimismo mediante el presente convenio se establecen las obligaciones y derechos del organismo beneficiario de los fondos FEDER, aplicados para la ejecución del antedicho proyecto.
El programa de innovación «Diagnóstico y tratamiento de precisión en enfermedades infecciosas y cáncer» (DyT-Precisión) tiene por objetivo desarrollar soluciones que permitan un diagnóstico más rápido, seguro y eficiente de resistencias antimicrobianas que los existentes actualmente de manera que permita instaurar un tratamiento antibiótico efectivo que impida el desarrollo de nuevas resistencias.
– Disminuir la morbimortalidad asociada a infecciones por agentes microbianos resistentes.
– Disminuir los costes asociados a tratamientos inefectivos de infecciones resistentes.
– El desarrollo y validación de un prototipo que permita la identificación y caracterización de biomarcadores en sangre de forma automatizada y simultánea para la personalización y monitorización del tratamientos de pacientes oncológicos (biopsia líquida).
– Diseño e implantación de un protocolo clínico integral de aplicación de la solución a pacientes con diagnósticos específicos de cáncer.
– Despliegue, en su caso, de la soluciones desarrolladas y validadas en el sistema sanitario público de Andalucía.
«Diagnóstico y tratamiento avanzados en enfermedades infecciosas y cáncer» (DyT-Precisión) se dirige a resolver problemas de salud pública relevantes en los campos de las enfermedades infecciosas y oncológicas:
Las infecciones producidas por agentes microbianos resistentes a antibióticos es un problema para la salud individual y colectiva de gran envergadura.
La rapidez en la determinación de los antibióticos efectivos ante el agente infeccioso es fundamental para poder acertar en la elección de antibióticos que permitan la rápida recuperación y no generar más resistencias antimicrobianas por las siguientes razones:
– Las infecciones graves por bacterias multirresistentes tienen mal pronóstico.
– Comienzo del tratamiento antibiótico apropiado con frecuencia se demora hasta las 48-72 h. del diagnóstico, por la lentitud de los sistemas actuales para determinar la sensibilidad de las bacterias a los antibióticos.
– El tratamiento antibiótico apropiado precoz es un factor protector frente a la muerte en estas infecciones.
Se necesitan por tanto nuevos métodos para realizar el diagnóstico rápido de la sensibilidad de las bacterias a los antimicrobianos.
El diagnóstico para la clasificación de los pacientes oncológicos y la prescripción de los fármacos diana se basan en el análisis del tejido tumoral que tiene serias limitaciones: de acceso, es doloroso, es costoso, no siempre es posible y una vez tomada no se puede usar para ver la eficiencia del tratamiento.
Las técnicas actuales para el diagnóstico de tumores sólidos en general, tienen pues muchas y evidentes limitaciones para valorar de modo ágil, no invasivo y económicamente asumible el proceso evolutivo del cáncer y de las metástasis. No obstante, El objeto del presente proyecto consiste en el desarrollo de un de un prototipo de análisis multiplexado de detección de biomarcadores circulantes (CTC, miRNA, cfDNA y exosomas) en sangre de pacientes oncológicos para la monitorización de la eficacia de las terapias así como para mejorar el pronóstico y el diagnóstico del cáncer.
1.1 Línea 1: Análisis de la susceptibilidad y resistencia microbiana a antibióticos (ASURANT).
Es conocido que la eficacia de los antibióticos se está reduciendo rápidamente. En muchos países, incluido el nuestro, existen casos puntuales de infecciones causadas por bacterias panresistentes, es decir resistentes a todos los antibióticos conocidos, y no son infrecuentes las infecciones por bacterias sensibles solo a un antimicrobiano. En consecuencia, las resistencias a los antibióticos producen una enorme cantidad de muertes, de sufrimientos, y de gasto sanitario, y además, suponen una seria amenaza para los avances médicos, y para la sostenibilidad de los sistemas sanitarios.
La rapidez en la determinación de los antibióticos efectivos ante el agente infeccioso es fundamental para poder acertar en la elección de antibióticos que permitan la rápida recuperación y no generar más resistencias antimicrobianas por las siguientes razones:
– Las infecciones graves por bacterias multirresistentes tienen mal pronóstico.
– Comienzo del tratamiento antibiótico apropiado con frecuencia se demora hasta las 48-72 h. del diagnóstico, por la lentitud de los sistemas actuales para determinar la sensibilidad de las bacterias a los antibióticos.
– El tratamiento antibiótico apropiado precoz es un factor protector frente a la muerte en estas infecciones.
Existe en la actualidad una clara necesidad de desarrollar nuevos métodos para realizar el diagnóstico rápido de la sensibilidad de las bacterias a los antimicrobianos dado el aumento de las tasas de mortalidad en las UCIs hospitalarias de todo el mundo causadas por este tipo de patógenos:
– 18 % pacientes infectados o colonizados con A. baumannii desarrolló bacteriemia: Mortalidad del 34%.
– A. baumannii causa neumonía asociada a ventilación: Mortalidad del 40%.
– Responsable de otras infecciones severas: Mortalidad del 25%.
– P. aeruginosa. Neumonía asociada a ventilación: Mortalidad del 34%-68%. Mayor tasa de bacteriemia (18-61%).
– E. coli: Aumento 18% a 28% de resistencias a beta-lactámicos de amplio espectro.
La implementación y uso de un dispositivo que permita un diagnóstico rápido de las resistencias en la práctica clínica habitual permitiría una mejora de los índices de supervivencia por infecciones en UCI y provocaría una reducción del porcentaje de bacterias resistentes en hospitales al usar menos antibióticos ineficaces. Además, la introducción de nuevas técnicas de diagnóstico rápidas, fiables y coste-efectivas, en particular, tecnología diagnóstica point-of-care (POC) como la presente, mejoraría el desarrollo de nuevos antibióticos y su administración a los pacientes. Estas herramientas ayudarían a mejorar el reclutamiento de pacientes para ensayos clínicos, asegurando que el sujeto cumple con los criterios de inclusión lo cual disminuiría el coste y tiempo del ensayo clínico.
Existen numerosas técnicas para la determinación de la susceptibilidad a antibióticos. Las técnicas clásicas, como las diluciones seriadas en medio de crecimiento microbiano y la técnica de difusión de disco de Bauer-Kirby (Woods GL & Washington JA.), necesitan 72 h. desde el procesamiento de la muestra hasta la obtención de los resultados de susceptibilidad. Por tanto, reducir el tiempo hasta conseguir resultados objetivos, sin afectar la precisión y la reproducibilidad, para la implementación de la terapia correcta es de crucial importancia en los laboratorios clínicos microbiológicos.
En estos momentos, un equipo de investigación de Andalucía en el marco del proyecto europeo MagicBullet del Séptimo Programa Marco, ha validado preliminarmente la aplicación de la tecnología de la microencapsulación para determinar la susceptibilidad rápida a antimicrobianos por parte de microorganismos patógenos multirresistentes. Hasta el momento se han determinado patrones de resistencia a antibióticos en patógenos oportunistas como Acinetobacter baumanii y se han identificado clones resistentes en poblaciones mayoritariamente sensibles. Dichos resultados han dado lugar a dos solicitudes de patente (P201330933, PCT/ES2014/070511) que podrían dar protección a un procedimiento para la determinación de patrones de susceptibilidad a antibióticos de microorganismos basado en la microencapsulación mediante enfocamiento de flujo.
Objetivos:
Desarrollo y fabricación de un método de diagnóstico rápido de la sensibilidad de las bacterias a los antibióticos, basado en microencapsulación en polímeros biocompatibles y en análisis de las microcolonias para mejorar el pronóstico de los pacientes con infecciones graves, reduciendo su mortalidad y morbilidad.
La solución que se persigue debería:
1) Basarse en la microencapsulación en polímeros biocompatibles y en el análisis de microcolonias usando muestras clínicas humanas.
2) Permitir la determinación de patrones poblacionales sin necesidad de aislar cepas en menor tiempo.
3) Disminuir el tiempo de estancias en UCIs y aumente el acierto en la elección terapéutica.
4) Reducir el uso abusivo de cócteles de antibióticos de uso hospitalario.
5) Establecer configuración amigable que mejore su aplicabilidad y usabilidad clínica.
Inicialmente, se plantea el desarrollo de un prototipo semiautomatizado para la determinación de la susceptibilidad a antimicrobianos (Objetivo 1). Una vez desarrollado, se establecerá el protocolo y procedimiento de tratamiento de muestras de esputo para la implementación de la tecnología en las UCIs del SNS (Objetivos 2-5). Se realizará un ensayo clínico piloto del prototipo desarrollado en la Fase I y de acuerdo a los protocolos y procedimientos establecidos en la Fase II (Objetivo 3).
1.2 Línea 2: Nuevo sistema diagnóstico para biopsia líquida (biopsia líquida).
El cáncer es una de las principales causas de muerte en los países más desarrollados y sobre todo la que mayor impacto social tiene debido a los largos, costosos y -muchas veces- poco eficientes tratamientos.
El diagnóstico para la clasificación de los pacientes oncológicos y la prescripción de los fármacos diana se basan en el análisis del tejido tumoral que tiene serias limitaciones: de acceso, es doloroso, es costoso, no siempre es posible y una vez tomada no se puede usar para ver la eficiencia del tratamiento.
La comunidad científica ha validado el uso de distintos marcadores que se encuentran en la circulación periférica y han demostrado ser capaces de diagnosticar y monitorizar el cáncer de manera más eficiente: células tumorales circulantes (CTCs), ácidos nucleicos (miRNA y cfDNA) y exosomas. Dichos estudios nos han permitido determinar su potencial papel en el proceso metastásico y de manera global se ha denominado como «biopsias líquidas».
Las técnicas actuales para el diagnóstico de tumores sólidos en general, tienen pues muchas y evidentes limitaciones para valorar de modo ágil, no invasivo y económicamente asumible el proceso evolutivo del cáncer y de las metástasis. No obstante, El objeto del presente proyecto consiste en el desarrollo de un de un prototipo de análisis multiplexado de detección de biomarcadores circulantes (CTC, miRNA, cfDNA y exosomas) en sangre de pacientes oncológicos para la monitorización de la eficacia de las terapias así como para mejorar el pronóstico y el diagnóstico del cáncer.
Objetivos:
Esta línea de acción pretende el desarrollo de un prototipo que permita la identificación y caracterización de biomarcadores en sangre (CTCs, exosomas, miRNA y ADN libre) de forma automatizada y simultanea para el diagnóstico precoz, así como para la personalización y monitorización del tratamiento de los pacientes.
Complementariamente se requiere el diseño e implantación de un protocolo clínico integral para la determinación de biomarcadores sanguíneos (CTCs, exosomas, miRNA y ADN libre) que irá desde la recogida de muestra hasta la decisión clínica.
La generación del prototipo se centrará en pacientes oncológicos afectos de tumores sólidos de mama y colon en estadios tempranos y metastásico (eventualmente: pulmón, próstata, páncreas).
La solución debería:
1) Diagnosticar de manera sencilla y menos invasiva al paciente oncológico.
2) Monitorizar la respuesta al tratamiento y establecer tratamientos personalizados.
3) Pronosticar la aparición de recaídas.
4) Establecer costes de producción de alrededor de 25 € y adecuado para los grandes volúmenes que se requieren.
5) Generar meta-análisis que apoyen la toma de decisiones.
6) Desarrollar un protocolo transversal, dentro de los sistemas de salud, que faciliten la gestión integral del proceso.
2. Entidades que colaboran
2.1 Ministerio de Economía, Industria y Competitividad (MEIC):
La Secretaría de Estado de I+D+i (SEIDi) y, en particular, la Secretaría General de Ciencia e Innovación (SGCi), del Ministerio de Economía, Industria y Competitividad (MEIC), y, dentro de la misma, a través de la Subdirección General de Fomento de la Innovación (SGFI) tienen entre sus objetivos el impulso de la Compra Pública Innovadora como instrumento para mejorar los servicios públicos al tiempo que fortalecer las capacidades innovadoras de las empresas, de acuerdo con el Real Decreto 345/2012, de 10 de febrero, que desarrolla la estructura orgánica básica del Ministerio de Economía, Industria y Competitividad, modificado por el Real Decreto 1067/2015, de 27 de noviembre, por el que se crea la Agencia Estatal de Investigación y se aprueba su Estatuto.
En particular la SGFI, en base a su experiencia como órgano impulsor de programas de CPI, asesorará a los beneficiarios en la definición de las arquitecturas financieras de CPI con objeto de maximizar el impacto en la innovación empresarial de la presente propuesta. Los beneficiarios consultarán preceptivamente con la SGFI en la elaboración y puesta en marcha de actuaciones de CPI así como en la definición de indicadores y medidas tendentes a fomentar la competitividad empresarial.
2.2 Servicio Andaluz de Salud (SAS).
El Servicio Andaluz de Salud, creado en 1986 (Ley 8/1986, de 6 de mayo, del Servicio Andaluz de Salud, «BOJA» n.º 41, de 10/05/1986), de acuerdo con lo previsto en el artículo 64 de la Ley 2/1998, de 15 de junio, de Salud de Andalucía («BOJA» núm. 74, de 4 de julio y «BOE» núm. 185, de 4 de agosto) tiene como misión prestar atención sanitaria a las ciudadanas y ciudadanos andaluces, ofreciendo servicios sanitarios públicos de calidad, asegurando la accesibilidad, equidad y satisfacción de los usuarios, buscando la eficiencia y el aprovechamiento óptimo de los recursos.
El Servicio Andaluz de Salud es una agencia administrativa de las previstas en el artículo 65 de la Ley 9/2007, de 22 de octubre, y respecto al régimen de contratación se rige por el Decreto 39/2011, de 22 de febrero, por el que se establece la organización administrativa para la gestión de la contratación de la Administración de la Junta de Andalucía y sus entidades instrumentales y se regula el régimen de bienes y servicios homologados. Considerando este marco legal y la Ley 1/2014, de 24 de junio, de Transparencia Pública de Andalucía, cualquier entrada de dinero a través de este programa se realizará de forma objetiva y transparente, y evitando ventaja económicas para el SAS. La compensación económica estimada para este programa de innovación no superará el nivel necesario para cubrir total o parcialmente los gastos ocasionados. Así, el SAS cumple los requerimientos indicados en la STJCE de 24 de julio de 2003, Altmark.
Por lo tanto el SAS cumple con las condiciones de servicio público según lo recogido en la Ley 2/1998, de 15 de junio, de Salud de Andalucía («BOJA» núm. 74, de 4 de julio y «BOE» núm. 185, de 4 de agosto. El SAS:
1) Ejerce exclusivamente obligaciones de servicio público.
2) Las obligaciones y funciones del SAS están claramente definidas en la mencionada Ley 2/1998, de 15 de junio, de Salud de Andalucía.
3) Considerando este marco legal, es conveniente aclarar que cualquier entrada de dinero a través de este programa se realizará de forma objetiva y transparente, y evitando ventajas económicas para el SAS respecto a cualquier otra entidad.
4) La compensación económica estimada para este programa de innovación no superará el nivel necesario para cubrir total o parcialmente los gastos ocasionados.
5) Finalmente todas las obligaciones de servicio público se van a realizar conforme a un procedimiento de contratación pública que permita seleccionar al candidato capaz de prestar estos servicios al menor coste para la colectividad. Por lo tanto el El Servicio Andaluz de Salud cumple los requerimientos indicados en la STJCE de 24 de julio de 2003, Altmark.
3. Líneas de actuación
Este convenio se articula en torno a dos líneas de actuación centradas en análisis de la susceptibilidad y resistencia microbiana a antibióticos y en nuevo sistema diagnóstico para biopsia líquida.
3.1 Línea 1. Análisis de la susceptibilidad y resistencia microbiana a antibióticos (SURAN).
3.1.1 Descripción.
Existen numerosas técnicas para la determinación de la susceptibilidad a antibióticos, revisadas por Jorgensen y Ferraro (Medical Microbiology CID 2009). Las técnicas clásicas, como las diluciones seriadas en medio de crecimiento microbiano y la técnica de difusión de disco de Bauer-Kirby (Woods GL & Washington JA.), necesitan 72 h. desde el procesamiento de la muestra hasta la obtención de los resultados de susceptibilidad. Por tanto, reducir el tiempo hasta conseguir resultados objetivos, sin afectar la precisión y la reproducibilidad, para la implementación de la terapia correcta es de crucial importancia en los laboratorios clínicos microbiológicos.
En estos momentos, un equipo de investigación de Andalucía en el marco del proyecto europeo MagicBullet del Séptimo Programa Marco, ha validado preliminarmente la aplicación de la tecnología de la microencapsulación para determinar la susceptibilidad rápida a antimicrobianos por parte de microorganismos patógenos multirresistentes. Hasta el momento se han determinado patrones de resistencia a antibióticos en patógenos oportunistas como Acinetobacter baumanii y se han identificado clones resistentes en poblaciones mayoritariamente sensibles. Dichos resultados han dado lugar a dos solicitudes de patente (P201330933, PCT/ES2014/070511) que podrían dar protección a un procedimiento para la determinación de patrones de susceptibilidad a antibióticos de microorganismos basado en la microencapsulación mediante enfocamiento de flujo.
3.1.2 Existencia de soluciones similares en el mercado.
A continuación se resumen las principales tecnologías existentes en el mercado incluyendo las desventajas que presentan frente a la tecnología que se pretende desarrollar en el presente proyecto:
– Sistemas automatizados actuales (Siemens HealthCare Diagnostics; Trek Diagnostics Systems): Alto precio, sistemas cerrados.
– Encapsulación para análisis individualizado de microorganismos (con o sin microfluídica): Sufrimiento celular (temperaturas altas), depende de citometría de flujo.
– Sistema de microfluídica (Lab on chip): Tratamiento de imágenes complejo, Sufrimiento celular (temperaturas altas), Microfluídica.
– Cellena®-Flow Focusing: Costosa y compleja de manejar.
– Genotipado: Necesario conocimiento previo del agente infeccioso y de genes de resistencia.
En este escenario, la presente tecnología permitiría reducir el tiempo hasta obtención de resultados a 12 h. frente a las 48-72 h. actuales sin afectar precisión y reproducibilidad. Además, permitiría la posibilidad de determinación de patrones poblacionales sin necesidad de aislar cepas, reduciendo 6 veces el tiempo para obtener resultados. Esto puede significar menor tiempo de estancias en UCIs, valorado en más de 3.000 euros/día, asegurar una elección terapéutica acertada y sobre todo, un menor abuso de cócteles de antibióticos de uso hospitalario, que están causando graves problemas de resistencias a antimicrobianos.
3.1.3 Población objeto de la mejora del servicio público (Población Diana).
Pacientes con infecciones graves por patógenos multirresistentes; Profesionales médicos de los servicios de Enfermedades Infecciosas, Microbiología y Cuidados Críticos.
3.1.4 Objetivos globales del proyecto.
Desarrollo y fabricación de un método de diagnóstico rápido de la sensibilidad de las bacterias a los antibióticos, basado en microencapsulación en polímeros biocompatibles y en análisis de las microcolonias para mejorar el pronóstico.
3.1.5 Objetivos específicos del proyecto.
1) Se base en la microencapsulación en polímeros biocompatibles y en el análisis de microcolonias usando muestras clínicas humanas.
2) Permitir la determinación de patrones poblacionales sin necesidad de aislar cepas en menor tiempo.
3) Disminuir el tiempo de estancias en UCIs y aumente el acierto en la elección terapéutica.
4) Reducir el uso abusivo de cócteles de antibióticos de uso hospitalario.
5) Establecer configuración amigable que mejore su aplicabilidad y usabilidad clínica.
3.1.6 Interacción entre los distintos objetivos, actividades, tareas…
Inicialmente, se plantea el desarrollo de un prototipo semiautomatizado para la determinación de la susceptibilidad a antimicrobianos (Objetivo 1). Una vez desarrollado, se establecerá el protocolo y procedimiento de tratamiento de muestras de esputo para la implementación de la tecnología en las UCIs del SNS (Objetivos 2-5). Se realizará un ensayo clínico piloto del prototipo desarrollado en la Fase I y de acuerdo a los protocolos y procedimientos establecidos en la Fase II (Objetivo 3).
3.2 Línea 2. Nuevo sistema diagnóstico para biopsia líquida (Biopsia Líquida).
3.2.1 Descripción.
El cáncer es una de las principales causas de muerte en los países más desarrollados y sobre todo la que mayor impacto social tiene debido a los largos, costosos y –muchas veces– poco eficientes tratamientos.
Todos los diagnósticos para la clasificación de los pacientes y la prescripción de fármacos diana se basan en el análisis del tejido tumoral (biopsia sólida) y tienen ciertas limitaciones: de acceso, es dolorosa, es costosa…
La comunidad científica ha validado el uso de distintos marcadores que se encuentran en la circulación periférica y han demostrado ser capaces de diagnosticar y monitorizar el cáncer de manera más eficiente: células tumorales circulantes (CTCs), ácidos nucleicos (miRNA y cfDNA) y exosomas. Dichos estudios nos han permitido determinar su potencial papel en el proceso metastásico y de manera global se ha denominado como «biopsias líquidas».
Actualmente, existen más de 50 EECC en el mundo para determinar la eficacia de la biopsia liquida, entre ellos 14 EECC para evaluar miRNA circulantes como biomarcadores de cáncer. Ej: The Role of microRNA-29b in the Oral Squamous Cell Carcinoma NCT02009852. No obstante, detectar cuantitativamente estos marcadores circulantes en forma multipléxica, con metodologías sencillas y no invasivas para los pacientes y ligadas a sus historiales clínicos que permita una actuación clínica adecuada y personalizada es la respuesta que este desarrollo innovador debe dar.
3.2.2 Existencia de soluciones similares en el mercado.
Actualmente, existe un test no invasivo aprobado para el diagnóstico y la monitorización del cáncer con el objetivo de seguir el proceso evolutivo de las metástasis sin necesitar tejido tumoral. Se basa en el uso de células tumorales circulantes (CTCs) y la FDA norteamericana ha aprobado un dispositivo, CellSearch, para su cuantificación que permite diagnosticar y pronosticar el cáncer. Su falta de especificidad y un grado muy limitado de versatilidad junto a los costos asociados a este equipo han impedido su implementación en sistemas de salud públicos. Por otro lado, Merck Serono ha aplicado para conseguir la marca CE-IVD de un producto que permite la detección e identificación de mutaciones RAS (KRAS y NRAS) en ADN libre circulante para pacientes de cáncer colorrectal metastásico.
Sin embargo, no existe en el mercado ningún dispositivo que permita llevar a cabo la detección simultánea de varios de estos biomarcadores.
3.2.3 Población objeto de la mejora del servicio público (Población Diana).
La generación del prototipo se centrará en pacientes oncológicos afectos de tumores sólidos de mama y colon en estadios tempranos y metastásico (eventualmente: pulmón, próstata, páncreas).
3.2.4 Objetivos globales del proyecto.
Desarrollo de un prototipo que permita la identificación y caracterización de biomarcadores en sangre (CTCs, exosomas, miRNA y ADN libre) de forma automatizada y simultanea para el diagnóstico precoz, así como para la personalización y monitorización del tratamiento de los pacientes.
Diseño e implantación de un protocolo clínico integral para la determinación de biomarcadores sanguíneos (CTCs, exosomas, miRNA y ADN libre) que irá desde la recogida de muestra hasta la decisión clínica
3.2.5 Objetivos específicos del proyecto.
1) Diagnosticar de manera sencilla y menos invasiva al paciente oncológico
2) Monitorizar la respuesta al tratamiento y establecer tratamientos personalizados.
3) Pronosticar la aparición de recaídas
4) Establecer costes de producción de alrededor de 25 € y adecuado para los grandes volúmenes que se requieren.
5) Generar meta-análisis que apoyen la toma de decisiones
6) Desarrollar un protocolo transversal, dentro de los sistemas de salud, que faciliten la gestión integral del proceso.
3.2.6 Interacción entre los distintos objetivos, actividades, tareas…
A) Detección de necesidades: necesidades técnicas y funcionales de la tecnología.
B) Consultas preliminares al mercado: previo al proceso de contratación, que aseguren la viabilidad y el éxito del proyecto planteado.
C) Licitación y gestión del Producto en modalidad de Compra Pública Innovadora (X3).
D) Validación del funcional de prototipo entregado: Testeo en una muestra residual del correcto funcionamiento del prototipo entregado.
4. Ejecución del Convenio y cronograma
4.1 Oficina de proyecto.
4.1.1 Equipo gestor.
Intervención & control financiero: Carlos González Laguillo Interventor Central del Servicio Andaluz de Salud (SAS).
Asesoría jurídica: Servicio de Asesoría Jurídica del Servicio Andaluz de Salud y de la Consejería de Salud.
Gestores: Titular de la Dirección General del SAS; Titular de la Secretaría General de I+D+i de la Consejería competente en materia de Salud; Titular de la Dirección General de Gestión Económica y Servicios Sociales de SAS; Titular de la Dirección General de Asistencia Sanitaria y Resultados en Salud del SAS; Titular de la Subdirección de Compras y Logística del SAS.
Mecanismos de coordinación: Unidad Técnica de Coordinación: titular de la Coordinación de la Estrategia de CPI del SSPA; titular de la Subdirección de Compras y Logística del SAS; un Técnico Superior designado por la Dirección General de Gestión Económica y Servicios del SAS; un representante de la Oficina Transferencia Tecnológica del SAS; titular de la Jefatura de Servicio de Innovación-Consejería competente en materia de Salud.
Otros: Los Gestores constituyen el Comité de Dirección del Proyecto responsable de las decisiones estratégicas. La unidad Técnica de Coordinación se encarga de la gestión logística y la coordinación de operaciones con las unidades administrativas responsables de la compra y el Grupo Técnico responsable del control y evaluación del desarrollo tecnológico.
4.1.2 Equipo técnico.
Línea 1: Análisis de la susceptibilidad y resistencia microbiana a antibióticos (ASURANT).
Dr. José Miguel Cisneros Herreros Director del PIRASOA: «Programa integral de prevención y control de las infecciones relacionadas con la asistencia sanitaria y uso apropiado de los antimicrobianos» (5 %).
Dos Doctores investigadores (20 %): Validación requisitos y efectividad clínica.
Facultativo servicio de microbiología y enfermedades infecciosas/ Microbiólogo (5 %): Validación clínica.
Investigador Senior (100 %): Jefe proyecto.
Investigador Técnico (2) (100 %): Operaciones.
Línea 2: Nuevo sistema diagnóstico para biopsia líquida (biopsia líquida).
Dr. José Antonio Lorente, PhD Director Científico de GENyO 5 %.
María J. Serrano, PhD (GENyO). Investigadora 10 %.
Dr. José Luis García-Puche, Dr. José Expósito Hernández 5%, oncólogos del HUC San Cecilio y HU Virgen de las Nieves.
Juan J. Díaz-Mochón, PhD Investigador 10 %.
Rosario Sánchez investigador 5 %.
Investigador Senior 100 %.
Investigador Técnico (2) 100 %.
4.2 Empleo CPI.
4.2.1 Línea 1. Análisis de la susceptibilidad y resistencia microbiana a antibióticos (ASURANT).
Esta necesidad se va a cubrir exclusivamente por mecanismos de CPP. En su ejecución ASURAN prevé una fase previa de consulta a los usuarios internos cualificados de la solución seguida de una fase de consulta al mercado, de las que se deriva la elaboración de los pliegos y las fases posteriores de licitación, adjudicación, ejecución y evaluación.
4.2.2 Línea 2. Nuevo sistema diagnóstico para biopsia líquida (Biopsia Líquida).
Esta necesidad se va a cubrir exclusivamente por mecanismos de CPP. En su ejecución Biopsia Líquida, prevé una fase previa de consulta a los usuarios internos cualificados de la solución seguida de una fase de consulta al mercado, de las que se deriva la elaboración de los pliegos y las fases posteriores de licitación, adjudicación, ejecución y evaluación.












Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid