En cumplimiento de lo dispuesto en los Estatutos de esta Universidad, aprobados por Decreto 231/2011, de 12 de julio, del Consejo de Gobierno de la Junta de Andalucía y publicados en el «Boletín Oficial de la Junta de Andalucía» número 147, de 28 de julio de 2011, en la Resolución de 11 de diciembre de 2017, de la Universidad de Granada, por la que se publica Oferta Extraordinaria de Empleo Público del personal de Administración y Servicios de la Universidad de Granada para el año 2017 (BOJA número 238, de 14 de diciembre de 2017), en la Resolución de 4 de octubre de 2018, de la Universidad de Granada, por la que se publica Oferta de Empleo Público para la estabilización del Personal de Administración y Servicios (BOJA número 196, de 9 de octubre de 2018), en la Resolución de 20 de octubre de 2020, de la Universidad de Granada, por la que se establecen las correspondientes equivalencias entre categorías de personal laboral y escalas de personal funcionario correspondientes a las Ofertas de Empleo Público, de los años 2017 y 2018 (BOJA número 207, de 26 de octubre de 2020), al amparo de lo dispuesto en el artículo 19.1.9 de la Ley 6/2018, de 3 de julio, de Presupuestos Generales del Estado para el año 2018 por el que se autoriza a las universidades públicas una tasa adicional para la estabilización de empleo temporal y el apartado 4.4 del Plan de Ordenación de Recursos Humanos del Personal de Administración y Servicios de la Universidad de Granada para 2019 (BOJA número 16, de 24 de enero de 2018), que autoriza la aplicación de las medidas de discriminación positivas previstas en el apartado 3 de la Disposición transitoria cuarta del Real Decreto Legislativo 5/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley del Estatuto Básico del Empleado Público, y con el fin de atender las necesidades de personal de Administración y Servicios.
Este Rectorado, en uso de las competencias atribuidas en el artículo 20 de la Ley Orgánica 6/2001, de 21 de diciembre, de Universidades, modificada por la Ley Orgánica 4/2007, de 12 de abril, en relación con el artículo 2.2.e), de la misma norma, así como en el artículo 45 de los Estatutos de esta Universidad, ha resuelto convocar proceso selectivo de acceso libre para el ingreso en la Escala Técnica de Apoyo a la Docencia y a la Investigación de esta Universidad, en el marco de la consolidación y estabilización de empleo temporal, con sujeción a las siguientes:
Bases de la convocatoria
1 Descripción de las plazas
1.1 Se convoca proceso selectivo de acceso libre para cubrir un total de 16 plazas de personal funcionario de la Escala Técnica de Apoyo a la Docencia y a la Investigación de la Universidad de Granada (grupo A, subgrupo A1), en el marco de los procesos de consolidación y estabilización de empleo temporal.
1.2 La distribución por puestos y perfiles de las 16 plazas convocadas es la siguiente:
|
Denominación puesto |
Perfil específico |
Número plazas |
|---|---|---|
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Análisis de Alimentos. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Análisis del Comportamiento Animal. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Bioanálisis. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Citometría de Flujo. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Espectrometría de Masas. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Espectroscopía Fotoelectrónica de Rayos X. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Experimentación Animal y Animales Gnotobióticos-1. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Experimentación Animal y Animales Gnotobióticos-2. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Información Genética. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Laboratorio de Isótopos Estables y Microscopía Electrónica de Barrido Ambiental. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Microscopía de Fluorescencia y Confocal y Microscopía Confocal Multifotón. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Microscopía Electrónica de Barrido. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Microscopía Electrónica. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Perforación y Testificación de Rocas y Drones. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Radiobioquímica e Inmunoanálisis. |
1 |
|
Titulado/a Superior Apoyo a la Docencia e Investigación. |
Radiología Experimental. |
1 |
2 Normas generales
2.1 Al presente proceso selectivo le serán aplicables el Real Decreto Legislativo 5/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley del Estatuto Básico del Empleado Público; la Ley 6/1985, de 28 de noviembre, de Ordenación de la Función Pública Andaluza; la Ley Orgánica 3/2007, de 22 de marzo, para la igualdad efectiva de mujeres y hombres; la Ley 12/2007, de 26 de noviembre, para la promoción de la igualdad de género en Andalucía; la Ley 17/1993, de 23 de diciembre, sobre acceso a determinados sectores de la función pública de los nacionales de los demás Estados miembros de la Unión Europea; el Decreto 299/2002, de 10 de diciembre, por el que se regula el acceso al empleo público de la administración de la Junta de Andalucía de los nacionales de los demás Estados miembros de la Unión Europea; Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas; Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público; los Estatutos de la Universidad de Granada y lo dispuesto en la presente convocatoria.
2.2 El procedimiento de selección será el de concurso-oposición.
2.3 La fase de oposición se desarrollará con los ejercicios y puntuaciones establecidos en el anexo III de esta convocatoria. Los programas correspondientes que han de regir en la fase de oposición para cada una de las plazas son los que figuran en el anexo I de esta convocatoria dentro del «Bloque Específico», siendo el primer apartado de este anexo, titulado «Bloque General. Normativa», común a todas ellas.
2.4 La fase de concurso se desarrollará conforme a lo dispuesto en el anexo III de la presente convocatoria, con aplicación del baremo contenido en el mismo.
2.5 El primer ejercicio de la fase de oposición se fijará en la resolución por la que se declaren aprobadas las listas definitivas de admitidos y excluidos y estará condicionada a la evolución de la situación generada por la pandemia Covid-19.
3 Requisitos de las personas aspirantes
3.1 Las personas aspirantes, para ser admitidas en el proceso selectivo, deberán reunir los requisitos generales de acceso a la función pública, y en particular:
a) Poseer la nacionalidad española o de alguno de los Estados miembros de la Unión Europea, o nacionales de aquellos Estados a los que, en virtud de los Tratados Internacionales, celebrados por la Unión Europea y ratificados por España, sea de aplicación la libre circulación de los trabajadores y las trabajadoras en los términos en que esta se halle definida en el Tratado Constitutivo de la Comunidad Europea.
Lo establecido en el párrafo anterior será asimismo de aplicación al cónyuge de los españoles y de los nacionales de otros estados miembros de la Unión Europea, siempre que no estén separados de derecho, así como a sus descendientes y a los de su cónyuge, siempre que no estén separados de derecho, menores de 21 años o mayores de dicha edad que vivan a sus expensas. Igualmente se extenderá a las personas incluidas en el ámbito de aplicación de los tratados internacionales celebrados por la Unión Europea y ratificados por España, en los que sea de aplicación la libre circulación de trabajadores.
b) Tener cumplidos los dieciséis años y no exceder, en su caso, de la edad máxima de jubilación forzosa.
c) Poseer la capacidad funcional para el desempeño de las tareas habituales del cuerpo y escala a que se aspira.
d) No haber sido separado mediante expediente disciplinario del servicio de cualquiera de las Administraciones Públicas o de los órganos constitucionales o estatutarios de las Comunidades Autónomas, ni hallarse en inhabilitación absoluta o especial para empleos o cargos públicos por resolución judicial, para el acceso al cuerpo o escala de funcionario, o para ejercer funciones similares a las que desempeñaban en el caso del personal laboral, en el que hubiese sido separado o inhabilitado. En el caso de ser nacional de otro Estado, no hallarse inhabilitado o en situación equivalente ni haber sido sometido a sanción disciplinaria o equivalente que impida, en su Estado, en los mismos términos el acceso al empleo público.
e) Estar en posesión del título de Grado, Licenciado, Ingeniero, Arquitecto o equivalente de conformidad con la normativa de aplicación, o de la justificación acreditativa de haberlo solicitado y abonado los correspondientes derechos para su obtención.
f) Cumplir los requisitos específicos para cada una de las plazas que se reflejan en el anexo II.
Las personas aspirantes con titulaciones obtenidas en el extranjero deberán acreditar que están en posesión de la correspondiente convalidación o de la credencial de homologación a título habilitante español, o certificado de su equivalencia a titulación y a nivel académico universitario oficial. Este requisito no será de aplicación a quienes hayan obtenido el reconocimiento de su cualificación profesional en el ámbito de las profesiones reguladas al amparo de las disposiciones del Derecho de la Unión Europea.
3.2 Estos requisitos estarán referidos a la fecha de finalización del plazo de presentación de solicitudes y deberán mantenerse hasta el momento de la toma de posesión como personal funcionario de la Universidad de Granada.
3.3 Para la admisión al proceso selectivo bastará con que quienes soliciten su participación declaren en su solicitud que reúnen todos y cada uno de los requisitos exigidos, que se acreditarán en el momento y con la documentación relacionada en la base 9.1, y la constancia de haber abonado la correspondiente tasa conforme a lo establecido en el la base 4.4 de esta convocatoria.
4 Solicitudes, tasa y plazo de presentación
4.1 Quienes deseen participar en este proceso selectivo deberán presentar una única solicitud cumplimentada electrónicamente. Para ello, deberán inscribirse mediante el procedimiento «Procesos selectivos de PAS: Solicitud de admisión», disponible en la sede electrónica de la Universidad de Granada (https://sede.ugr.es). En la ficha del citado procedimiento se indican las instrucciones a seguir para cumplimentar la solicitud electrónica de admisión a procesos selectivos. Cada aspirante podrá participar en el proceso selectivo de una o de varias plazas de las convocadas.
4.2 Junto con la solicitud de admisión a la que se refiere el apartado anterior deberá adjuntarse el modelo del Anexo IV cumplimentado, en el que se indicará la plaza o plazas por las que se desea participar, seleccionando la casilla o las casillas correspondientes al puesto y perfil al que se aspira. No seleccionar en dicho modelo la plaza o plazas por las que se desea participar supondrá la exclusión del aspirante del proceso selectivo. Dicho modelo también estará disponible para su descarga en formato electrónico en la web del Servicio de Personal de Administración y Servicios (http://serviciopas.ugr.es/).
4.3 La presentación de solicitudes se hará en el plazo de los veinte días naturales siguientes a la publicación de esta convocatoria en el «Boletín Oficial del Estado».
4.4 Las personas aspirantes con discapacidad con grado reconocido igual o superior al 33 por 100 que deseen participar en el proceso selectivo, deberán indicarlo en el recuadro correspondiente de la solicitud expresando, en su caso, las posibles adaptaciones de tiempo y medios para la realización de los ejercicios en el que esta adaptación sea necesaria a fin de asegurar su participación en el proceso en condiciones de igualdad, utilizando para ello el apartado correspondiente de la solicitud. A tal fin, deberán aportar dictamen técnico facultativo acerca de la procedencia de la adaptación solicitada, emitido por el órgano técnico de valoración que determinó el grado de discapacidad, en el que conste expresamente la adaptación que corresponde al interesado en cada uno de los ejercicios según sus circunstancias personales. El Tribunal estudiará la propuesta del informe técnico y decidirá sobre su concesión, conforme a los criterios establecidos en la Orden PRE/1822/2006, de 9 de junio.
4.5 Los derechos de examen serán de 42,50 euros, y se ingresarán en la cuenta ES05 2038 3505 3664 0001 2738 de cualquier oficina de Bankia, abierta a nombre de «Pruebas Selectivas de Acceso a la Universidad de Granada», bien directamente o mediante transferencia bancaria a dicha cuenta. La solicitud deberá ir acompañada del resguardo acreditativo de la transferencia. La falta de justificación del abono de los derechos de examen o de encontrarse exento del mismo determinará la exclusión de la persona aspirante.
En ningún caso, la mera presentación de la acreditación del pago de los derechos de examen supondrá la sustitución del trámite de presentación, en tiempo y forma, de la solicitud de participación de acuerdo con lo dispuesto en la convocatoria.
4.6 Exenciones y bonificaciones de los derechos de examen.
Estarán exentos del pago de los derechos de examen:
a) De conformidad con lo establecido en el artículo 17 de la Ley 50/1998, de 30 de diciembre, de Medidas Fiscales, Administrativas y de Orden Social, por el que se modifica el apartado cinco del artículo 18 de la Ley 66/1997, de 30 de diciembre, de Medidas Fiscales, Administrativas y de Orden Social:
1) Las personas con discapacidad igual o superior al 33 por 100.
2) Las personas que figuren como demandantes de empleo durante el plazo, al menos, de un mes anterior a la fecha de publicación en el «Boletín Oficial del Estado» de la presente convocatoria. Serán requisitos para el disfrute de la exención que, en el plazo de que se trate, no hubieran rechazado oferta de empleo adecuado ni se hubiesen negado a participar, salvo causa justificada, en acciones de promoción, formación o reconversión profesional y que, asimismo, carezcan de rentas superiores en cómputo mensual al Salario Mínimo Interprofesional.
El informe negativo de rechazos se solicitará en las oficinas de los servicios públicos de empleo. La acreditación de las rentas, se realizará mediante certificado de la declaración presentada del Impuesto sobre la Renta de las Personas Físicas correspondiente al último ejercicio o, en su caso, del certificado del nivel de renta, que deberá aportar el interesado, que podrá solicitar a través de la Sede Electrónica de la Agencia Tributaria en el enlace:
https://www.agenciatributaria.gob.es/AEAT.sede/Inicio/Procedimientos_y_Servicios/Certificaciones/Declaraciones_Tributarias/Declaraciones_Tributarias.shtml
Ambos documentos deberán acompañarse a la solicitud.
b) Las víctimas del terrorismo, entendiendo por tales las personas que hayan sufrido daños físicos o psíquicos como consecuencia de la actividad terrorista, su cónyuge o persona que haya convivido con análoga relación de afectividad, el cónyuge del fallecido y los hijos de los heridos y fallecidos, de acuerdo con la disposición final quinta de la Ley Orgánica 9/2015, de 28 de julio, que añade un nuevo párrafo al apartado cinco del artículo 18 de la Ley 66/1997, de 30 de diciembre.
c) Las familias numerosas en los términos del artículo 12.1.c) de la Ley 40/2003, de 18 de noviembre, de protección de la familia numerosa. Tendrán derecho a una exención del 100 por 100 de las tasas y precios públicos los miembros de familias de la categoría especial y a una bonificación del 50 por 100 los que fueran de la categoría general.
4.7 De conformidad con lo establecido en el artículo 12 de la Ley 8/1989, de 13 de abril, de Tasas y Precios Públicos, procederá, previa solicitud de la persona interesada, la devolución de las tasas que se hubieran exigido, cuando no se realice su hecho imponible por causas no imputables al sujeto pasivo. Por tanto, no procederá devolución alguna de los derechos de examen en los supuestos de exclusión del proceso selectivo por causa imputable a la persona aspirante, por lo que en el supuesto de exclusión por no cumplir los requisitos o no aportar los documentos exigidos en la convocatoria, no dará lugar a la devolución de los derechos de examen. La devolución se efectuará una vez finalizado el proceso selectivo.
4.8 Verificación y acreditación de documentación.–La Universidad de Granada accederá a la Plataforma de Intermediación de Datos de las Administraciones Públicas, con garantía de confidencialidad y con la única finalidad de verificación y consulta de los datos de identidad (base 3.1), titulación (base 3.1) y en su caso para la acreditación de: condición de discapacidad (base 4.6.a.1), beneficiario de víctima del terrorismo (base 4.6.b) y familia numerosa (base 4.6.c).
En el caso de manifestar oposición motivada a la consulta de alguno de los datos indicados en el párrafo anterior se deberá aportar la documentación acreditativa. Igualmente, en caso de que no sea posible obtener o verificar los datos a través de la Plataforma de Intermediación de Datos, la Universidad de Granada podrá, en cualquier momento, solicitar que se aporte la documentación requerida.
La persona aspirante que no posea DNI, deberá aportar junto con su solicitud copia de su documento de identificación o pasaporte.
4.9 Las personas aspirantes quedan vinculadas a los datos que hayan hecho constar en sus solicitudes, pudiendo solicitar su modificación mediante escrito motivado, dentro del plazo establecido para la presentación de solicitudes. Transcurrido dicho plazo, no se admitirá ninguna petición de esta naturaleza.
4.10 Los errores de hecho que pudieran advertirse podrán subsanarse en cualquier momento, de oficio o a petición de la persona interesada.
5 Admisión de aspirantes
5.1 Expirado el plazo de presentación de solicitudes, la Rectora de la Universidad de Granada dictará resolución declarando aprobadas las listas provisionales de personas admitidas y excluidas. En dicha resolución, que deberá publicarse en el «Boletín Oficial de la Junta de Andalucía», se indicarán los lugares en que se encuentran expuestas al público las listas certificadas completas de personas admitidas y excluidas indicándose, en este último caso, las causas de exclusión.
5.2 Las personas que figuren excluidas u omitidas dispondrán de un plazo de diez días hábiles, contados a partir del siguiente al de la publicación de la resolución en el «Boletín Oficial de la Junta de Andalucía», para que reclamen y presenten la documentación que a su derecho convenga. En todo caso, al objeto de evitar errores y, en el supuesto de producirse, posibilitar su subsanación en tiempo y forma, las personas aspirantes comprobarán fehacientemente no solo que no figuran recogidas en la relación de exclusiones, sino, además, que sus datos identificativos constan en la pertinente relación de personas admitidas. Las personas que dentro del plazo señalado no subsanen la exclusión o aleguen la omisión quedarán definitivamente excluidas de la participación en el proceso selectivo.
5.3 Concluido el plazo de subsanación, por resolución de la Rectora de la Universidad de Granada se declararán aprobadas las listas definitivas de personas admitidas y excluidas y en ellas se decidirá acerca de las alegaciones planteadas por las personas interesadas sobre la exclusión u omisión en las listas provisionales, y su publicación les servirá de notificación. Esta resolución se publicará en el «Boletín Oficial de la Junta de Andalucía», y en ella se señalarán el lugar, fecha y hora de realización del primer ejercicio de la oposición, y el lugar donde se expondrán al público las listas definitivas.
5.4 La resolución por la que se declara aprobada la lista definitiva de personas admitidas y excluidas agotará la vía administrativa. Contra la citada resolución cabrá interponer recurso potestativo de reposición ante la Rectora de la Universidad de Granada, en el plazo de un mes, contado desde el día siguiente al de su publicación, o interponer directamente recurso contencioso-administrativo en el plazo de dos meses, contados desde el día siguiente a su publicación, ante la Sala correspondiente de lo Contencioso-Administrativo del Tribunal Superior de Justicia de Andalucía, de conformidad con lo dispuesto en los artículos 123 y 124 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas, y el artículo 46 de la Ley 29/1998, de 13 de julio, reguladora de la Jurisdicción Contencioso-Administrativa. En el caso de interponer recurso de reposición, no se podrá interponer recurso contencioso-administrativo hasta que aquel sea resuelto expresamente o se haya producido su desestimación presunta.
6 Tribunales
6.1 Los Tribunales calificadores de este proceso, conforme a lo dispuesto en el artículo 60 del Real Decreto Legislativo 5/2015, de 30 de octubre, por el que se aprueba el Texto refundido de la Ley del Estatuto Básico del Empleado Público y el artículo 162.3 de los Estatutos de la Universidad de Granada, estarán compuestos por cinco miembros y sus respectivos suplentes respetando el principio de presencia equilibrada de mujeres y hombres. Serán nombrados por la Rectora, y se publicarán junto con la resolución que declare aprobadas las listas definitivas de personas admitidas y excluidas a la que se refiere la base 5.3 de la presente convocatoria.
6.2 Los miembros de los Tribunales deberán abstenerse de intervenir, notificándolo a la Rectora de la Universidad de Granada, cuando concurran en ellos alguna de las causas previstas en el artículo 23 de la Ley 40/2015, de 1 de octubre, del Régimen Jurídico del Sector Público, o hubiesen realizado tareas de preparación de aspirantes a pruebas selectivas en los cinco años anteriores a la publicación de la convocatoria.
El Presidente o Presidenta de cada uno de los Tribunales podrá solicitar de los miembros del Tribunal declaración expresa de no hallarse incursos en las circunstancias previstas en el párrafo anterior. Asimismo, las personas aspirantes podrán recusar a los miembros del Tribunal, a tenor del artículo 24 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
6.3 Con anterioridad a la iniciación del proceso selectivo, si se hubiese producido y prosperado un incidente de abstención o recusación, la autoridad convocante publicará en el «Boletín Oficial de la Junta de Andalucía», resolución por la que se nombra a las nuevas personas que integran el Tribunal afectado y que habrán de sustituir a las que hayan perdido su condición por alguna de las causas previstas en la base anterior. No obstante, si dicha abstención o recusación se plantease después de pasados quince días desde la publicación del Tribunal a la que se hace referencia en la base 6.1 de esta convocatoria, la composición de las nuevas personas que integren el Tribunal se realizará en el sitio web del Servicio de Personal de Administración y Servicios de la Universidad de Granada http://serviciopas.ugr.es/.
6.4 Previa convocatoria de su Presidente o Presidenta se constituirán los Tribunales con la asistencia de todos sus miembros. Las personas designadas como titulares que no concurran al citado acto cesarán y serán sustituidos por sus respectivos suplentes. Celebrarán su sesión de constitución con una antelación mínima de diez días antes de la celebración del primer ejercicio de la fase de oposición. En dicha sesión, cada Tribunal acordará las decisiones que le correspondan en orden al correcto desarrollo del proceso selectivo.
6.5 A partir de su constitución, los Tribunales, para actuar válidamente a efectos de la celebración de sesiones, deliberaciones y toma de acuerdos, requerirán la asistencia, presencial o a distancia, del Presidente/a y Secretario/a o, en su caso, de quienes les sustituyan, y la de la mitad, al menos, de sus miembros.
6.6 Durante el desarrollo del proceso selectivo, cada Tribunal resolverá todas las dudas que pudieran surgir en la aplicación de estas normas, así como lo que se deba hacer en los casos no previstos. El procedimiento de actuación de los Tribunales se ajustará en todo momento a lo dispuesto en la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
6.7 Los Tribunales podrán disponer la incorporación a sus trabajos de especialistas para el asesoramiento en la preparación o desarrollo de las pruebas correspondientes de los ejercicios que estimen pertinentes, limitándose, dichas personas, a prestar su colaboración en sus especialidades técnicas. La designación de tales asesores o asesoras deberá comunicarse a la Rectora de la Universidad a fin de que sea formulada la oportuna resolución de nombramiento.
6.8 Igualmente, cuando por el número de personas que soliciten participar en el proceso selectivo se considere necesario, y para garantizar el correcto y normal desarrollo de los ejercicios, los tribunales podrán designar personal colaborador.
6.9 Los Tribunales adoptarán las medidas precisas en aquellos casos en que resulten necesario, de forma que las personas con discapacidad gocen de similares condiciones para la realización de los ejercicios que el resto de personas que participan en el proceso. En este sentido se establecerá, para las personas con discapacidad que lo soliciten en la forma prevista en la base 4.4, las adaptaciones posibles en tiempo y medios para su realización.
6.10 El Presidente o Presidenta de cada Tribunal adoptará las medidas oportunas para garantizar que el ejercicio o ejercicios que forman parte de la fase de oposición, sean valorados sin que se conozca la identidad de las personas aspirantes.
6.11 A efectos de comunicaciones y demás incidencias, los Tribunales tendrán su sede en el Servicio de Personal de Administración y Servicios, Edificio Santa Lucía (c/ Santa Lucía, número 8), teléfonos 958 241 000, extensiones 20572 y 20574. Los Tribunales dispondrán que en dicha sede, al menos una persona, que podrá pertenecer o no al Tribunal, atienda cuantas cuestiones sean planteadas en relación con este proceso selectivo.
6.12 Los Tribunales que actúen en este proceso selectivo percibirán las indemnizaciones por razón de servicio establecidas en las Normas de Ejecución del Presupuesto de la Universidad de Granada vigentes.
6.13 Los Tribunales no podrán declarar que han superado el proceso selectivo un número superior de aspirantes al de plazas convocadas. Cualquier propuesta de personas que han superado el proceso que contravenga lo anterior será nula de pleno derecho. No obstante, cuando se produzcan renuncias de los aspirantes seleccionados, antes del nombramiento o toma de posesión, o cuando alguna de las personas seleccionadas carezca de los requisitos señalados en la base 3, el órgano convocante podrá requerir del órgano de selección relación complementaria de los aspirantes que sigan a los propuestos, para su posible nombramiento como funcionarios de carrera, todo ello de conformidad con lo dispuesto en el artículo 61.8 del Texto refundido de la Ley del Estatuto Básico del Empleado Público.
7 Desarrollo del proceso selectivo
7.1 En cualquier momento cada Tribunal podrá requerir a las personas aspirantes para que acrediten su identidad. En el caso de no ostentar la nacionalidad española, para la acreditación de la identidad, se tendrá que utilizar el original del documento aportado según la base 4.1.
7.2 El orden de actuación de las personas aspirantes en el ejercicio o los ejercicios en que se requiera una actuación individualizada, será por orden alfabético, a partir del aspirante cuyo primer apellido comience por la letra «M», según resolución de 3 de febrero de 2020, de la Dirección General de Recursos Humanos y Función Pública (BOJA número 26 de 7 de febrero de 2020). En el supuesto de que no exista ningún aspirante cuyo primer apellido comience por la letra «M», el orden de actuación se iniciará por aquellos cuyo primer apellido comience por la letra «N», y así sucesivamente.
7.3 Las personas aspirantes serán convocadas para la realización de los ejercicios de la fase de oposición en llamamiento único, aunque los mismos hayan de dividirse en varias sesiones, siendo excluidas de la oposición aquellas personas que no comparezcan, salvo en los casos debidamente justificados y libremente apreciados por el Tribunal.
7.4 Una vez comenzado el proceso selectivo, los sucesivos anuncios de la celebración de los restantes ejercicios deberán hacerse públicos por el Tribunal en el sitio web del Servicio de Personal de Administración y Servicios de la Universidad de Granada (http://serviciopas.ugr.es/) y por cualquier otro medio si se juzga conveniente, con veinticuatro horas, al menos, de antelación del comienzo de los mismos.
7.5 En cualquier momento del proceso selectivo, si el Tribunal tuviese conocimiento de que alguna de las personas aspirantes no posee la totalidad de los requisitos exigidos en la presente convocatoria, previa audiencia de la misma, deberá proponer su exclusión a la Rectora de la Universidad de Granada, comunicándole asimismo las inexactitudes o falsedades formuladas en la solicitud de admisión al proceso selectivo, a los efectos procedentes.
Contra la exclusión, se podrá interponer recurso potestativo de reposición ante la Rectora o bien recurso contencioso-administrativo ante el Juzgado de lo Contencioso-Administrativo.
7.6 Desde la total conclusión de un ejercicio o prueba hasta el comienzo del siguiente deberá transcurrir un plazo mínimo de 72 horas.
8 Lista de personas seleccionadas
8.1 Tras la publicación de la relación definitiva de aspirantes que han superado cada uno de los ejercicios de la fase de oposición en la forma prevista en el Anexo III, cada Tribunal hará pública en el sitio web del Servicio de Personal de Administración y Servicios de la Universidad de Granada (http://serviciopas.ugr.es), la relación definitiva de aspirantes que han superado la fase de oposición. Las personas aspirantes que no se hallen incluidas en tal relación tendrán la consideración de no aptas a todos los efectos, siendo excluidas del proceso selectivo.
8.2 La calificación final del proceso selectivo vendrá determinada por la suma de la puntuación obtenida en la fase de oposición y la obtenida en la fase de concurso.
En caso de empate en la calificación final, a efectos de determinar las personas aspirantes que han superado el proceso selectivo, prevalecerá la mayor puntuación individual en el global de la fase de oposición. Si persistiese el empate, se resolverá atendiendo a la mayor puntuación individual obtenida en cada uno de los ejercicios según el siguiente orden de prioridad: primer ejercicio y segundo ejercicio. Si a pesar de esto se mantuviese el empate, este se dirimirá por orden alfabético comenzando por la letra indicada en la base 7.2.
8.3 Finalizado el proceso selectivo, cada Tribunal hará pública la relación definitiva de personas que han superado el mismo por orden de puntuación, en las que constarán las calificaciones de los ejercicios de la fase de oposición y la puntuación obtenida en la fase de concurso, así como la calificación final obtenida. Al efecto de confeccionar dicha relación, el Tribunal declarará que han superado el proceso selectivo las personas aspirantes que hayan obtenido las mayores calificaciones finales, sin que el número de personas supere el número de plazas convocadas, tal como se establece en la base 6.13 de esta resolución.
El Presidente o la Presidenta del Tribunal enviará copia certificada de dicha relación a la Rectora de la Universidad, con propuesta de nombramiento de personal funcionario de carrera.
8.4 Asimismo, al objeto de poder realizar nombramientos de personal funcionario interino, si así lo requieren las necesidades de la Universidad en sus centros y servicios de Granada, Ceuta y Melilla, se podrá crear la correspondiente bolsa para el nombramiento de personal funcionario interino.
9 Presentación de documentos y nombramiento de personal funcionario
9.1 En el plazo de diez días hábiles a contar desde la publicación en el sitio web del Servicio de Personal de Administración y Servicios de la Universidad de Granada (http://serviciopas.ugr.es/) de las relaciones de personas que han superado el proceso selectivo a que se refiere la base anterior, quienes figuren en las mismas, deberán presentar en dicho Servicio, los siguientes documentos:
a) Certificado médico acreditativo de no poseer enfermedad ni defecto físico que imposibiliten para el servicio, expedido por el Servicio de Salud y Prevención de Riesgos Laborales de la Universidad de Granada.
b) Original y fotocopia para su compulsa de la titulación académica exigida en la base 3.1.e de la convocatoria, solo en el caso que manifieste oposición motivada a la consulta que de esos datos realizará la Universidad de Granada.
c) Declaración jurada o promesa de no haber sido separado, mediante expediente disciplinario, de ninguna Administración Pública ni hallarse inhabilitado para el ejercicio de funciones públicas, según modelo que facilitará a los interesados el Servicio de Personal de Administración y Servicios de la Universidad de Granada.
d) Las personas seleccionadas que hayan hecho valer su condición de persona con discapacidad deberán presentar de los órganos competentes del Ministerio de Trabajo y Asuntos Sociales o de la Comunidad Autónoma correspondiente:
1) Certificación que acredite tal condición solo en el caso que manifieste oposición motivada a la consulta que de esos datos realizará la Universidad de Granada.
2) Certificación acreditativa de la compatibilidad con el desempeño de tareas y funciones correspondientes.
9.2 Ante la imposibilidad, debidamente justificada, de presentar los documentos expresados en el apartado anterior, podrá acreditarse que se reúnen las condiciones exigidas en la convocatoria mediante cualquier medio de prueba admisible en derecho.
9.3 Las personas que tuvieran la condición de funcionarios de carrera estarán exentos de justificar documentalmente las condiciones y demás requisitos ya probados para obtener su anterior nombramiento, debiendo presentar certificación para acreditar su condición, así como fotocopia compulsada de la titulación exigida, y aquellas circunstancias que obren en su hoja de servicios.
9.4 Quienes dentro del plazo fijado, y salvo los casos de fuerza mayor, no presentaran la documentación o, del examen de la misma se dedujera que carecen de alguno de los requisitos señalados en la base 3, no podrán ser nombrados funcionarios de carrera y quedarán anuladas las actuaciones, sin perjuicio de la responsabilidad en que hubieran incurrido por falsedad en la solicitud inicial.
9.5 Por la autoridad convocante, vista la propuesta del Tribunal calificador, se procederá al nombramiento de personal funcionario de carrera, mediante resolución que se publicará en el «Boletín Oficial de la Junta de Andalucía».
9.6 La toma de posesión de las personas seleccionadas se efectuará en el plazo máximo de un mes, contado desde el día siguiente a la fecha de publicación de su nombramiento en el «Boletín Oficial de la Junta de Andalucía».
10 Norma final
10.1 Las personas aspirantes, por el hecho de participar en el presente proceso selectivo, se someten a las bases de esta convocatoria y su desarrollo y a las decisiones que adopte el Tribunal, sin perjuicio de las reclamaciones pertinentes. El Tribunal se halla facultado para resolver las dudas que se presenten en todo lo no previsto en las bases, así como para la adopción de los acuerdos necesarios para el buen orden del proceso selectivo.
10.2 Contra la presente resolución, que agota la vía administrativa en virtud del artículo 84 del Decreto 231/2011, de 12 de julio, del Consejo de Gobierno de la Junta de Andalucía por el que se aprueban los Estatutos de la Universidad de Granada, podrá interponerse potestativamente recurso de reposición en el plazo de un mes, a contar desde el día siguiente a aquel en que tenga lugar su publicación en el «Boletín Oficial del Estado», ante el mismo órgano que lo ha dictado, de conformidad con lo dispuesto en los artículos 123 y 124 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas o interponer directamente Recurso Contencioso-Administrativo ante el Juzgado de lo Contencioso-Administrativo de Granada, en el plazo de dos meses a partir de la publicación de esta resolución, de conformidad con lo dispuesto en los artículos 8.3 y 46 de la Ley 29/1998, de 13 de julio, reguladora de la jurisdicción contencioso administrativa.
10.3 Las personas que tengan la consideración de interesadas en el procedimiento podrán interponer recurso de alzada contra los actos del Tribunal calificador ante la Rectora de la Universidad, en los términos previstos en los artículos 121 y concordantes Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
10.4 Asimismo, la Rectora de la Universidad de Granada podrá, en su caso, proceder a la revisión de los Acuerdos del Tribunal, conforme a lo previsto en la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas y el artículo 85 de los Estatutos de la Universidad de Granada.
Granada, 9 de noviembre de 2020.–La Rectora, Pilar Aranda Ramírez.
Bloque general
Normativa
1. La Constitución Española de 1978.
2. Ley Orgánica 6/2001, de 21 de diciembre, de Universidades.
3. Real Decreto Legislativo 5/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley del Estatuto Básico del Empleado Público.
4. Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
5. Ley 40/2015, de 1 de octubre de Régimen Jurídico del Sector Público: Título Preliminar: Disposiciones generales, principios de actuación y funcionamiento del sector público. Título III: Relaciones interadministrativas.
6. Ley 14/2011, de 1 de junio, de la Ciencia, la Tecnología y la Innovación.
7. Decreto 231/2011, de 12 de julio, por el que se aprueban los Estatutos de la Universidad de Granada.
8. Ley 31/1995, de 8 de noviembre, de prevención de Riesgos Laborales.
9. Prevención de riesgos laborales en la UGR: Plan de Prevención de Riesgos Laborales. Manual del Sistema de Gestión de Seguridad y Salud Laboral (aprobado en la sesión del Consejo de Gobierno de 31 de enero de 2017).
10. Ley Orgánica 3/2007, de 22 de marzo, para la igualdad efectiva de mujeres y hombres: Título Preliminar: Objeto y ámbito de la Ley. Título I: El principio de igualdad y la tutela contra la discriminación. Título II: Políticas públicas para la igualdad. Título IV: El derecho al trabajo en igualdad de oportunidades. Título V: Capítulo 1 Criterios de actuación de las Administraciones públicas. Protocolo de la Universidad de Granada para la prevención y respuesta ante el acoso (aprobado en la sesión ordinaria del Consejo de Gobierno de 26 de octubre de 2016).
Bloque específico
«Análisis de Alimentos»
1. Aspectos teóricos de química analítica. Definición, Objetivos y Clasificación de métodos. Herramientas para el laboratorio de QA. Reactivos, grados de pureza. Inventario de reactivos sistema ChemInventor y compartido en la Universidad de Granada; Instrumentación; Equipamiento.
2. Enfoque analítico. Esquema de un análisis completo, definición de objetivos y estrategia de análisis. Errores en el análisis; descripción y tipos. Métodos analíticos generales de cuantificación. Clasificación según principio de cuantificación.
3. Métodos de cuantificación volumétricos. Fundamentos, clasificación e instrumentación. Agentes valorantes, indicadores, ensayos en blanco y errores en la valoración. Métodos de cuantificación gravimétricos. Fundamentos, clasificación e instrumentación. Cálculos y aplicaciones en el análisis de alimentos.
4. Métodos instrumentales en el análisis de alimentos. Cromatografía: fundamento y clasificación. Cromatografía de gases. Aspectos fundamentales, instrumentación y aplicación en AAL. PCR a tiempo real: fundamento y aplicación en AAL.
5. Observaciones generales en el laboratorio de qa: seguridad en el laboratorio. Instalaciones, elementos de seguridad, almacenamiento de productos, fichas de seguridad y eliminación de residuos.
6. Sistemas de evaluación de calidad en los procesos de laboratorio. Documentación, registros y procedimientos de trabajo. Seguridad en el almacenamiento de datos y copias de respaldo. Mantenimiento de equipos de laboratorio. Planificación, calibración y verificación. Mantenimiento preventivo y correctivo. Sistemática de verificación. Control de documentación: Auditorías.
7. Prestación del servicio de análisis en el centro de instrumentación científica. Atención de usuarios. Modalidades de prestación de servicios: Autoservicio, gestión de reservas y autorizaciones. Solicitud, trámite y gestión de pedidos. Elaboración de presupuestos. Gestión de órdenes de trabajo.
8. Análisis alimentario: terminología y tipos de análisis alimentario; importancia, objetivos y campos de aplicación. Integración de los análisis en la investigación científica, estructuración multidisciplinar, evaluación nutricional y toxicológica, planes de intervención nutricional.
9. Calidad alimentaria. Concepto, atributos de calidad. La Política de calidad del Sistema Agroalimentario Español; Normas de calidad europeas y españolas; Programas de Certificación, calidad diferenciada, Sellos de calidad. Métodos oficiales de análisis: AOAC y métodos de análisis en España. Control Oficial de los Alimentos, laboratorios de control oficial, Plan nacional de control oficial de la cadena alimentaria.
10. Control de calidad: definición y evaluación de requisitos de calidad. Indicadores de calidad. Fraudes alimentarios y alteraciones en alimentos: definición, y clasificación. Utilización de técnica de PCR a tiempo real para detección de adulteraciones, fraudes alimentarios y organismos modificados genéticamente.
11. Etiquetado de alimentos: información nutricional en el Etiquetado; Normativa vigente, obligatoriedad, exenciones y aplicación del etiquetado nutricional. Alegaciones publicitarias referentes al etiquetado nutricional: Valor Nutritivo y Declaración de Propiedades Saludables.
12. Caracterización de los alimentos en base a su composición nutricional: obtención y evaluación de datos de composición para su incorporación en bases de datos y tablas de composición. Métodos de compilación, tipos y fuentes de datos. Programas nacionales, regionales e internacionales. Limitaciones. Comisiones competentes en la compilación de datos obtenidos FAO, EUROFOODS, BEDCA.
13. Bases de datos de composición de alimentos II: tipos de bases de datos: bases concisas, bases exhaustivas y bases de referencia; selección de componentes a analizar según aporte de nutrientes, necesidad básica de información: análisis proximal.
14. Bases de datos de composición de alimentos iii. Elección de métodos de análisis de nutrientes y su evaluación: validación del método analítico. Muestreo: definición, importancia y principio general de los procedimientos de toma de muestra; criterios de muestreo para Bases de datos de Alimentos, fuentes de alimentos, utilidad y limitaciones. Operaciones de Muestreo según tipo de producto y objetivos analíticos, error de muestreo y exactitud del proceso.
15. Preparación de la muestra: métodos de preparación de alimentos para análisis general y métodos desarrollados para bases de datos.
16. Conservación y preservación de muestras para el análisis de nutrientes. El proceso de liofilización.
17. Análisis de humedad: determinación de Agua, Extracto Seco y Sólidos totales por gravimetría. Métodos de desecación según matriz.
18. Mineralización e incineración de muestras en horno Mufla para determinación de cenizas por gravimetría.
19. Análisis de nitrógeno total y proteínas. Preparación de muestra y digestión ácida.
20. Análisis de nitrógeno total y proteínas II: destilación y valoración volumétrica para determinación de Nitrógeno total y proteínas por el método de Kjeldhal. Limitaciones y cálculo. Factores de conversión.
21. Análisis de materia grasa total. Preparación de muestra e hidrólisis.
22. Análisis de materia grasa total II. Extracción de grasas por el método Soxhlet para determinación de materia grasa por gravimetría.
23. Determinación de fibra dietética total, fibra soluble y fibra insoluble por el método enzimático-gravimétrico.
24. Cálculo del contenido en hidratos de carbono por diferencia (método aproximado de Weende) y cálculo del valor energético de alimentos según normativa comunitaria.
25. El sistema proximal de análisis: formas de garantizar la calidad de los datos analíticos en la compilación para Bases de Datos. Formas de expresión de resultados en el análisis proximal.
26. Análisis de perfil lipídico. Preparación de la muestra. Esterificación y metilación de ácidos grasos.
27. Análisis de perfil lipídico II. Identificación, cuantificación y cálculo de índices de ácidos grasos por cromatografía gaseosa.
«Análisis del Comportamiento Animal»
1. Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia.
2. Orden ECC/566/2015, de 20 de marzo, por la que se establecen los requisitos de capacitación que debe cumplir el personal que maneje animales utilizados, criados o suministrados con fines de experimentación y otros fines científicos, incluyendo la docencia.
3. Las 3Rs. Ética y bienestar animal. Comités de ética y órganos habilitados para la evaluación de los proyectos de investigación.
4. Métodos alternativos a la investigación con animales.
5. Biología fundamental de rata y ratón de laboratorio. Características fisiológicas. Conductas sociales. Reconocimiento de conductas anormales.
6. Estabulación de la rata y ratón de laboratorio: Condiciones del entorno animal. Instalaciones y alojamiento. Variables ambientales.
7. Nomenclatura estandarizada de los distintos tipos de cepas de ratones de laboratorio. Nomenclatura estandarizada de ratones modificados genéticamente.
8. Procedimiento para la evaluación del bienestar animal. Indicadores de bienestar y puntos de intervención. Implementación de protocolos para la evaluación del bienestar de los animales de laboratorios. Reconocimiento de la angustia, dolor y sufrimiento en rata y ratón de laboratorio.
9. Métodos para la evaluación de las conductas fisiológicas y el bienestar animal en la rata y el ratón de laboratorio: borrowing, nesting, ruedas de actividad locomotora (spontaneous activity wheels). Protocolos de los modelos. Valoración e interpretación de las conductas indicadores de alguna alteración.
10. Evaluación de la severidad de los procedimientos experimentales. Factores que influyen en el nivel de severidad. Límite máximo de severidad. Clasificación de la severidad de procedimientos experimentales. Evaluación retrospectiva de la severidad asignada.
11. Protocolos de supervisión y criterios de punto final humanitario en la experimentación con rata y ratón de laboratorio.
12. Eutanasia en rata y ratón de laboratorio. Situaciones en las que realizar la eutanasia. Métodos de eutanasia en animales adultos. Métodos de eutanasia para fetos y neonatos. Métodos de eutanasia aceptables en animales inconscientes. Métodos inaceptables de eutanasia.
13. Vías sistémicas de administración de sustancias en la rata y el ratón de laboratorio: oral, intraperitoneal, subcutánea, intravenosa. Manejo e inmovilización del animal. Planificación, preparación y ejecución de la técnica. Problemas potenciales y refinamientos de las técnicas.
14. Vías locales de administración de sustancias: intracerebroventricular, intratecal intradérmica, intraplantar, intranasal, intravaginal y tópica-dérmica. Manejo e inmovilización del animal. Planificación, preparación y ejecución de la técnica. Problemas potenciales y refinamientos de las técnicas.
15. Procedimientos para la obtención de muestras biológicas en la rata y el ratón de laboratorio.
16. Anestesia para procedimientos experimentales en la rata y el ratón de laboratorio. Tipos de anestésicos. Fases de la técnica anestésica. Factores implicados en la elección de la técnica anestésica. Monitorización del animal. Recuperación anestésica.
17. Analgesia en la rata y el ratón de laboratorio. Analgésicos opioides. AINEs.
18. Seguridad farmacológica. Evaluación de la toxicidad farmacológica en rata y ratón. Test de Irwin.
19. Modelos animales de experimentación: Tipos y generalidades. Selección del modelo animal adecuado. Consideraciones generales para la extrapolación del modelo animal al humano.
20. Métodos para la evaluación de la coordinación motora en la rata y el ratón de laboratorio: Rotarod, análisis del modo de andar (Catwalk). Metodología de las técnicas. Análisis de las conductas comportamentales. Aplicaciones experimentales.
21. Procedimiento experimental para la evaluación de aprendizaje y memoria en rata y ratón: Prueba de reconocimiento de objetos, laberinto acuático de Morris. Principios y metodología de los procedimientos.
22. Procedimientos para el estudio de la ansiedad en la rata y el ratón de laboratorio. Modelo de campo abierto (open field), laberinto elevado en cruz. Principios y metodología de los procedimientos.
23. Modelos oncológicos en ratón de laboratorio. Inoculación de células tumorales. Xenoinjertos. Generación de tumores ortotópicos.
24. Modelos de diabetes espontánea e inducida por fármacos en rata y ratón. Mecanismos fisiopatológicos implicados. Valoración de los síntomas y alteraciones comportamentales propias de la enfermedad. Precauciones metodológicas.
25. Modelos de osteoartritis e inflamación en rata y ratón: Modelo de inyección intraarticular de monoiodoacetado sódico. Test de formalina, carragenina y coadyuvante de Freud. Mecanismos fisiopatológicos implicados. Características y preparación de las sustancias químicas empleadas. Metodología de los modelos. Precauciones metodológicas. Valoración de las alteraciones comportamentales generadas por la sustancia inoculada.
26. Modelos de neuropatía inducida por fármacos y cirugía. Modelos de administración de antineoplásicos y otros fármacos neuropáticos. Modelos de ligadura total o parcial del nervio y de sección del nervio. Procedimientos quirúrgicos para el desarrollo de los modelos. Precauciones metodológicas. Mecanismos fisiopatológicos implicados. Valoración de las alteraciones comportamentales.
27. Modelos para el estudio de dolor nociceptivo, hiperalgesia y alodinia en rata y ratón. Modelo de placa caliente (hot-plate), modelo de retirada de la cola (tail-flick), test de la capsaicina, test de la formalina. Modelo de Von Frey, modelo de Randall-Sellito, modelo de Hargreaves, modelo de la acetona Mecanismos fisiológicos implicados. Metodología de los modelos. Precauciones metodológicas.
28. Modelos de dolor visceral en rata y ratón: modelo de las contorsiones inducido por ácido acético, cistitis inducida por ciclofosfamida y modelo de enfermedad inflamatoria intestinal inducida por capsaicina intracolónica. Mecanismos fisiopatológicos implicados. Metodología de los modelos. Valoración de la sintomatología generada por el algógeno.
«Bioanálisis»
1. Contador hematológico: del hemograma manual al recuento automatizado. Ventajas de la automatización en el contaje de células en sangre periférica.
2. Detección óptica de células hematológicas. Principios de detección. Valores absolutos, porcentuales y aspecto morfológico de las tres poblaciones celulares de la sangre periférica: leucocitos, eritrocitos y plaquetas.
3. Contadores de apertura-impedancia. Contadores de dispersión de luz. Calidad analítica en los hemogramas de 22 parámetros.
4. Índices eritrocitarios, leucocitarios y plaquetarios: volumen corpuscular medio, distribución de tamaños y medidas de integración.
5. Fundamento de los métodos de análisis bioquímicos: métodos químicos, físicos, enzimáticos, inmunológicos e hibridación.
6. Determinación cuantitativa in vitro de marcadores bioquímicos clínicos en suero, plasma y orina. Uso de analizadores bioquímicos automatizados.
7. Selección del método de análisis; variabilidad de los datos analíticos, valoración de los mismos y control de calidad de los resultados.
8. Medida de la intensidad luminosa por conversión fotoeléctrica de reacciones enzimáticas a «punto final», «tiempo fijo» y «cinético».
9. Técnicas analíticas inmunoquímicas. La interacción antígeno-anticuerpo; el principio de especificidad de los métodos inmunológicos.
10. Inmunoensayos y análisis de múltiples biomarcadores en muestras biológicas: sobrenadantes de cultivo celular, homogenado de tejido, plasma, suero, orina, etc.
11. Cuantificación mediante fluoroinmunoensayos «multiplex» en citómetro de placa tipo «Luminex».
12. Análisis cuantitativo de proteínas. Western-blot. Protocolos a seguir. Sistemas de detección.
13. Estructura y función del ADN: replicación. Cuantificación de ADN. Southern-blot. Protocolos a seguir. Principios básicos. PCR cualitativa.
14. Estructura y función del ARN. Transcripción y expresión génica. Traducción y procesado del ARN. Análisis de expresión génica mediante Northern-blot. Principios básicos.
15. PCR cuantitativa en tiempo real: concepto, diseño y optimización de experimentos. Instrumentación.
16. Aplicaciones de la técnica de PCR en tiempo real. Cuantificación absoluta. Cuantificación relativa.
17. Imagen molecular: imagen preclínica. Sistemas de detección y sondas específicas para detectar procesos celulares a nivel molecular de forma remota y no invasiva.
18. Imagen óptica no invasiva en la experimentación en células. Bases de los métodos. Sistemas de detección: IVIS Spectrum.
19. Imagen óptica no invasiva en la experimentación in vivo. Fundamentos del método. Sistemas de detección: IVIS Spectrum.
20. Imagen in vivo de fuentes bioluminiscentes y fluorescentes; análisis DLIT y FLIT.
21. Imagen de resonancia magnética nuclear: principios básicos. Ventajas e inconvenientes.
22. Señal de RMN: excitación y relajación nuclear. Propiedades magnéticas de la materia. Secuencias de pulsos básicas en RMN. Secuencias de IRM clásicas.
23. IRM: localización de la señal de RMN. Gradientes de campo, codificación en frecuencia y fase.
24. Reconstrucción de la imagen: Espacio de Fourier.
25. Contraste en IRM. Imágenes ponderadas en densidad protónica. Imágenes ponderadas en T1 y T2. Agentes de contraste en IRM: agentes paramagnéticos y agentes superparamagnéticos.
26. Imagen de RMN potenciada en difusión y perfusión. Imágenes de RMN funcionales. Imagen de RMN de susceptibilidad magnética.
27. Espectroscopía in vivo por RMN.
28. Documentación, registros y procedimientos de trabajo en el laboratorio. Mantenimiento de equipos de laboratorio. Planificación, calibración y verificación. Mantenimiento preventivo y correctivo. Sistemática de verificación. Control de documentación, registros, sistemas de verificación y procedimientos de trabajo.
«Citometría de Flujo»
1. Principios físicos de la Citometría de Flujo. Física de Fluidos. Flujo laminar. Hidrodinámica. Enfoque hidrodinámico acústicamente asistido. Cámara de flujo.
2. Sistemas de iluminación en citometría de flujo. Principios físicos de la luz láser. Polarización de la luz. Enfoque del haz del láser. Tipos de láseres. Otras formas de iluminación (LED).
3. Procesos dispersivos en citometría de flujo. Dispersión Rayleigh y Teoría de Mie. Discriminación en diferentes ángulos.
4. Arquitectura del citómetro de flujo. Sistema óptico. Óptica de colección. Fluorescencia. Discriminación de fluorescencias.
5. Fotodetección en citometría de flujo. Electrónica frontal. Tipos de detectores. Eficiencia cuántica.
6. Electrónica en citometría de flujo. Componentes electrónicos en un citómetro de flujo. Electrónica relacionada con los detectores. Características del pulso. Electrónica de la digitalización. Electrónica relacionada con el análisis de datos y su visualización.
7. Rendimiento de los citómetros de flujo. Optimización del voltaje de los PMTs. Estadísticas del fotón. Control de calidad. Eficiencia cuántica, Ruido de fondo, Parámetro de Separación. Unidades ABD, MEFS.
8. Solapamiento espectral. Manejo del solapamiento espectral. Error de propagación.
9. Análisis de datos. Selección electrónica de poblaciones. Optimización. Análisis y separación de eventos raros. Parámetros estadísticos en citometría de flujo.
10. Aislamiento de partículas. Sistemas de formación de gota, carga de gota y tiempo de espera. Resolución de conflictos durante la separación. Evaluación del proceso de separación. Estadísticas del aislamiento de partículas.
11. Diseño experimental. Controles en citometría de flujo. Calibración del citómetro de flujo analizador y separador.
12. Preparación de muestras para citómetros de flujo analizadores y de separación. Preparación de células eucariotas para citometría de flujo. Preparación de procariotas para citometría de flujo.
13. Detección de quistes de protozoos en aguas. Cryptosporidium y Giardia. Evaluación de parasitismo intracelular por citometría de flujo.
14. Determinación de antígenos de membrana en citometría de flujo. Determinación de antígenos intracelulares por citometría de flujo. Detección de antígenos virales por citometría de flujo. Anticuerpos monoclonales y policlonales en citometría de flujo.
15. Citometría de flujo multiparamétrica. Diseño y optimización de paneles. Problemas potenciales. OMIPs.
16. Citometría de aguas. Preparación de la muestra. Contaje absoluto.
17. Sondas fluorescentes. Fluorocromos de unión covalente y no covalente. Autofluorescencia.
18. Viabilidad celular. Proliferación celular.
19. Sondas de ácidos nucléicos. Detección de ADN y ARN. Detección de ARNm por citometría de flujo: nuevas aproximaciones.
20. Ciclo celular por citometría de flujo. Modelización matemática del ciclo celular y proliferación celular. Estudio de las fases del ciclo celular.
21. Determinación de pH intracelular. Homeostasis de iones. Otras sondas para diferentes componentes de la célula, carbohidratos, lípidos y colesterol.
22. Actividad enzimática por citometría de flujo. Detección celular y mitocondrial de especies reactivas de oxígeno.
23. Determinación por citometría de flujo del potencial de membrana. Citometría de flujo en el estudio de la mitocondria. Medidas en Eucariotas y Procariotas.
24. Proteínas fluorescentes en citometría de flujo. Genes reporteros. Electropermeabilización. Fusión celular.
25. Apoptosis y otras muertes celulares. Estudio por citometría de flujo.
26. Citogenética y Citometría de flujo. Análisis de Cromosomas.
27. Mantenimiento integral. Puesta a punto y funcionamiento de los equipos de citometría de flujo analítica y de separación.
«Espectrometría de Masas»
1. Fundamentos de la espectrometría de masas (I):
– Relación masa/carga.
– Ión molecular.
– Regla del nitrógeno.
2. Fundamentos de la espectrometría de masas (II):
– Masa nominal.
– Resolución y exactitud de masa (baja y alta resolución).
3. Acoplamiento cromatografía líquida (LC)-espectrometría de masas (MS) (I). Fuentes de ionización:
– Electrospray (ESI).
– APCI.
– UniSpray.
4. Acoplamiento cromatografía liquida (LC)-espectrometría de masas (MS) (II). Analizadores:
– Quadrupolo.
– Tiempo de Vuelo.
5. Espectrometría de masas en tándem (I):
– MS/MS.
– Moléculas protonadas, desprotonadas y formación de aductos.
– Desarrollo y optimización de metodologías por LC-MS/MS.
– Mantenimiento y acondicionamiento del equipo LC-MS/MS.
6. Espectrometría de masas en tándem (II). Modos de funcionamiento en LC-MS/MS:
– Modo iones producto.
– Modo iones precursores.
– Modo MRM.
– Modo pérdida constante de fragmentos neutros.
– Modo ganancia constante de fragmentos neutros.
– Modo ScanWave de iones producto.
7. Fragmentación en LC-MS/MS:
– Generación de iones en ESI y APCI.
– Fragmentación de moléculas protonadas y desprotonadas.
– Fragmentación de grupos funcionales.
– Fragmentación de fármacos y contaminantes.
8. Estrategias de identificación en LC-MS/MS:
– Confirmación basada en estrategias SRM Targeted-Screening.
– Confirmación basada en estrategias de masa exacta de alta resolución.
– Identificación de estructuras mediante compuestos relacionados.
– Identificación de compuestos Known Unknowns and Real Unknowns.
9. Proceso y técnicas de cuantificación en LC-MS/MS:
– Método del patrón externo.
– Método del patrón interno.
– Parámetros analíticos generales.
10. Sistema de alta resolución-LCT (I):
– Resolución y medida de masa nominal.
– TDC settings, MCP Setup, Tune.
– Calibración externa e interna para masa exacta en modo positivo y negativo.
11. Sistema de alta resolución-LCT (II):
– Preparación de la muestra e infusión directa.
– Selección y medida de la referencia.
– Cálculo de la composición elemental.
12. Sistema de alta resolución-LCT (III):
– Desarrollo y optimización de metodologías por LCT y LC-LCT.
– Mantenimiento y acondicionamiento de los equipos LCT y LC-LCT.
13. Sistema de alta resolución-LCT (IV). Aplicaciones:
– Determinación de masas nominales de sustancias orgánicas.
– Estudios de estructura molecular.
– Identificación de sustancias orgánicas no volátiles.
14. Introducción al análisis de isótopos estables en compuestos específicos (CSIA):
– Instrumentación para SIA.
– Principios de BSIA y CSIA.
– Desarrollo histórico del acoplamiento GC y LC con la espectrometría de masas de relaciones isotópicas (IRMS).
15. Aspectos fundamentales de los isótopos estables y el fraccionamiento isotópico.
– Isótopos estables.
– Abundancia natural isotópica y sus variaciones.
– La escala δ y sus límites.
16. Instrumentación para el análisis de isotopos estables en compuestos específicos (I).
– Espectrómetro IRMS.
– Sistemas de inyección.
– Periféricos para flujo continuo.
17. Instrumentación para el análisis de isótopos estables en compuestos específicos (II).
– Aspectos cromatográficos específicos para SIA.
– CSIA por GC-IRMS (δ13C, δ15N y δD).
– Desarrollo y optimización de metodologías por GC-IRMS.
– Mantenimiento y acondicionamiento del equipo GC-IRMS.
18. Preparación de muestra para el análisis de isotopos estables en compuestos específicos:
– Conservación.
– Procesado de muestra.
– Derivatización.
19. Estrategias para las medidas de referencia y el control de la calidad en el análisis de isotopos estables en compuestos específicos:
– Materiales de referencia internacionales primaros.
– Materiales de referencia certificados.
– QA y QC, repetibilidad, reproducibilidad, linealidad, estabilidad, límites de detección e incertidumbre total en los datos obtenidos en CSIA.
20. Aplicaciones del análisis de isotopos estables en compuestos específicos:
– Certificación de autenticidad de alimentos (miel, zumos, aromas, aceites, café, té, cacao).
– Arqueología.
– Ciencias ambientales.
21. El proceso cromatográfico:
– Aspectos fundamentales.
– Componentes: fase móvil, fase estacionaria.
– Definición de cromatografía de líquidos (LC), definición de cromatografía de gases (GC).
22. Parámetros cromatográficos:
– Tiempo de retención, factor de capacidad, selectividad, eficacia-número de platos, altura equivalente de plato teórico, ensanchamiento de banda, eficacia, resolución.
23. Cromatografía de líquidos (I).
– Fundamentos: el cromatógrafo de líquidos.
– Mantenimiento y acondicionamiento del equipo LC.
24. Cromatografía de líquidos (II).
– Modos: fase normal, fase reversa, intercambio iónico, exclusión por tamaño.
25. Cromatografía de líquidos (III).
– Optimización del proceso cromatográfico en LC: selección de columnas, selección de fases móviles, modo isocrático, modo gradiente.
– Detectores: ultravioleta-visible y fluorescencia. Acoplamiento, acondicionamiento y mantenimiento.
26. Cromatografía de gases:
– Fundamentos: el cromatógrafo de gases.
– Optimización del proceso cromatográfico en GC.
– Detectores.
«Espectroscopía Fotoelectrónica de Rayos X»
1. Fundamentos básicos de la Espectroscopia Electrónica de Rayos X (XPS):
– Principios básicos y efecto fotoeléctrico.
– Niveles electrónicos atómicos.
– Acoplamiento spin-órbita.
– Emisiones Auger.
– Notación de picos (XPS y Auger).
– Energía de ligadura y energía cinética de electrones fotoemitidos.
– Longitud de atenuación efectiva de los electrones y Ley de Beer-Lambert.
– Profundidad del análisis y sensibilidad superficial.
2. Fundamentos básicos de la Espectroscopía Electrónica Auger (AES):
– Espectros Auger.
– Nomenclatura.
– Comparación con XPS, ventajas e inconvenientes.
– Aplicaciones.
– Instrumentación para AES.
– Cañón de electrones.
– Tipos de analizadores.
– Detector.
3. Diseño general del Espectrómetro Fotoelectrónico de Rayos X:
– Partes generales del equipo.
– Sistemas de ultra-alto vacío y diferentes tipos de sistemas de vacío.
– Tipos de medidores de vacío.
– Sistema de refrigeración.
– Operación del sistema de introducción de muestras.
– Cámara de tratamiento de muestras y cámara de análisis.
4. Fuentes de Rayos X:
– Principios básicos de funcionamiento.
– Tipos de ánodos de Rayos X.
– Ventajas e inconvenientes de los diferentes tipos de ánodos.
– Monocromador de Rayos X.
– Efecto Bremsstrahlung.
– Sistema de compensación de carga.
5. Sistemas de Lentes de transferencia:
– Principios de funcionamiento de las lentes de transferencia.
– Tipos de lentes de transferencia.
– Lentes para la definición del área de análisis.
– Lentes para el ajuste de la energía de los electrones (lentes de retardo).
6. Analizador de electrones:
– Principios de funcionamiento.
– Tipos de analizadores de electrones.
– Modos de operación.
– Energía de paso.
– Función de transmisión.
– Resolución.
– Factores que afectan a la resolución.
7. Detectores:
– Principio de funcionamiento de los multiplicadores de electrones.
– Tipos de multiplicadores.
– El detector tipo DLD (Delay Line Detector).
– Ventajas e inconvenientes de los diferentes tipos.
– Espectroscopia de escaneado e instantánea.
8. Acondicionamiento de muestras:
– Preparación de muestras sólidas.
– Preparación de muestras pulverulentas.
– Eliminación del material volátil.
– Técnicas de acondicionamiento de muestras erosión, abrasión, rotura, raspado y molienda). Tipos de montaje.
– Pretratamientos de muestras: tratamientos térmicos, tratamientos en atmósfera oxidante, tratamientos en atmósfera reductora.
9. Operación del Equipo de XPS:
– Desarrollo de métodos de análisis.
– Procedimiento seguro de introducción y extracción de muestras.
– Programación de análisis con el sistema automático de muestreo.
– Ajuste de las lentes de apertura y el iris.
10. Tipos de análisis:
– Elección de las condiciones experimentales.
– Interpretación general de espectros.
– Características espectrales.
– Estructuras primaria y secundaria de los espectros.
– Efectos de estado inicial.
– Efectos de estado final.
– Análisis de datos.
– Corrección de carga.
11. Interpretación cualitativa de espectros:
– Identificación de líneas.
– Espectros a alta resolución y estructura fina del espectro.
– Análisis de estados de oxidación y desplazamiento químico.
– Parámetro Auger.
– Efectos no deseados en los espectros y picos fantasmas.
– Plasmones.
– Multipletes.
– Picos satélite «Shake-up».
12. Interpretación cuantitativa de espectros:
– Adquisición de espectros generales.
– Determinación de la composición elemental de la superficie.
– Sección cruzada de fotoionización (cross-section).
– Librerías de factores de sensibilidad.
– Ajuste de picos.
– Corrección del fondo (background).
– Factores que influyen en la cuantificación relativos a la muestra.
– Factores que influyen en la cuantificación relativos al espectrómetro.
– Límites de detección del sistema.
13. Análisis de perfiles de composición en profundidad:
– Métodos destructivos y no destructivos.
– XPS de resolución angular.
– Uso del cañón de iones.
– Fuentes de iones.
– Calibración y alineación del cañón de iones.
– Factores que afectan a la eliminación del material.
– Resolución del perfil de profundidad.
– Factores que afectan a la resolución del perfil de profundidad.
14. Análisis de muestras aislantes:
– Problemas de las muestras aislantes.
– Uso del neutralizador de carga.
– Optimización de los parámetros del neutralizador.
– Calibración de la escala de energía en muestras aislantes.
15. Espectroscopía de área seleccionada (Small Area XPS):
– Sonda virtual.
– Modos de operación.
– Espectroscopía XPS de área seleccionada definida por las lentes.
– Espectroscopía XPS de área seleccionada definida por la fuente.
– Resolución lateral.
– Aplicaciones.
16. XPS Imaging and Mapping:
– Sistemas para la adquisición de imágenes.
– Adquisición en serie.
– Adquisición en paralelo.
– Procesamiento de datos de mapas.
17. Análisis con variación de temperatura:
– Funcionamiento del sistema de calentamiento y enfriamiento.
– Procedimiento de desgasificado.
– Precauciones en el proceso de calentamiento.
– Procedimiento de enfriamiento.
– Precauciones en el proceso de enfriamiento.
18. Manejo de celdas de reacción catalítica:
– Instrumentación.
– Sistema de control de gases.
– Sistema de evacuación.
– Sistema de control de temperatura.
– Inserción de muestras.
– Transferencia entre la celda catalítica y la cámara de análisis.
19. Mantenimiento del Equipo de XPS:
– Calibrado de un equipo de XPS.
– Uso de espectros de referencia.
– Calibración de la energía de paso y de la escala de energía.
– Confirmación del tamaño y verificación del rendimiento en el modo de punto pequeño (small area).
– Calibración del sistema de compensación de carga.
– Métodos preventivos y correctivos.
– Procedimiento de «baking».
– Puesta a punto tras un proceso de «baking».
20. Manejo de software específico:
– Aplicación de programas específicos para la adquisición y procesado de datos de espectros de XPS.
– Vision Software y CASA XPS.
– Bases de datos esoectroscópicos.
– Elaboración de informes.
«Experimentación Animal y Animales Gnotobióticos-1»
1. Normativa europea y nacional en vigor relacionada con experimentación animal:
– Directiva 2010/63 2010/63/UE del Parlamento Europeo y del Consejo de 22 de septiembre de 2010 relativa a la protección de los animales utilizados para fines científicos.
– Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia.
– Ley 32/2007, de 7 de noviembre, para el cuidado de los animales, en su explotación, transporte, experimentación y sacrificio. Título I. Explotaciones, transporte, experimentación y sacrificio de animales. Título II. Inspecciones, infracciones y sanciones.
– Ley 6/2013, de 11 de junio, de modificación de la Ley 32/2007, de 7 de noviembre, para el cuidado de los animales, en su explotación, transporte, experimentación y sacrificio.
2. Normativa autonómica andaluza sobre experimentación animal:
– Ley 11/2003, de 24 de noviembre, de protección de los animales. Título I. Disposiciones. Generales. Título V. Infracciones y sanciones.
– Decreto 65/2012. de 13 de marzo, por el que se regulan las condiciones de sanidad y zootécnicas de los animales. Capítulo IV. Sección 3ª Experimentación animal. Capítulo V. Bienestar animal.
3. Orden de formación en experimentación animal ECC566/2015, de 20 de marzo, por la que se establecen los requisitos de capacitación de debe cumplir el personal que maneje animales utilizados, criados o suministrados con fines de experimentación y otros fines científicos incluyendo la docencia.
4. Normativa reguladora de la utilización de animales transgénicos.
– Ley 9/2003 de 25 de abril, por la que se establece el régimen jurídico de la utilización confinada, liberación voluntaria y comercialización de organismos modificados genéticamente. Título I. Capítulo I: objetivo y ámbito de la ley. Título II. Capítulo I. Utilización confinada de organismos modificados genéticamente.
5. Seguridad en el trabajo con animales de experimentación: zoonosis y alergias.
– Real Decreto 664/1997, de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo.
6. Biología fundamental de roedores y lagomorfos. Anatomía, histología y fisiología. Reproducción y cría: manipulación de embriones de ratón, desarrollo embrionario, congelación, fertilización, transferencia embrionaria.
7. Biología fundamental de peces cebra. Anatomía, histología, fisiología y reproducción.
8. Tipos de animales en función de su condición sanitaria. Estandarización microbiana. Obtención de animales en condiciones específicas. Eliminación, exclusión, contención y erradicación de contaminantes.
9. Tipos de animales en función de su condición genética.
– Cepas consanguíneas, coisogénicas, congénicas. Modificaciones genéticas: mutagénesis y transgénesis. Nomenclatura de los animales genéticamente modificados.
– Transgénesis inducida y mutagénesis condicional.
– Control de la deriva genética.
10. Animales gnotobióticos. Características, manejo, instalaciones, operaciones.
11. Instalaciones y equipos. Tipos y áreas de servicios. Condiciones ambientales de estabulación. Microambiente y macroambiente. Barreras y zonas protegidas. Estrategias de bioseguridad.
12. Monitorización ambiental. Controles, metodología y parámetros aplicables.
13. Equipos, condiciones ambientales y programa de control sanitario en instalaciones de peces cebra.
14. Control sanitario de la colonia de roedores y lagomorfos. Recomendaciones de la FELASA. Especificaciones microbiológicas.
15. Monitorización sanitaria. Metodología, factores que afectan a su eficacia, informes sanitarios.
16. Manejo de brotes de enfermedad. Repetición de test, contención y erradicación. Investigación de los brotes.
17. Manejo y programa de control sanitario de peces cebra.
18. Enfermedades de origen infeccioso y parasitario en roedores y lagomorfos. Etiología, patogenia, signos clínicos, lesiones y tratamiento, interferencia en la investigación.
19. Enfermedades genéticas y de manejo en roedores, lagomorfos. Etiología, patogenia, signos clínicos, lesiones y tratamiento, interferencia en la investigación.
20. Enfermedades infecciosas, de manejo, genéticas del pez cebra. Etiología, patogenia, signos clínicos, lesiones y tratamiento, interferencia en la investigación.
21. Patologías asociadas a alteraciones nutricionales y dietas deficientes. Modelos de enfermedad relacionadas con la nutrición.
22. Administración de sustancias y toma de muestras.
23. Procedimientos de anestesia de roedores, lagomorfos y peces cebra. Monitorización de la anestesia. Efectos de la anestesia en los procedimientos experimentales.
24. Procedimientos de analgesia en roedores, lagomorfos y peces cebra.
25. Técnicas de cirugía básica. Equipamiento, formas y tipos de suturas. Implicación de la cirugía en los experimentos. Curación y reparación.
26. Reconocimiento de angustia, estrés y sufrimiento. Hojas de valoración de los signos de dolor, angustia, sufrimiento. Criterios de punto final. Eutanasia de los animales de experimentación.
27. Técnicas de diagnóstico por imagen. Fundamentos y usos.
«Experimentación Animal y Animales Gnotobióticos-2»
1. Introducción a la Ciencia del animal de laboratorio.
– Desarrollo histórico.
– Definiciones.
– Experimentación Animal.
– Líneas de investigación.
2. Principios éticos.
– Desarrollo histórico.
– Relación animal hombre.
– Uso del animal de experimentación. Limitaciones.
– Grupos proteccionistas.
– Principio de las 3Rs.
– Métodos alternativos.
3. Comités de éticos de bienestar animal.
– Composición y funciones.
4. Legislación y normativas legales en la experimentación Animal.
– Aspectos básicos de la legislación.
– Normativa Europea.
– Normativa Española.
– Normativa Andalucía.
5. Normativa reguladora de la utilización de animales transgénicos.
6. Bienestar Animal.
– Manejo y manipulación del animal de laboratorio.
– Conducta.
– Reconocimiento de parámetros claves de pérdida de bienestar animal: dolor, sufrimiento y estrés.
– Enriquecimiento ambiental. Programa de enriquecimiento.
– Uso de puntos finales humanitarios.
7. Biología general del animal de laboratorio de las especies más habituales.
– Reproducción y cría de los animales de experimentación.
8. Nutrición, alimentación y bebida del animal de experimentación. Dietas básicas y experimentales.
– Requerimientos nutritivos.
– Elaboración de dietas, molido, mezcla y peletizado.
– Equipamiento básico de una planta de dietas.
– Envasado y almacenamiento.
– Nivel microbiológico de las dietas.
– Tratamientos.
9. Estado sanitario del animal de experimentación.
10. Eutanasia: definición, métodos adecuados.
– Eliminación de cadáveres y otros residuos. Normas sanitarias.
11. Organización y gestión de un animalario.
12. Instalaciones y equipos. Diseño y equipamiento para control. Tipos y áreas de servicios.
13. Condiciones ambientales de estabulación y mantenimiento. Equipos, jaulas y accesorios en las instalaciones.
14. Barreras y zonas protegidas. Sistemas de contención microbiológica. Tipos de barreras.
15. Modificación genética animal. Mutagénesis tradicional y transgénesis.
16. Modelos animales.
– Elección del modelo según el estudio.
17. Variables condicionantes. Parámetros fisiológicos, hemáticos y bioquímicos del animal de experimentación.
18. Tipos de animales de laboratorio en función de su condición sanitaria. Obtención de animales de condición sanitaria específica.
– Animales gnotobióticos y agnotobióticos.
– Gnotobiología. Animales libres de patógenos específicos (SPF). Animales libres de.
– gérmenes.
19. Instalación de animales Gnotobióticos. Equipamiento y manejo.
– Control microbiológico.
– Tratamientos ambientales.
20. Tipos de animales de laboratorio en función de su condición genética. Caracterización genética.
– Cepas consanguíneas, coisogénica,.
– Líneas congénicas y transgénicas.
21. La genética en el animal de laboratorio.
– Genética de poblaciones. Consanguinidad. Depresión consanguínea.
– Deriva genética. Control de la calidad y pureza genéticas.
22. Bioseguridad en el trabajo con animales de experimentación. Alergias, zoonosis, carcinógenos, materiales radiactivos, peligros físicos, patógenos.
23. Control de la salud y prevención de enfermedades. Cuarentena, higiene y desinfección. Estandarización microbiológica.
24. Manipulación de animales de laboratorio. Manejo e inmovilización. Marcaje e identificación. Administración de sustancias y toma de muestras.
25. Procedimientos de anestesia y analgesia.
– Agentes anestésicos. Elección del anestésico y efectos en los resultados experimentales.
– Complicaciones, manipulación postexperimental, seguridad y precauciones.
26. Cuarentena y transporte de los animales.
– Influencia del transporte. Medidas a tener en cuenta.
27. Procedimientos para inspecciones veterinarias de los Órganos competentes o habilitados para dicha función. Documentación, registros. Infracciones.
28. Cronobiología. Tipos de ritmos. Capacidad de sincronización. Organización del sistema circadiano.
«Información Genética»
1. Fundamentos de la Reacción en cadena de la polimerasa.
– Reactivos, protocolo, mecanismo de amplificación, Diseño de oligonucleótidos, Cuantificación de muestras.
2. Otros métodos de amplificación.
– Reacción en cadena de la ligasa, amplificación isotérmica, reactivos, protocolos, mecanismos de amplificación.
3. Variantes de PCR.
– PCR «Touch down» PCR, Ensamblaje mediante PCR, PCR «hot start».
4. Diferencias entre PCR de punto final y PCR cuantitativa.
– Diseño experimental, Controles, cebadores y sondas.
5. Tipos de reacciones.
– Diseño de las reacciones, reacciones de un paso y de dos pasos, reactivos.
6. Metodología de qPCR y análisis de resultados.
– Curva de calibración, réplicas, optimización, curvas de melting, PCR multiplex. Cuantificación absoluta, Cuantificación relativa. Valores Ct. Cuantificación con curva estándar. Cálculo de número de copias.
7. Manejo de termocicladores.
– Programación, Software de análisis, gradientes.
8. Fundamentos de RT-qPCR.
– Principios teóricos y aplicaciones Aplicación práctica de la RT-qPCR, extracción de ARN, retrotranscripción, métodos de amplificación.
9. Tipos de vectores, características principales.
– Plásmidos, vectores derivados de fagos, cósmidos, orígenes de replicación, marcadores, selección positiva, sitios MCS, secuenciación, vectores para purificación de proteínas.
10. Clonación de fragmentos de DNA.
– Fragmentos de restricción, productos de PCR, secuencias sintéticas.
11. Conceptos básicos de Biología Sintética.
– Definición, características principales, fundamentos teoricos. Partes, dispositivos y sistemas, BioBricks.
12. El registro de partes biológicas.
– Estructura del registro, distribuciones, búsquedas, consultas de partes.
13. Ensamblaje de BioBricks.
– Ensamblaje estándar, Ensamblaje 3A, Ensamblaje «in fusion», Ensamblaje Gibson, Ensamblaje por recombinación.
14. Introducción de ácidos nucléicos en bacterias y células.
– Transformación, electroporación, transfección, vectores virales, nanopartículas.
15. Geles de agarosa.
– Aplicaciones de distintos tipos de agarosa. Preparación de geles para electroforesis de DNAy de RNA, tampones para electroforesis, geles desnaturalizantes.
16. Tipos de electroforesis de ácidos nucléicos.
– Electroforesis de campo fijo, electroforesis con inversión de campo, electroforesis de campo pulsante, electroforesis en gradiente, técnicas de retraso en gel.
17. Manejo de fuentes de alimentación.
– Efecto del voltaje, intensidad, producción de calor, concentración de agarosa, concentración de tampones, tamaño de las cubetas.
18. Uso de la electroforesis para la purificación de fragmentos.
– Tipos de agarosa, técnicas de extracción, técnicas de purificación.
19. Transferencia e hibridación en filtros de nylon y nitrocelulosa.
– Transferencia de DNA, transferencia de RNA, tipos de filtros y características. Marcaje de sondas, condiciones de hibridación, lavados, revelado.
20. Electroforesis en poliacrilamida.
– Preparación de geles y tampones. Usos y aplicaciones.
21. Fundamentos teóricos de la secuenciación Sanger.
– Preparación de las muestras, tipos de reacciones, lectura de la secuencia.
22. Interpretación de resultados de secuenciación.
– Lectura de la secuencia, posibles artefactos y sus soluciones.
23. Manejo, mantenimiento y aplicaciones del secuenciador.
– Puesta a punto y limpieza, programación, software, Detección de SNPs, análisis de polimorfismos de conformación de cadena simple (SSCP), Análisis de repeticiones cortas en tándem (STR).
24. Tecnologías NGS.
– Similitudes y diferencias entre tecnologías. Plataformas NGS. Construcción de librerías, software de manejo de experimentos, Protocolos, kits, parámetros de procesamiento.
25. Secuenciación por nanoporos.
– Fundamentos teóricos, secuenciador y funcionamiento del nanoporo. Protocolos.
26. Análisis bioinformático.
– Alineamiento de secuencias, Análisis de expresión diferencial, Expresión diferencial sin genoma de referencia.
27. Instrumentación, Manejo de bioanalizador, espectrofotómetro, fuente robótica, software de los equipos, secuenciadores.
«Laboratorio de Isótopos Estables y Microscopía Electrónica de Barrido Ambiental»
1. Fundamentos de geoquímica de isótopos estables.
– Estructura interna de los átomos y características generales de los isótopos. Isótopos estables. Estabilidad y abundancia. Masa atómica relativa.
– Abundancia natural de isótopos y sus variaciones.
2. Procesos de fraccionamiento isotópico.
– Intercambio isotópico: coeficiente de fraccionamiento y la escala delta (δ).
– Principales procesos que afectan al fraccionamiento isotópico.
– Fraccionamiento de los isótopos estables más usados en biogeoquímica: carbono, hidrógeno. nitrógeno, oxígeno y azufre (CHNOS).
3. Preparación de muestras en estudios biogeoquímicos.
– Consideraciones generales de los muestreos para los análisis isotópicos: muestreo de plantas, tejidos animales, materiales geológicos y aguas.
– Procedimientos más comunes: molienda, extracción de agua, digestión ácida, extracción y purificación.
4. Principios básicos de la espectrometría de masas de relaciones isotópicas de carbono, hidrógeno, nitrógeno, oxígeno y azufre (IRMS).
– Fundamentos.
– Fuente de ionización.
– Separación de iones por sector magnético.
– Sistema de detección iónica.
– Respuesta de los detectores: centrado de picos y efecto ambiental.
5. Espectrometría de masas de relaciones isotópicas con sistema de doble entrada (DI-IRMS) (I).
– Fundamentos y configuración.
– Medidas del gas de referencia y muestra.
– Cálculo de los valores del delta (δ).
– Optimización de métodos de DI-IRMS y acondicionamiento del equipo.
– Periféricos más comunes para DI-IRMS.
6. Espectrometría de masas de relaciones isotópicas con sistema de doble entrada (DI-IRMS) (II).
– Análisis simultáneo de d18O y d13C en carbonatos por acidificación. Factores que afectan a los análisis.
– Preparación de las muestras.
– Optimización de los métodos, corrección de coeficientes de fraccionamiento y normalización.
– Análisis de isótopos ligados, clumped isotopes, ∆47 en carbonatos. Preparación de muestras y medidas.
7. Espectrometría de masas de relaciones isotópicas mediante flujo continuo (CF-IRMS).
– Fundamentos y configuración.
– Gas porteador y flujo del gas.
– Sistema de entrada de muestra y de gas de referencia (open-split).
– Optimización de métodos y acondicionamiento del equipo. Separación de picos.
– Detección de picos e integración para el cálculo de las relaciones isotópicas.
– Normalización.
– Técnicas más comunes en IRMS de flujo continuo y periféricos usados: EA-IRMS, TC/EA-IRMS, GC-C-IRMS, GC-TC-IRMS.
8. Analizador elemental acoplado a IRMS (EA-IRMS y TC/EA-IRMS).
– Fundamentos y configuración.
– Optimización de los métodos.
– Método de análisis de muestras sólidas orgánicas e inorgánicas: d13C, d15N, d34S, d2H, d18O.
– Métodos de análisis de muestras líquidas: d2H, d18O. Diferencias entre los métodos para la determinación de d2H.
– Métodos de análisis de muestras gaseosas.
– Métodos y cálculos de análisis elemental.
9. Correcciones y control de calidad en el análisis de isótopos estables.
– Corrección del factor 3H.
– Corrección isobárica en CO2, de blanco, linealidad y deriva.
– Material de referencia primario internacional y material certificado.
– Incertidumbre total: repetitividad, reproductibilidad y límites de detección.
10. Espectroscopía CRDS (Cavity Ring Down Spectroscopy) para el análisis de relaciones de isótopos estables.
– Fundamentos y tipos de analizadores.
– Análisis de d18O y d13C y exceso de 17O de aguas. Componentes y optimización.
– Estándares y normalización.
– Ventajas y limitaciones de esta técnica frente al IRMS.
11. Control rutinario y mantenimiento de los equipos.
– Comprobación de los parámetros de la fuente iónica (tuning).
– Detección de fugas.
– Comprobación del fondo: agua, nitrógeno y CO2.
– Linealidad, estabilidad y enriquecimiento respecto al cero.
– Cambio de filamento.
– Limpieza de la fuente.
– Mantenimiento del sistema de vacío.
12. Microscopio electrónico de barrido (SEM):
– Tipos y modos de funcionamiento.
– Componentes de la columna de un SEM: cañón de electrones, lentes electromagnéticas y aperturas.
– Aberraciones.
– Alineamientos.
– Sistemas correctores del astigmatismo.
– Sistemas de vacío para alto vacío y para presión variable.
– Sistema eléctrico.
– Cámaras portamuestras.
13. Interacción del haz de electrones con la muestra y señales.
– Volumen de interacción (simulación de Montecarlo), rango, influencia del haz de electrones y tipo de muestras.
– Electrones secundarios.
– Electrones retrodispersados.
– Electrones Auger.
– Catodoluminiscencia.
– Rayos X.
– Daños en las muestras causados por la irradiación.
– Contaminación de la superficie de las muestras.
14. Formación de la imagen en el microscopio electrónico de barrido.
– Construcción de las imágenes y digitalización. Registro de las imágenes, tipos y procesados. Monitores y cámaras.
– Magnificación y calibraciones.
– Profundidad de campo.
– Factores que afectan a la resolución y a la calidad de la imagen.
– Resolución y diámetro del haz de electrones.
– Detectores de señales en cámara y en columnas. Imágenes topográficas e imágenes composicionales.
15. Preparación de muestras para la observación en el microscopio electrónico de barrido ambiental.
– Muestras biológicas. Obtención del material y técnicas básicas.
– Muestras geológicas para la observación en el microscopio electrónico de barrido, microanálisis de rayos X, análisis mineralógico y EBSD.
– Procedimientos para eliminar las cargas en muestras no conductoras. Evaporadores y sputtering.
16. Principios de microscopía electrónica de barrido ambiental (ESEM) y de presión variable. (VPSEM).
– Características instrumentales especiales de los ESEM y VPSEM.
– Efecto de la amplificación de la señal por ionización de gas.
– Trayectoria libre de los electrones primarios. Distancia que recorren los electrones primarios a través del gas (d, GPL) y distancia de trabajo. Efecto ¨falda» (skirt effect).
– Uso de diferentes gases.
– Ionización y excitación.
– Efecto de la presión de gas en la trayectoria de los electrones primarios.
– Formación de imágenes de muestras no conductoras sin recubrimientos.
– Detectores de señales para los diferentes modos de trabajo.
– Imagen composicional y topográfica.
– Principios involucrados en la generación de la imagen cuando se usa vapor de agua.
17. Aplicaciones de la microscopía electrónica de barrido ambiental (ESEM) y de presión variable (VPSEM).
– Caracterización de material aislante.
– «Wet-STEM».
– Experimentos in situ a baja temperatura con pletina «Peltier» y a alta temperatura con pletina de calentamiento.
– Experimentos de evaporación y condensación de agua.
– Aplicaciones en muestras biológicas.
– Caracterización de materiales blandos o líquidos.
18. Microscopía electrónica de baja temperatura ¨Cryo-SEM¨.
– Fundamentos y componentes del equipo.
– Modo de trabajo.
– Preparación de muestras.
– Aplicaciones.
19. Técnicas analíticas en el microscopio electrónico de barrido.
– Fundamentos generales del microanálisis de rayos X.
– Espectrómetro de rayos X de energía dispersiva (EDX).
– Correcciones de matriz (ZAF). Limitaciones, interferencias y artefactos.
– Determinaciones cualitativas y cuantitativas.
– Mapas elementales.
– Microanálisis de rayos X en presencia de un gas. Minimización del efecto del gas en los análisis y métodos de corrección.
20. Aplicaciones de las técnicas analíticas en el microscopio electrónico de barrido al estudio mineralógico y textural automatizado en Ciencias de la Tierra e industria minera.
– Fundamentos y procesos del análisis mineralógico y petrográfico con el sistema «QuemScan».
– Calibraciones.
– Modos de trabajo y optimización de los parámetros de medida.
– Fabricación y modificación de las librerías de minerales. Lista de minerales para su clasificación, librerías primaria y secundaria.
– Procesados e informes.
21. Microscopía de barrido con sistema de catodoluminiscencia.
– Principios de la catodoluminiscencia.
– Instrumentación.
– Generación e interpretación de imágenes de catodoluminiscencia.
– Análisis espectral e híper-espectral.
– Aplicaciones en Ciencias de la Tierra.
22. Otras técnicas de microscopía electrónica.
– Difracción de electrones retrodispersados (EBSD). Fundamentos e Interpretación. Aplicaciones en Ciencias de la Tierra y de los Materiales.
– Microscopio electrónico con haz de iones focalizado (FIB). Fundamentos, tipos y detectores. Preparación de lamelas y generación de Imágenes 3D.
23. Procesado y tratamiento de imágenes digitales en microscopía electrónica.
– Mezclas de señales para construir imágenes.
– Paletas de color, normalización y ecualización. Imágenes en falso color.
– Imágenes estereoscópicas y estudios de metrología de la superficie a partir de modelos 3D. Alturas, distancias reales y ángulos.
24. Mantenimiento general del microscopio electrónico de barrido ambiental.
– Alineaciones en sistemas termoiónicos y de emisión de campo.
– Cambio de aperturas en ESEM termoiónico y de emisión de campo.
– Mantenimiento y limpieza de la estación »Cryo-SEM» y todos los componentes involucrados.
– Mantenimiento del sistema de vacío y refrigeración.
– Cambio de filamento, alineamientos, verificaciones y calibraciones, limpieza de la cámara.
«Microscopía de Fluorescencia y Confocal y Microscopía Confocal Multifotón»
1. Fundamentos y métodos de fijación tisular.
2. Métodos y técnicas de inclusión de muestra biológicas para microscopia fotónica.
3. Técnicas de corte tisular y Micrótomo de rotación.
4. Fundamentos generales de la coloración tisular.
5. Tinciones rutinarias sobre material parafinado para microscopia fotónica.
6. Fundamentos biológicos de la inmunohistoquímica.
7. Técnicas inmunoenzimáticas de última generación basadas en polímeros.
8. Marcadores de diferenciación epitelial de utilidad en inmunohistoquímica.
9. Marcadores de diferenciación mesenquimal de utilidad en inmunohistoquímica.
10. Marcadores de diferenciación leucocitaria de utilidad en inmunohistoquímica.
11. Marcadores de diferenciación neuroendocrina y nerviosa.
12. Marcadores tumorales en inmunohistoquímica.
13. Técnicas de coloración en muestras citológicas. Inmunocitoquímica.
14. Fundamentos y utilidad de la biopsia líquida.
15. Fundamentos del sistema de microscopia barrido láser. Microscopio confocal.
16. Diferencias entre la microcopia confocal convencional y la microscopia multifotónica.
17. Métodos de fijación, procesamiento, inclusión y corte de muestra biológicas en congelación. Cortes criostáticos.
18. Técnicas de inmunofluorescencia para microscopía confocal.
19. Marcados múltiples, visualización de transcritos y proteínas.
20. Aplicaciones más frecuentes de la microscopía confocal: Colocalización y análisis tridimensional.
21. Aplicaciones de la microscopía láser confocal sobre células vivas. Microscopia a tiempo real. Proteínas fluorescentes para estudios funcionales (GFP).
22. Herramientas avanzadas de microscopia confocal: Recuparación de fluorescencia por fotoblanqueo (FRAP), Transferencia de energía por resonancia fluorescente (FRET).
23. Técnicas de marcado para estudios de expresión génica in situ.
24. Visualización de la estructura vegetales y de los alimentos mediante microscopía de escaneo láser confocal.
25. Análisis de imágenes de fluorescencia.
«Microscopía Electrónica de Barrido»
1. Microscopía Electrónica de Barrido.
– Antecedentes históricos.
– Evolución del Microscopio Electrónico de Barrido.
– Tipos de Microscopios Electrónicos de Barrido y modos de trabajo.
– Microscopio Electrónico de Barrido convencional (SEM) y Microscopio Electrónico de Barrido de Emisión de Campo (FESEM). Especificidades e indicaciones.
2. Componentes del Microscopio Electrónico de Barrido (I).
– Cañón de electrones: tipos y características.
– Componentes de la columna: lentes, aperturas, deflector del haz.
3. Componentes del Microscopio Electrónico de Barrido (II).
– Sistemas de vacío y bombas de vacío.
– Válvulas.
– Sistema eléctrico.
– Plataformas portamuestras.
4. Características de las lentes del Microscopio Electrónico de Barrido (SEM).
– Aberraciones de las lentes.
– Alineamientos.
– Sistemas correctores del astigmatismo.
5. El haz de electrones en el Microscopio Electrónico de Barrido.
– Formación del haz de electrones.
– Parámetros del haz de electrones.
6. Interacción del haz de electrones con la muestra en el Microscopio electrónico de barrido (I).
– Esquema de la interacción.
– Dispersión de electrones.
– Volumen de interacción (simulación de Monte Carlo).
– Factores que influyen en el volumen de interacción. Rango del electrón.
– Daños causados por la radiación en las muestras. Contaminación de la superficie de las muestras.
7. Interacción del haz de electrones con la muestra en el Microscopio electrónico de barrido (II).
– Señales de dispersión elástica: electrones retrodispersados.
8. Interacción del haz de electrones con la muestra en el Microscopio electrónico de barrido (III).
– Señales de dispersión ineslástica: electrones secundarios, rayos-X, electrones Auger y catodoluminiscencia.
9. Formación e interpretación de la imagen en el Microscopio Electrónico de Barrido (I).
– Construcción de la imagen.
– Imágenes digitales. Monitores y cámaras.
– Magnificación y calibraciones de la imagen. Profundidad de campo.
– Factores que afectan a la imagen. Distorsión de la imagen.
10. Formación e interpretación de la imagen en el Microscopio Electrónico de Barrido (II).
– Detectores de señales.
– Imágenes de composición química y de topografía a baja magnificación.
– Imágenes a alta resolución.
– Imágenes a baja energía.
11. Espectrometría de Rayos-X de Energía Dispersiva en el Microscopio Electrónico de Barrido (I).
– Fundamentos generales.
– Espectrómetro de Rayos-X de Energía Dispersiva.
– Limitaciones, interferencias y artefactos.
12. Espectrometría de Rayos-X de Energía Dispersiva en el Microscopio Electrónico de Barrido (II).
– Determinaciones cualitativas.
13. Espectrometría de Rayos-X de Energía Dispersiva en el Microscopio Electrónico de Barrido (II).
– Determinaciones cuantitativas.
14. Espectrometría de Rayos-X de Energía Dispersiva en el Microscopio Electrónico de Barrido (III).
– Mapas elementales.
– Fundamentos de las correcciones de matriz (ZAF): efecto del número atómico (Z), efecto de la absorción de Rayos-X (A) y efecto de la Fluorescencia de Rayos-X (F).
15. Sistema de Haz de Iones Focalizados (FIB) (I).
– Fuentes de iones.
– Componentes de la columna iónica.
– Sistemas de inyección de gases.
16. Sistema de Haz de Iones Focalizados (FIB) (II).
– Principios básicos de la interacción de los iones con la materia y formación de imágenes con iones.
17. Sistema de Doble Haz de Iones Focalizados y Electrones (FIB-SEM).
– Fundamentos de las reconstrucciones 3D.
– Fundamentos de la preparación de lamelas.
18. Otras técnicas de Microscopía Electrónica (I).
– Microscopía Electrónica de Transmisión y Microscopía Electrónica de Transmisión de Barrido: fundamentos, detectores y microanálisis.
– Diferencias entre la Microscopía Electrónica de Barrido y la Microscopía Electrónica de Transmisión (TEM).
19. Otras técnicas de Microscopía Electrónica (II).
– Microsonda Electrónica y Espectrometría de Rayos-X de Longitud de Onda Dispersiva: fundamentos y configuración de la Microsonda Electrónica.
– Comparación entre Espectrometría de Rayos-X de Energía Dispersiva y Espectrometría de Rayos-X de Longitud de Onda Dispersiva.
20. Otras técnicas de Microscopía Electrónica (III).
– Catodoluminiscencia: fundamentos.
– Difracción de Electrones Retrodispersados: fundamentos.
21. Preparación de muestras para Microscopía Electrónica de Barrido.
– Tipos de soportes y adhesivos.
– Recubrimientos metálicos para muestras no conductoras: evaporadores y sputterings.
22. Preparación de muestras inorgánicas para su estudio mediante Microscopía Electrónica de Barrido.
– Generalidades.
– Aplicaciones en metales, muestras cerámicas y geológicas, arenas, suelos, arcillas, partículas y fibras.
23. Preparación de muestras biológicas y orgánicas para su estudio estructural mediante Microscopía Electrónica de Barrido.
– Generalidades.
24. Mantenimiento general y preventivo del Microscopio Electrónico de Barrido Convencional (SEM).
– Condiciones de la sala.
– Cambio de filamento y limpieza de aperturas.
– Alineamientos, verificaciones y calibraciones.
25. Mantenimiento general y preventivo del Microscopio Electrónico de Barrido de Emisión de Campo (FESEM).
– Condiciones de la sala.
– Cambio de filamento y limpieza de aperturas.
– Alineamientos, verificaciones y calibraciones.
26. Organización de un servicio de Microscopía Electrónica de Barrido.
– Diseño e infraestructura.
– Equipamiento: elementos de almacenaje de muestras, dewards de nitrógeno líquido.
– Procedimiento de prestación del servicio en el marco del CIC.
«Microscopía Electrónica»
1. Fundamentos y métodos generales de fijación tisular.
2. Fundamentos y métodos de fijación tisular para técnicas ultraestructurales.
3. Métodos y técnicas de inclusión de muestra biológicas para microscopia fotónica.
4. Técnicas de corte tisular y micrótomo de rotación.
5. Fundamentos generales de la coloración tisular.
6. Métodos de fijación, procesamiento, inclusión y corte de muestra biológicas en congelación. Cortes criostáticos.
7. Técnicas de inmunofluorescencia.
8. Procesamiento y métodos de inclusión de muestra biológicas para microscopia electrónica de transmisión.
9. Tipos de Buffers para microscopía electrónica.
10. Microscopio Electrónico de Transmisión. Fundamentos físicos. Programas de análisis de imágenes.
11. Técnicas de corte y tinción de contraste para microscopia electrónica de transmisión. Ultramicrotomía.
12. Obtención de imágenes en un microscopio electrónico de transmisión.
13. Causas y remedios más frecuentes de defectos en las secciones ultrafinas.
14. Fundamentos técnicos de la microscopia electrónica de barrido.
15. Métodos de fijación de muestra biológicas para miscroscopia electrónica de barrido.
16. Técnica de criofractura para microscopia electrónica.
17. Métodos de procesamiento e inclusión de muestra biológicas para miscroscopia electrónica de barrido.
18. Obtención de imágenes en un microscopio electrónico de barrido.
19. Técnicas de inmunomarcaje a nivel ultraestructural.
20. Microscopia electrónica de rastreo SEM-EDX. Microanálisis por dispersión de energías de rayos-X.
21. Componentes ultraestructurales celulares.
22. Patologías donde está indicada la microscopia electrónica para mejorar la precisión diagnóstica.
23. Aplicaciones en investigación de la microscopía electrónica de transmisión.
24. Aplicaciones en investigación de la microscopía electrónica de barrido.
25. Fundamento y aplicaciones de la microdisección por captura láser.
«Perforación y Testificación de Rocas y Drones»
1. Prospección geológica: conceptos básicos. Métodos de prospección: medios mecánicos, medios geofísicos y medios geoquímicos. Conceptos básicos de perforación mecánica.
2. Las rocas y su reconocimiento. Rocas ígneas félsicas, intermedias, máficas y ultramáficas. Rocas sedimentarias detríticas y químicas. Rocas metamórficas foliadas y no foliadas. Criterios de reconocimiento de rocas a visu.
3. Métodos de perforación aplicados a geología. La perforación a percusión, rotopercusión y rotación: diferencias entre los tipos de perforación y tipos de muestras obtenidas.
4. Los sondeos en investigación. Generalidades. Métodos de recuperación de testigo continuo en sondeos: rotación, presión y percusión o golpeo.
5. Equipos de sondeos con recuperación de testigo continúo. Generalidades. Características técnicas de sondas rotativas. Operaciones con sonda rotativa. Operaciones específicas para obtención de testigo continuo.
6. Útiles y herramientas en los sondeos con recuperación de testigo continuo. Material de perforación: wireline y convencional. Coronas, varillaje y tubos testigos: diámetros, características y aplicaciones.
7. Ensayos en sondeos. Realización e instalación de piezómetros. Ensayos de permeabilidad en sondeos: Lugeon y Lefranc. Ensayos geotécnicos en sondeos: Muestra Inalterada, Ensayo de penetración estándar (SPT) y Testigos parafinados.
8. Fluidos de perforación. Utilidad de revestimientos y fluidos en perforación mecánica. Tipos de fluidos en función de su composición: usos y aplicaciones. Impacto ambiental de fluidos de perforación.
9. Preparación de testigos de sondeo para investigación. Métodos de corte de testigos de sondeo. Fabricación de bandejas portatestigos. Resinas y materiales utilizables. Orientación de la sección de testigos de sondeo. Escaneo de imagen en testigos de sondeo. Escaneado de sección slabbed. Escaneado de muestras unrolled.
10. Introducción a la prospección geofísica. Métodos geofísicos en la geología: prospección electromagnética, prospección sísmica, prospección eléctrica, testificación de sondeos y gravimetría. Aplicaciones de las técnicas geofísicas a la geología.
11. Testificación geofísica de sondeos. Generalidades. Tipos de digrafías: «loggin while drilling» y «wireline logging». Equipos de testificación geofísica para sondas tipo slim hole: características y componentes.
12. Sondas de imagen óptica. Características generales. Principios de medición, ensamblaje, condiciones de operatividad y mantenimiento. Características de un registro de sonda de imagen óptica. Aplicaciones en investigación geológica.
13. Sondas de imagen acústica. Características generales. Principios de medición, procedimientos de operaciones, ensamblaje, comprobación, calibración y mantenimiento. Interpretación cuantitativa de imágenes acústicas. Aplicaciones en investigación geológica.
14. Sondas de rayos gamma natural. Características generales, principios de medición, ensamblaje, condiciones de operatividad y mantenimiento. Uso cuantitativo y cualitativo del registro de rayos gamma. Patrones estándar de registros de diagrafías de rayos gamma. Aplicaciones en investigación geológica.
15. Sondas de rayos gamma espectral. Características generales, principios de medición, ensamblaje, condiciones de operatividad y mantenimiento. Radioactividad natural en las rocas. Comportamiento geoquímico del potasio, el uranio y el torio en las rocas sedimentarias. Uso cuantitativo y cualitativo del registro diagráfico de rayos gamma espectral. Aplicaciones en investigación geológica.
16. Posproceso de datos de testificación geofísica. Programas de posproceso y representación gráfica de datos. WellCAD 5.1: Aplicaciones a la caracterización geológica, petrofísica y geomecánica del subsuelo.
17. Sedimentología a partir de testigo de sondeo y diagrafía de pozo. Facies, secuencias estratigráficas y ambientes deposicionales a partir de registros de testificación geofísica combinados con testigos de sondeo.
18. Polaridad estratigráfica. Identificación de techo y muro de estratos. Polaridad normal e inversa. Criterios de reconocimiento de polaridad en testigo de sondeo. Patrones de polaridad a partir de datos geofísicos.
19. Fotogrametría y geología. Fundamentos de fotogrametría. Historia de la fotogrametría aérea. Equipos tradicionales. Aplicaciones de la fotogrametría en geología.
20. Fotogrametría digital tradicional vs programas de «structure from motion» SFM. Fundamento para el uso de programas SFM. Características del Software Pix4D. Características del software Agisoft Metashape.
21. Planificación de vuelos fotogramétricos con dron. Elección de altura de vuelo y escala del mapa. Parámetros del plan de vuelo, recubrimientos. Cálculo del Ground Sample Distance (GSD) para la planificación de un vuelo fotogramétrico. Planificación de vuelo para generar un Digital Outcrop Model (DOM).
22. Sistemas de coordenadas y puntos de control en fotogrametría. Elección del sistema de coordenadas. Georreferenciación de imágenes aéreas. Concepto, utilidad planificación de Ground Control Points (GCPs). Diferenciación de puntos de control y puntos de apoyo.
23. Planificación de vuelo con dron. Características de aeronaves pilotadas por control remoto. Procedimiento de puesta en vuelo y mantenimiento. Ejecución de un plan de vuelo automático por waypoints. Optimización del tiempo de vuelo.
24. Modelos digitales de afloramiento. Tipos. Caracterización e interpretación de un modelo digital de afloramiento (DOM). Flujo de trabajo en adquisición de datos. Procedimientos de modelización numérica de modelos digitales de afloramiento.
25. Real Decreto 1036/2017, de 15 de diciembre, por el que se regula la utilización civil de las aeronaves pilotadas por control remoto, y se modifican el Real Decreto 552/2014, de 27 de junio, por el que se desarrolla el Reglamento del aire y disposiciones operativas comunes para los servicios y procedimientos de navegación aérea y el Real Decreto 57/2002, de 18 de enero, por el que se aprueba el Reglamento de Circulación Aérea.
«Radiobioquímica e Inmunoanálisis»
1. Fundamentos de Física Nuclear: Estructura de la Materia, magnitudes Radiológicas, interacción de la radiación con la materia. Efectos biológicos de las radiaciones ionizantes.
2. Radionucleidos de uso frecuente en investigación biológica. Detección y medida de la radiación ionizante: Fundamentos y tipos de detectores. Dosimetría de la radiación externa e interna. Criterios generales y medidas básicas de protección radiológica.
3. Investigación con fuentes radiactivas no encapsuladas: Diseño general y organización de instalaciones radiactivas de centros de investigación. Requerimientos en cuanto a infraestructura de contención, retención y blindaje en función del rango de actividad. Dispositivos de protección radiológica.
4. Puesta en práctica de un programa de protección radiológica operacional en instalación con fuentes no encapsuladas. Normas de manipulación de fuentes radiactivas no encapsuladas. Proceso de recepción, almacenamiento y transporte. Gestión de residuos radiactivos. Contaminación y descontaminación radiactiva.
5. Experimentación in vitro con emisores β y ϒ: Técnicas de marcaje de moléculas biológicas y cultivos celulares, aplicaciones, normas de manipulación específica para el marcaje, métodos de detección.
6. Legislación española sobre instalaciones radiactivas y organismos competentes relacionados con la protección radiológica. Aspectos legales y administrativos específicos de las instalaciones radiactivas de fuentes no encapsuladas.
7. Fundamentos de la Biología Celular y Molecular: Bases químicas de la vida. Bioenergética, enzimas y metabolismo. La estructura y función de la membrana plasmática. Respiración aeróbica y la mitocondria. Interacciones entre las células y su ambiente. El citoesqueleto y la movilidad celular.
8. Expresión génica: De la transcripción a la traducción. Control de la expresión génica. Replicación y reparación del ADN. Reproducción celular. Señalización celular y transducción de señales: comunicación intercelular.
9. Regulación del crecimiento y la muerte de las células: El ciclo celular y su regulación. Crecimiento celular anormal. Tipos de muerte celular. Envejecimiento y senescencia.
10. Bioquímica estructural de las proteínas: Definición, concepto y significación biológica. Características generales. Aminoácidos: sus clases y propiedades generales. Niveles de organización estructural de la molécula proteica. Propiedades químicas de las soluciones proteicas. Solubilidad. Precipitación. Clasificación de proteínas.
11. Bioquímica estructural de los ácidos nucleicos: Composición. Nucleótidos. Nucleósidos. Bases nitrogenadas y osas. Estructura y propiedades de ADN y ARN.
12. Biología del Cultivo Celular: Normas de trabajo y manipulación en condiciones estériles. Tipos de cultivo celular. Crecimiento y morfología del cultivo celular. Requerimientos de un cultivo celular. Mantenimientos de Subcultivo. Detección de contaminaciones en cultivos celulares.
13. Normas de buenas prácticas en un laboratorio de investigación biomédica. Seguridad en la manipulación de materiales con riesgo biológico.
14. Niveles de bioseguridad. Gestión de residuos químicos y biológicos. Control de calidad de los procedimientos de medida. Uso eficiente de los recursos de laboratorio.
15. Preparación de muestras biológicas para análisis: Principios y fundamentos de los métodos de separación de sustancias. Fraccionamiento celular y homogeneización. Filtración, diálisis y centrifugación. Técnicas de extracción, separación y purificación de proteínas y ácidos nucleicos. Manipulación y procesamiento de fluidos corporales y tejidos.
16. Técnicas de localización y caracterización de moléculas: Electroforesis SDS-PAGE, métodos de visualización y cuantificación de resultados. Transferencia e hibridación Southern blot, Northen blot, dot blot. Inmunotransferencia y western blot.
17. Citometría asistida por imagen en placa multipocillo con microscopio automatizado en canales de campo claro, contraste de fases digital y epifluorescencia. Método de imagen multicanal y sus aplicaciones. Consideraciones en el diseño de un experimento celular para el análisis de imagen. Condiciones óptimas y requerimientos del cultivo para extracción de datos cuantitativos de calidad en la imagen. Metodología de segmentación y análisis computacional de imágenes. Aplicaciones de la tecnología en cultivos celulares y microtejidos.
18. Técnicas analíticas basadas en el uso de anticuerpos: Conceptos de Antígeno y anticuerpo. El anticuerpo en la inmunotécnica. Marcaje de anticuerpos. Clasificación, señal y control de especificidad en inmunotécnicas. Sistema biotina-avidina. Criterios de validación de un inmunoensayo. Principios de ajuste de curva patrón en inmunoensayos. Solución de problemas comunes en inmunoensayos.
19. Conceptos generales y aplicaciones de las distintas técnicas inmunológicas: Inmunoensayos competitivos y no competitivos, en medio homogéneo o heterogéneo, captura en soportes sólidos o en suspensión. Marcadores radiactivos, enzimas, fluocromos y quimioluminiscencia. Inmunocitoquimica. Inmunoensayo multiplex con esferas en suspensión.
20. Ensayos de unión de ligando-receptor. Ley de acción de masas. Diseño de ensayos de saturación, de unión competitiva y de cinética de unión. Métodos de detección de la unión. Aspectos cuantitativos y transformación de datos de unión para el análisis.
21. Uso de Sondas fluorescentes para tinción celular: Fundamentos para la elección y combinación de fluocromos en un ensayo. Consideraciones para la tinción de células vivas, métodos de fijación y permeabilización celular, fundamentos de la tinción inmunofluorescente y conservación de muestras.
22. Espectroscopia óptica: Diseño general de instrumentos para la espectroscopía óptica, fuentes de radiación, selectores de longitud de onda: filtros y monocromadores y recipientes para la muestra. Aspectos cuantitativos de los métodos basados en la absorción. Ley de Lambet-Beer. Espectrometría UV-visible, fluorescencia y luminiscencia y aplicaciones.
23. Conceptos generales y aplicaciones de fluorimetría en tiempo retardado TRF, ensayos homogéneos de proximidad fluorescente amplificada ALPHA y metodologías basadas en mecanismos de transferencia de energía luminiscente FRET y TR-FRET.
24. Diseño de la medida de actividad enzimática: medio de reacción, medida de la velocidad de reacción, métodos de detección de la reacción enzimática. Cinética enzimática. Modelo de Michaelis-Menten. Aspectos cuantitativos y transformación de datos para el análisis.
25. Biosensor RWG: Fundamentos de un biosensor óptico con transductor de rejilla de ondas resonantes integrado en placa multipocillos. Detección de la redistribución dinámica de la masa en la superficie del biosensor y sus aplicaciones. Flujo de trabajo de trabajo en ensayos con celulares y bioquímicos.
26. Biosensor RWG: Componentes que intervienen en funcionamiento adecuado del biosensor con cultivos celulares o con moléculas. Identificación y resolución de problemas habituales en el de rendimiento del biosensor. Fundamentos para la inmovilización de moléculas diana en el biosensor y aspectos cuantitativos para la detección de la interacción molecular. Consideraciones para la siembra de células en el biosensor y aspectos cuantitativos parta la detección de la respuesta celular.
27. Implementación de sistemas automatizados en un laboratorio de investigación biomédica. Beneficios de un sistema robótico en un laboratorio. Requerimientos del sistema para el flujo de trabajo de un inmunoensayo. Modos de configuración y programación del sistema para la dispensación de líquidos en un ensayo. Optimización de protocolos de ensayo en el sistema. Mantenimiento del rendimiento del sistema robótico.
«Radiología Experimental»
1. Estructura atómica y nuclear. Unidades de masa y energía en física atómica. Energía de enlace del electrón en el átomo. Equivalencia entre masa y energía. Energía de enlace nuclear. Radionúclidos.
2. Núclidos estables o inestables. Tipos de desintegraciones radiactivas: alfa, beta, gamma, transición isomérica. Captura electrónica.
3. Radiactividad y reacciones nucleares. Actividad. Leyes de Desintegración. Período de semidesintegración. Vida media. Equilibrio radiactivo. Reacciones nucleares: fuentes de neutrones.
4. Radiación ionizante. Características de la radiación electromagnética (REM). Espectro electromagnético.
5. Radiación ionizante. Rayos X. Radiación característica y de frenado. Espectro de Rayos X.
6. Radiación ionizante. Rayos gamma. Media de emisores gamma por espectrometría gamma.
7. Reacciones nucleares. Fuentes de neutrones.
8. Interacción de la REM con la materia. Efecto fotoeléctrico, compton y producción de pares. Ley general de atenuación y parámetros asociados a ésta.
9. Interacción de la radiación particulada con la materia. Poder de frenado y alcance de partículas cargadas.
10. Magnitudes y Unidades Radiológicas. Magnitudes asociadas a la naturaleza de la radiación, a la interacción con la materia y al efecto biológico.
11. Detección y medida de la radiación (I). Fundamentos físicos de la detección. Detectores de gas: cámaras de ionización, contadores proporcionales, contadores Geiger-Müller.
12. Detección y medida de la radiación (II). Detectores de centelleo y semiconductor. Detectores fotográficos. Detectores de Termoluminiscencia (TLD).
13. Dispositivos experimentales para la irradiación de modelos celulares y de pequeños animales de experimentación. Diseño, construcción, mantenimiento y validación.
14. Efectos biológicos de la radiación ionizante (I). Etapas de la acción biológica de la radiación. Acción directa e indirecta de la radiación. Nivel molecular. Concepto de radiosensibilidad.
15. Efectos biológicos de la radiación ionizante (II). Nivel celular. Factores que influyen la radiosensibilidad celular.
16. Efectos biológicos de la radiación ionizante (III). Nivel tisular. Factores de influencia. Efectos deterministas y estocásticos.
17. Protección Radiológica (I). Sistema de limitación de dosis: justificación, optimización y limitación. Límites de dosis del personal profesionalmente expuesto y del público, límites de incorporación y derivados.
18. Protección Radiológica (II). Medidas generales de protección contra la radiación: distancia, tiempo y blindaje. Confinamiento. Clasificación del personal y de las zonas de trabajo y su señalización. Vigilancia: Control dosimétrico de áreas y de personal. Descontaminación.
19. Protección Radiológica (III). Gestión de residuos radiactivos en instalaciones radiactivas. Transporte de materiales radiactivos.
20. Legislación y normativa aplicable. Legislación española sobre instalaciones radiactivas y organismos competentes relacionados con la protección radiológica.
21. Instalaciones de investigación biológica. Técnicas de marcaje in vitro e in vivo con emisores beta, gamma y de positrones.
22. Radionucleidos de uso frecuente en investigación biológica. Propiedades y clasificación.
23. Protección radiológica en instalaciones radiactivas de fuentes no encapsuladas.
24. Contaminación en instalaciones radiactivas de fuentes no encapsuladas. Medidas de prevención y protección de la contaminación radiactiva. Vigilancia y control de la contaminación radiactiva. Descontaminación.
25. Gestión de residuos generados en instalaciones radiactivas de fuentes no encapsuladas. Control documental de la gestión de residuos. Control de calidad de la gestión de residuos.
26. Aspectos legales y administrativos de instalaciones radiactivas de fuentes no encapsuladas.
(La normativa exigible serán las versiones vigentes o disposiciones que la sustituyan, a fecha de publicación de la presente convocatoria.)
«Análisis del Comportamiento Animal»
– Capacidad para realizar la función e del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia (asumir la responsabilidad de la supervisión in situ del bienestar y cuidados de los animales), o categoría D1 del Real Decreto 53/2013, disposición transitoria quinta.
«Bioanálisis»
– Capacidad para realizar la función b del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia, artículo 15.2 (eutanasia de los animales), o categoría A, B o D2 del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función c del Real Decreto 53/2013, artículo 15.2 (realización de los procedimientos), o categoría B o C del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función d del Real Decreto 53/2013 (diseño de los proyectos y procedimientos), o categoría C del Real Decreto 53/2013, disposición transitoria quinta.
«Experimentación Animal y Animales Gnotobióticos-1»
– Capacidad para realizar la función e del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia artículo 15.2 (asumir la responsabilidad de la supervisión in situ del bienestar y cuidados de los animales), o categoría D1 del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función f del Real Decreto 53/2013 artículo 15.2 (asumir las funciones de veterinario designado), o categoría D2 del Real Decreto 53/2013 disposición transitoria quinta.
– Licenciado/Grado en Veterinaria.
«Experimentación Animal y Animales Gnotobióticos-2»
– Capacidad para realizar la función b del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia artículo 15.2 (eutanasia de los animales), o categoría A, B o D2 del Real Decreto 53/2013 disposición transitoria quinta.
– Capacidad para realizar la función c del Real Decreto 53/2013 artículo 15.2 (realización de los procedimientos), o categoría B o C del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función d del Real Decreto 53/2013 (diseño de los proyectos y procedimientos), o categoría C del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función e del Real Decreto 53/2013 (asumir la responsabilidad de la supervisión in situ del bienestar y cuidados de los animales), o categoría D1 del Real Decreto 53/2013, disposición transitoria quinta.
«Microscopía de Fluorescencia y Confocal y Microscopía Confocal Multifotón»
– Capacidad para realizar la función b del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia artículo 15.2 (eutanasia de los animales), o categoría A, B o D2 del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función c del Real Decreto 53/2013 artículo 15.2 (realización de los procedimientos), o categoría B o C del Real Decreto 53/2013, disposición transitoria quinta.
– Capacidad para realizar la función d del Real Decreto 53/2013 (diseño de los proyectos y procedimientos), o categoría C del Real Decreto 53/2013, disposición transitoria quinta.
«Perforación y Testificación de Rocas y Drones»
– Estar en posesión del Permiso de Circulación vigente Tipo C.
– Estar en posesión del Certificado vigente de Aptitud Profesional (CAP) Mercancías.
– Curso Avanzado de Piloto RPAS Teórico y Práctico: Equipos RPAS FV8 y RPAS AT FV4 ó similar.
– Certificado Médico Aeronáutico LAPL vigente.
«Radiobioquímica e Inmunoanálisis»
– Estar en posesión de la Licencia vigente de Supervisor de Instalaciones radiactivas, en el campo de aplicación «Laboratorio con Fuentes no Encapsuladas» homologado por el consejo de Seguridad Nuclear.
«Radiología Experimental»
– Estar en posesión de Licencia vigente de Supervisor de Instalaciones Radiactivas en el Campo de Aplicación de Laboratorios con Fuentes NO Encapsuladas.
– Estar en posesión de Licencia vigente de Supervisor de Instalaciones Radiactivas en el Campo de Aplicación de Radiografía Industrial.
– Estar en posesión de Licencia vigente de Supervisor de Instalaciones Radiactivas en el Campo de Aplicación de Control de Procesos, Técnicas Analíticas y otras actividades de riesgo restringido.
– Estar en posesión de la capacitación para las funciones: b) eutanasia de los animales, c) realización de los procedimientos y d) diseño de los proyectos y procedimientos, según el artículo 15.2 del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia y el artículo 3.2 de la orden ECC/566/2015.
El proceso selectivo constará de fase de oposición y fase de concurso. Los puntos de la fase de concurso no podrán aplicarse para superar la fase de oposición.
Fase de oposición
La fase de oposición tendrá una puntuación máxima de 70 puntos y estará formada de los siguientes ejercicios:
Primer ejercicio: Tendrá carácter eliminatorio y consistirá en contestar un cuestionario de 100 preguntas con 4 respuestas alternativas, de las que solo una será correcta, basado en el contenido del programa correspondiente que figura en el anexo I de esta convocatoria. Para la realización de este ejercicio los opositores dispondrán de cien minutos.
Se calificará de 0 a 40 puntos, siendo necesario para superarlo obtener una calificación mínima total de 20 puntos. La calificación del ejercicio será calculada de acuerdo al procedimiento establecido en el apartado Sistema de Corrección de los Ejercicios con Respuesta Alternativa incluido en esta convocatoria.
Segundo ejercicio: Tendrá carácter eliminatorio y consistirá en resolver uno o varios supuestos o pruebas prácticas propuestas por el Tribunal, basados en el contenido del programa correspondiente del Bloque Específico que figura para cada una de las plazas dentro del anexo I de esta convocatoria, en el tiempo y con los medios auxiliares que el Tribunal disponga.
Se calificará de 0 a 30 puntos, siendo necesario para aprobar obtener una calificación mínima de 15 puntos.
Por Acuerdo del Tribunal se publicará el listado provisional de aspirantes que han superado cada ejercicio, con indicación de sus calificaciones y se abrirá un plazo de tres días hábiles para presentar reclamaciones sobre el mismo. Finalizado el plazo anterior, y resueltas las reclamaciones que puedan presentarse, mediante Acuerdo del Tribunal se publicará la relación definitiva de aspirantes que han superado cada ejercicio, así como la fase de oposición tras la publicación del listado correspondiente al segundo ejercicio, con expresión de la calificación obtenida.
Las personas opositoras que no hayan alcanzado la puntuación mínima para superar cada uno de los ejercicios, tendrán la consideración de no aptas a todos los efectos, quedando eliminadas del proceso selectivo.
La calificación final de la fase de oposición vendrá determinada por la suma de las puntuaciones obtenidas en los dos ejercicios.
Sistema de corrección de los ejercicios con respuesta alternativa:
La nota mínima para aprobar un ejercicio será el 50 % de la puntuación máxima de ese ejercicio. Fórmula aplicable:
NME = PME*50/100
El número de preguntas válidas será igual al número total de preguntas en el cuestionario menos el número de preguntas anuladas. Fórmula aplicable:
NPV = NTPC – NPA
La puntuación de cada una de las preguntas válidas será el resultado de dividir la puntuación máxima del ejercicio entre el número de preguntas válidas. Fórmula aplicable:
PPV = PME / NPV
El número de preguntas puntuables será igual al número de preguntas correctas menos el número de preguntas incorrectas dividida por el número de respuestas alternativas de cada pregunta. Fórmula aplicable:
NPP = NPC – NPI/NRAP
Calificación:
La calificación del ejercicio será igual al producto de las preguntas puntuables obtenidas por el opositor y la puntuación de cada una de las preguntas. Fórmula aplicable:
C = NPP*PPV
Donde:
NME: Nota mínima para aprobar un ejercicio.
PME: Puntuación máxima del ejercicio.
NPV: Número de preguntas válidas.
NTPC: Número total de preguntas en el cuestionario.
NPA: Número de preguntas anuladas.
PPV: Puntuación de cada una de las preguntas válidas.
NPP: Número de preguntas puntuables.
NPC: Número de preguntas correctas.
NPI: Número de preguntas incorrectas.
NRAP: Número de respuestas alternativas de cada pregunta.
C: Calificación de un ejercicio.
Fase de concurso
Finalizada la fase de oposición tendrá lugar la fase de concurso. La puntuación máxima de esta fase será de 30 puntos. Tan solo participarán en esta fase aquellas personas aspirantes que hayan superado la fase de oposición.
Los méritos a valorar se referirán a la fecha de finalización del plazo de presentación de solicitudes de participación en el proceso selectivo.
Las personas aspirantes dispondrán de un plazo de diez días hábiles, contados a partir del día siguiente al de publicación de la listas de aspirantes que han superado de la fase de oposición, para presentar mediante el procedimiento «Procesos selectivos de PAS: Entrega de méritos (fase de concurso)», disponible en la sede electrónica de la Universidad de Granada (https://sede.ugr.es), la justificación documental de los méritos que quieran hacer valer en la fase de concurso o, en su defecto, solicitud expresa para que se computen los méritos que ya figuren en su expediente en el Servicio de Personal de Administración y Servicios.
Los méritos no justificados, en el plazo establecido al efecto y mediante el procedimiento establecido en el párrafo anterior no podrán ser valorados en la fase de concurso.
El Tribunal calificador publicará en el sitio web oficial del Servicio de Personal de Administración y Servicios (http://serviciopas.ugr.es/) la relación que contenga la valoración provisional de méritos de la fase de concurso, con indicación de la puntuación obtenida. Las personas aspirantes dispondrán de un plazo de diez días hábiles, a contar a partir del siguiente al de la publicación de dicha relación para efectuar las alegaciones pertinentes. Finalizado dicho plazo, el Tribunal publicará la relación con la valoración definitiva de la fase de concurso.
La valoración de los méritos se realizará de la siguiente forma:
Servicios prestados en la Universidad de Granada como personal funcionario en puestos de Técnico/a Puesto base, Gestión Puesto base y Técnico/a nivel 4 o 5, en el área correspondiente al perfil específico que se convoca: 0,01 puntos por día de servicios, con un máximo de 30 puntos.
Los puntos obtenidos en la fase de concurso, que en ningún caso podrán superar los 30 puntos, se sumarán a la puntuación final de la fase de oposición, a efectos de establecer el orden definitivo de aspirantes.
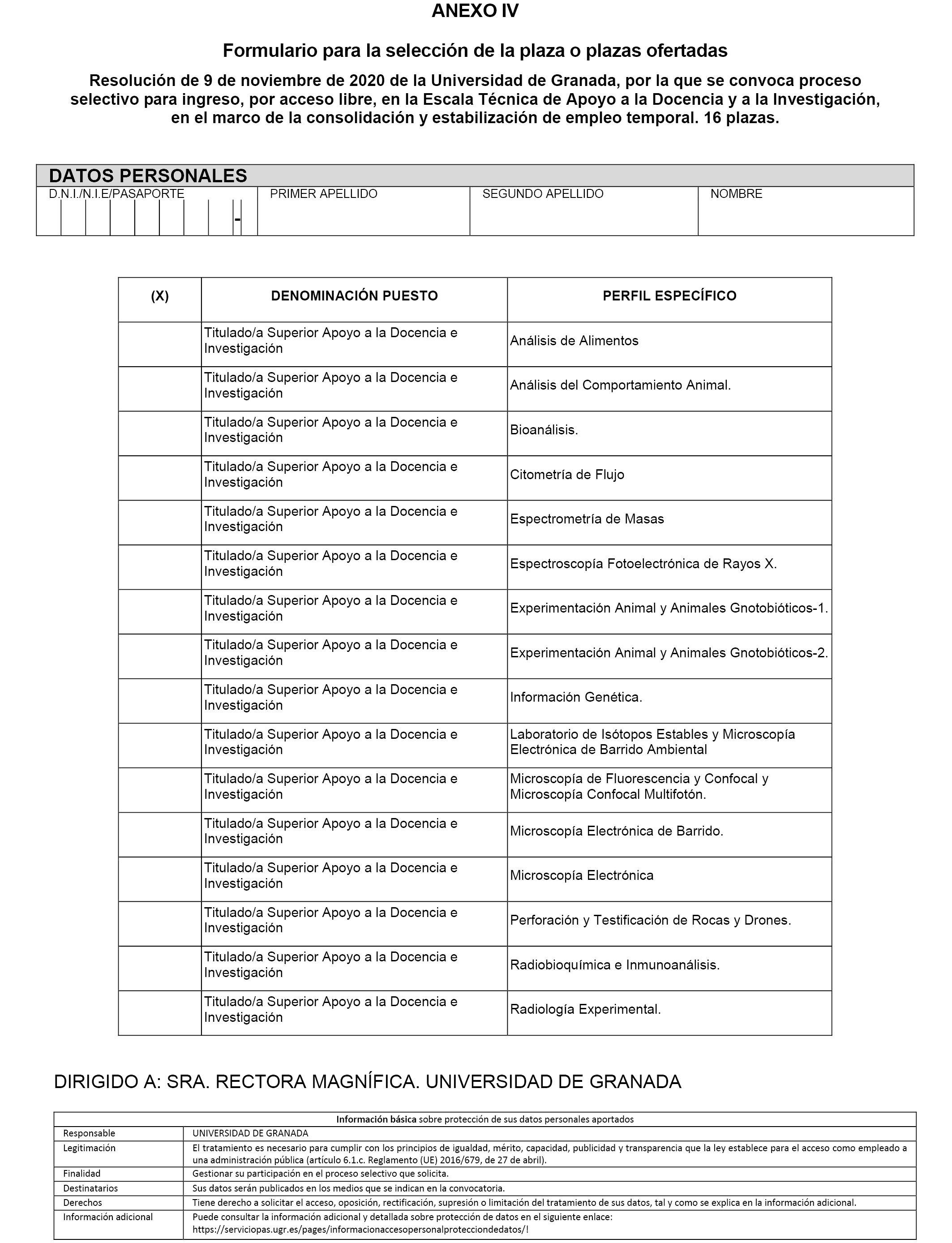
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid