 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.[Disposición derogada]
[Bloque 2: #pr]
El organismo nocivo Ralstonia solanacearum (Smith) Yabuuchi et al., conocido anteriormente por Pseudomonas solanacearum (Smith) Smith, es causa de las enfermedades de la «podredumbre parda» en los tubérculos de patata y de la «marchitez bacteriana» en las plantas de patata, tomate y otras especies de solanáceas, y representa una grave amenaza para las producciones de estos cultivos.
Debido a que en los últimos años han aparecido brotes de las enfermedades citadas en algunas partes de la Comunidad Europea y que aún subsisten algunos focos de infección aislados, y en particular respecto a España se han producido algunas intercepciones en Castilla y León y Galicia y, dicha bacteria está presente con una distribución localizada en la isla de La Palma en Canarias; considerando la importancia económica de los citados productos vegetales; y teniendo en cuenta que el conocimiento actual de la biología y epidemiología de Ralstonia solanacearum en las condiciones europeas es incompleto y que puede preverse la necesidad de revisar en el futuro las medidas y los procedimientos de análisis aquí establecidos, se hace preciso adoptar las medidas mínimas necesarias contempladas en la Directiva 98/57/CE del Consejo, de 20 de julio de 1998, sobre el control de Ralstonia solanacearum (Smith) Yabuuchi et al. mediante el correspondiente programa de erradicación y control y ello sin perjuicio de que se adopten las medidas adicionales más estrictas que resulten necesarias.
En consecuencia, mediante este Real Decreto, se incorpora al ordenamiento interno la Directiva 98/57/CE, del Consejo, de 20 de julio, de acuerdo con las competencias atribuidas al Estado con carácter exclusivo por el artículo 149.1.13.a de la Constitución Española en materia de bases y coordinación de la planificación general de la actividad económica.
En la elaboración de la presente disposición han sido consultadas las Comunidades Autónomas y los sectores afectados.
En su virtud, a propuesta del Ministro de Agricultura, Pesca y Alimentación, previo informe del Ministro de Administraciones Públicas, de acuerdo con el Consejo de Estado, y previa deliberación en el Consejo de Ministros del día 22 de octubre de 1999,
DISPONGO:
[Bloque 3: #a1]
La presente disposición establece el programa de erradicación y control del organismo Ralstonia solanacearum (Smith) Yabuuchi et al., anteriormente denominado Pseudomonas solanacearum (Smith) Smith (denominado en lo sucesivo «del organismo») de acuerdo con el artículo 12 del Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional, con el fin de que, en lo que respecta a las plantas huésped del organismo indicadas en la sección I del anexo I del presente Real Decreto (denominadas en lo sucesivo «del material vegetal indicado»), se adopten las medidas necesarias para:
a) localizar el organismo y determinar su distribución;
b) impedir su aparición y propagación; y
c) en caso de que aparezca, evitar su propagación y controlarlo con vistas a su erradicación.
2. Se declaran de utilidad pública las medidas contempladas en el presente Real Decreto, de conformidad con lo establecido en el Real Decreto 1190/1998.
[Bloque 4: #a2]
1. El programa que se aprueba y las medidas de él dimanantes serán de aplicación en todo el territorio nacional.
2. En tanto la Comisión de las Comunidades Europeas no se pronuncie al respecto, la duración del programa se prevé ilimitada. En todo momento y como consecuencia de la situación de la enfermedad, el Ministerio de Agricultura, Pesca y Alimentación podrá introducir las modificaciones que se consideren necesarias o determinar su conclusión.
[Bloque 5: #a3]
1. Los organismos oficiales responsables de cada Comunidad Autónoma, a los que se hace referencia en el artículo 11.2 b) del Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción y difusión, en el territorio nacional y de la Comunidad Europea, de organismos nocivos para los vegetales o productos vegetales; así como para la exportación y tránsito hacia países terceros y el órgano competente de la Comunidad Autónoma de Canarias, llevarán a cabo anualmente exámenes oficiales sistemáticos para detectar la posible presencia del organismo en el material vegetal indicado originario de su territorio.
Con objeto de determinar otras posibles fuentes de contaminación existentes para el cultivo del material vegetal indicado, los organismos oficiales responsables de cada Comunidad Autónoma llevarán a cabo una evaluación de riesgo y, salvo que no se haya detectado riesgo alguno de propagación durante dicha evaluación, efectuarán, en las zonas productoras de dicho material, exámenes oficiales orientados específicamente a la detección del organismo en plantas distintas de ese material, incluidas las solanáceas silvestres huésped, así como en las aguas de superficie que se utilicen para regar tal material y en los residuos líquidos vertidos por las instalaciones industriales de transformación o de embalaje en las que se manipule el material indicado y que se utilicen para regar el material vegetal indicado. La extensión de estos exámenes orientados se determinará en función del riesgo observado.
Los organismos oficiales responsables de cada Comunidad Autónoma podrán realizar también exámenes oficiales destinados a la detección del organismo en otros materiales, como el medio de cultivo, el suelo y los residuos sólidos procedentes de las instalaciones industriales de transformación o de embalaje.
2. Los exámenes oficiales previstos en el apartado 1 del artículo 3 se efectuarán:
a) en el caso del material vegetal indicado, de acuerdo con las normas establecidas en el punto 1 de la sección II del anexo I del presente Real Decreto; y,
b) en el caso de las plantas huésped del organismo distintas del material vegetal indicado y en el de las aguas, incluidos los residuos líquidos, aplicando métodos apropiados y, cuando proceda, tomando muestras y sometiéndolas a análisis de laboratorio oficiales o bajo supervisión oficial;
c) cuando resulte apropiado, en el caso de otros materiales, utilizando métodos adecuados.
Para la realización de esos exámenes, los pormenores de los procedimientos de inspección así como el número, origen y clasificación de las muestras y el calendario de su recogida serán decididos por los organismos oficiales responsables de cada Comunidad Autónoma basándose en principios científicos y estadísticos sólidos y en la biología del organismo y teniendo en cuenta, según la región de que se trate, los sistemas concretos que se utilicen para la producción del material vegetal indicado y, en su caso, de otras plantas huésped del organismo.
3. Los detalles y resultados de los exámenes oficiales previstos en el apartado 1 del artículo 3 serán notificados al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión Europea cada año, siguiendo, a tal efecto, las disposiciones del punto 2 de la sección II del anexo I del presente Real Decreto. Estas notificaciones se presentarán, a más tardar, el 15 de mayo, salvo en el caso de las patatas utilizadas para siembra en la propia explotación, que se presentarán, a más tardar, el 15 de agosto. Los detalles y resultados relativos a los cultivos se referirán a la producción del año anterior.
[Bloque 6: #a4]
Los productores, los almacenes colectivos y los centros de expedición de los materiales contemplados en la sección I del anexo I del presente Real Decreto deberán notificar inmediatamente a los organismos oficiales responsables de cada Comunidad Autónoma, en las que estén situadas sus parcelas o establecimientos, la aparición sospechosa o la presencia confirmadas del organismo en el material que produzca o comercialice.
[Bloque 7: #a5]
1. En todos los casos de sospecha de brote, los organismos oficiales responsables de cada Comunidad Autónoma afectada velarán por la realización de análisis de laboratorio oficiales o bajo supervisión oficial en los que se aplique, para el material vegetal indicado, el método pertinente establecido en el anexo II y en las condiciones determinadas en el punto 1 del anexo III del presente Real Decreto o, en todos los demás casos, cualquier otro método aprobado oficialmente que permita confirmar o despejar la sospecha en cuestión. En caso de confirmación, serán de aplicación los requisitos dispuestos en el punto 2 del anexo III del presente Real Decreto.
2. En espera de la confirmación o disipación de la sospecha a la que se refiere el apartado 1 del artículo 5, en todos los casos en que:
i) se hayan observado síntomas de las enfermedades causadas por el organismo y se hayan obtenido resultados positivos en la prueba o pruebas de detección rápida que se contemplan en el punto 1 de la sección I y en el punto 1 de la sección II del anexo II del presente Real Decreto; o ii) se haya obtenido un resultado positivo en la prueba o pruebas de detección contempladas en el punto 2 de la sección I y en la sección III del anexo II del presente Real Decreto,
Los organismos oficiales responsables de cada Comunidad Autónoma, en lo que respecta a la producción propia:
a) prohibirán la circulación de las plantas y tubérculos de todos los cultivos, lotes o partidas de los que se hayan tomado las muestras, salvo que tal circulación tenga lugar bajo su control y siempre que se haya comprobado que no existe ningún riesgo identificable de propagación del organismo;
b) tomarán las medidas necesarias para descubrir el origen del presunto brote;
c) establecerán, en lo que respecta especialmente a la producción del material vegetal indicado y al movimiento de lotes de patata de siembra distintos de los mencionados en la letra a), producidos en el lugar de producción del que se hayan obtenido las muestras mencionadas en la letra a), medidas preventivas complementarias que, basándose en el nivel de riesgo estimado, sean adecuadas para prevenir toda propagación del organismo.
3. En los casos de sospecha de brote en que exista un riesgo de contaminación del material vegetal indicado o de las aguas de superficie que procedan o se dirijan a otra u otras Comunidades Autónomas o, en su caso, a otro Estado miembro, la Comunidad Autónoma en la que se haya observado el presunto brote informará inmediatamente al Ministerio de Agricultura, Pesca y Alimentación de los detalles de dicho brote y del nivel de riesgo identificado para que éste a su vez, a través del cauce correspondiente, informe a las Comunidades Autónomas o a los Estados miembros afectados, y dichas Comunidades Autónomas cooperarán en consecuencia. Las Comunidades Autónomas a las que así se informe aplicarán medidas preventivas acordes con lo dispuesto en la letra c) del apartado 2 del artículo 5 y tomarán cualquier otra medida que resulte adecuada de conformidad con lo dispuesto en los apartados 1 y 2 del mismo.
[Bloque 8: #a6]
1. Si la presencia del organismo en una muestra, tomada en cumplimiento del presente Real Decreto, fuere confirmada por análisis de laboratorios oficiales o bajo supervisión oficial en los que se utilice, para el material vegetal indicado, el método establecido en el anexo II del presente Real Decreto o, para todos los demás casos, cualquier otro método oficialmente aprobado, los organismos oficiales responsables de cada Comunidad Autónoma, basándose a tal efecto en principios científicos sólidos, en la biología del organismo y en los sistemas concretos de producción, comercialización y transformación que se utilicen en su territorio para las plantas huésped del organismo, adoptarán las siguientes medidas:
a) en el caso del material vegetal indicado:
i) emprenderán una investigación para determinar el alcance y la fuente o fuentes primarias de la contaminación, con arreglo a las disposiciones del anexo IV del presente Real Decreto y efectuando nuevos análisis, de conformidad con el apartado 1 del artículo 4, como mínimo, en todas las existencias de patata de siembra relacionadas clónicamente;
ii) declararán contaminados el material vegetal indicado, la partida o el lote de los que se haya tomado la muestra, así como la maquinaria, vehículo, nave, almacén, o unidades de éste, y cualesquiera otros objetos, incluido el material de embalaje, que hayan estado en contacto con el material vegetal indicado al que pertenezca la muestra tomada; asimismo, declararán contaminados, en su caso, el campo o campos, la unidad o unidades de producción de cultivos protegidos y el lugar o lugares de producción en los que se haya cosechado el material vegetal indicado y de los que proceda la muestra; además, en el caso de las muestras tomadas durante la fase de cultivo, declararán contaminados el campo o campos, el lugar o lugares de producción y, si procediere, la unidad o unidades de producción de cultivos protegidos de los que se haya tomado la muestra;
iii) determinarán, con arreglo a las disposiciones del punto 1 del anexo V del presente Real Decreto, el alcance de la contaminación que probablemente se haya producido por contactos anteriores o posteriores a la cosecha, por nexos en la producción, riego o por relaciones clonales con la contaminación declarada; y
iv) delimitarán una zona en función de tres factores: la declaración de contaminación contemplada en el inciso ii) anterior, el alcance de la contaminación probable que se determine en el marco del inciso iii) anterior y la posible propagación del organismo, con arreglo a las disposiciones del inciso i) del punto 2 del anexo V del presente Real Decreto.
b) en el caso de los cultivos de plantas huésped distintas del material mencionado en la letra a) en los que se haya identificado un riesgo para la producción del material vegetal indicado:
i) emprenderán una investigación de acuerdo con lo dispuesto en el inciso i) de la letra a);
ii) declararán contaminadas las plantas huésped del organismo de las que se haya tomado la muestra; y iii) con respecto a la producción del material vegetal indicado, determinarán el alcance de la contaminación probable y delimitarán una zona de conformidad con los incisos iii) y iv) de la letra a), respectivamente.
c) en el caso de las aguas de superficie (incluidos los vertidos de residuos líquidos procedentes de instalaciones industriales de transformación o envasado en las que se manipule el material vegetal indicado) y en el de las solanáceas silvestres huésped del organismo asociadas en las que, por causa del riego, aspersión o inundación con dichas aguas, se haya identificado un riesgo para la producción del material vegetal indicado:
i) emprenderán una investigación para determinar el alcance de la contaminación, realizando en los momentos oportunos, un examen oficial de muestras de las aguas de superficie y, en su caso, de las solanáceas silvestres huésped del organismo;
ii) procederán, en la medida que sea pertinente y sobre la base de la investigación mencionada en el inciso i), a declarar contaminadas las aguas de superficie de las que se hayan tomado la muestra o muestras; y,
iii) determinarán el alcance de la contaminación probable y delimitarán una zona en función de la declaración de contaminación contemplada en el inciso ii) anterior y de la posible propagación del organismo, teniendo en cuenta las disposiciones del punto 1 y del inciso ii) del punto 2 del anexo V del presente Real Decreto.
2. De conformidad con las disposiciones de los puntos 3 y 4 del anexo V del presente Real Decreto, las Comunidades Autónomas notificarán inmediatamente al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los otros Estados miembros y a la Comisión Europea, cualquier caso de contaminación declarada en virtud del inciso ii) de la letra a) y del inciso ii) de la letra c) del apartado 1 del artículo 6, así como los datos relativos a la zona que se haya delimitado con arreglo al inciso iv) de la letra a) del apartado 1 del artículo 6 y, en su caso, al inciso iii) de la letra c) de ese mismo apartado.
3. Como resultado de la notificación dispuesta en el apartado 2 y de los datos en ella contenidos, las Comunidades Autónomas afectadas emprenderán una investigación de acuerdo con el inciso i) de la letra a) del apartado 1 del artículo 6 y, en su caso, con el inciso i) de la letra c) del mismo apartado, y tomarán las medidas complementarias que sean adecuadas de conformidad con los apartados 1 y 2 del artículo 6.
4. Se crea en el Ministerio de Agricultura, Pesca y Alimentación un registro de las explotaciones, los almacenes colectivos y los centros de explotación afectados.
[Bloque 9: #a7]
1. Se prohíbe la plantación del material vegetal indicado que se haya declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6 y, bajo el control y aprobación de los organismos oficiales responsables de cada Comunidad Autónoma, dicho material será sometido a una de las disposiciones del punto 1 del anexo VI del presente Real Decreto con el fin de que pueda establecerse que no existe ningún riesgo identificable de propagación del organismo.
2. Se prohíbe la plantación del material vegetal indicado que, en virtud del inciso iii) de la letra a) y del inciso iii) de la letra c) del apartado 1 del artículo 6, se haya considerado probablemente contaminado, incluido el material vegetal indicado respecto del que se haya detectado la existencia de algún riesgo, producido en lugares de producción que con arreglo al inciso iii) de la letra a) del apartado 1 del artículo 6 se hayan considerado probablemente contaminados, y, bajo el control de los organismos oficiales responsables de cada Comunidad Autónoma, dicho material se destinará a un uso adecuado o se eliminará de acuerdo con el punto 2 del anexo VI del presente Real Decreto a fin de que pueda establecerse que no existe ningún riesgo identificable de propagación del organismo.
3. Toda maquinaria, vehículo, nave, almacén o unidades de éstos y cualesquiera otros objetos, incluido el material de embalaje, que se hayan declarado contaminados en virtud del inciso ii) de la letra a) y del inciso iii) de la letra c) del apartado 1 del artículo 6 o que se hayan considerado probablemente contaminados en virtud del inciso iii) de la letra a) del apartado 1 del mismo artículo será destruido o descontaminado, aplicando métodos apropiados, de conformidad con el punto 3 del anexo VI del presente Real Decreto. Tras su descontaminación, todos estos objetos dejarán de considerarse contaminados.
4. Sin perjuicio de las medidas que se ejecuten en virtud de los apartados 1, 2 y 3 del artículo 7, en la zona delimitada con arreglo a los incisos iv) de la letra a) y iii) de la letra c) del apartado 1 del artículo 6 se aplicarán una serie de medidas acordes con lo dispuesto en los puntos 4.1 y 4.2 del anexo VI del presente Real Decreto. Cada año se notificarán detalles de estas medidas al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión Europea.
5. Las medidas fitosanitarias ordenadas por los organismos oficiales responsables de cada Comunidad Autónoma contempladas en los apartados 1, 2, 3 y 4 del artículo 7 serán realizadas, bajo control oficial, por el propietario del material afectado.
En el caso de que los afectados no ejecuten a su debido tiempo y forma las medidas a que se refiere el párrafo anterior, la Comunidad Autónoma procederá a ejecutarlas, con sus propios medios o empleando servicios ajenos, cargando los gastos correspondientes a los interesados, cuyo importe podrá exigírseles por vía de apremio, con independencia de las sanciones a que hubiere lugar.
[Bloque 10: #a8]
1. Las patatas de siembra deberán reunir los requisitos del Real Decreto 2071/1993 y proceder, en línea directa, de patatas que, habiéndose obtenido en el marco de un programa oficialmente aprobado, hayan dado resultados negativos en cuanto a la presencia del organismo en análisis oficiales u oficialmente supervisados en los que se haya utilizado el método pertinente establecido en el anexo II del presente Real Decreto.
2. Dichos análisis serán efectuados:
a) en los casos en que se haya confirmado la presencia del organismo en la producción propia de patatas de siembra,
i) analizando el material propagado anteriormente, incluida la selección clonal inicial y analizando sistemáticamente los clones de patatas de siembra de base, o ii) en los casos en que se haya demostrado que no hay relación clonal, analizando todos los clones de patatas de siembra de base o el material propagado anteriormente, incluida la selección clonal inicial, y
b) en los demás casos, analizando en cada una de las plantas de la selección clonal inicial o muestras representativas de las patatas de siembra de base o del material propagado anteriormente.
[Bloque 11: #a9]
Se prohíbe la conservación y manipulación del organismo a que se refiere el presente Real Decreto.
[Bloque 12: #a1-2]
Sin perjuicio de las disposiciones del Real Decreto, 2071/1993, se podrán autorizar excepciones a lo dispuesto en los artículos 7 y 9 del presente Real Decreto, de conformidad con las normas establecidas para la realización de pruebas e investigaciones científicas o de estudios en materia de selecciones varietales en el Real Decreto 401/1996, de 1 de marzo, por el que se establecen las condiciones para la introducción en el territorio nacional de determinados organismos nocivos, vegetales, productos vegetales y otros objetos, con fines de ensayo, científicos y para la actividad de selección de variedades y en el Real Decreto 39/1998, de 16 de enero, por el que se modifica el Real Decreto 401/1996, de 1 de marzo, por el que se establecen las condiciones para la introducción en el territorio nacional de determinados organismos nocivos vegetales, productos vegetales y otros objetos, con fines de ensayo, científicos y para la actividad de selección de variedades.
[Bloque 13: #a1-3]
1. Los órganos competentes de las Comunidades Autónomas podrán adoptar las medidas complementarias o más estrictas que sean necesarias para combatir el organismo o impedir su propagación, siempre que tales medidas se ajusten a las disposiciones del Real Decreto 2071/1993.
2. Los detalles de estas medidas deberán ser notificados al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, los notificará, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión.
[Bloque 14: #a1-4]
1. Se aplicará el sistema de indemnizaciones previsto en el artículo 18 del Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional.
2. No son indemnizables los gastos ocasionados ni el material vegetal destruido en aplicación de una medida oficial, cuando el propietario de los vegetales o productos vegetales afectados haya incumplido la normativa vigente y, especialmente, lo determinado en el Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción y difusión en el territorio nacional y de la Comunidad Económica Europea de organismos nocivos para los vegetales o productos vegetales; así como para la exportación y tránsito hacia países terceros.
3. En el caso de que el afectado por la contaminación de un lote suministrado por un productor, almacenista u operador que hubiera incumplido lo determinado en la legislación vigente, percibiera indemnización por parte de cualquiera de estos sujetos, y por parte de la Administración, reembolsará a la Administración la indemnización percibida.
4. El Ministerio de Agricultura, Pesca y Alimentación, dentro de los límites establecidos por los créditos disponibles para estos fines, participará, con cargo a sus presupuestos, en la cuantía del 50 por 100 de los gastos ocasionados en la ejecución del programa.
[Bloque 15: #dt]
En tanto no se pronuncie la Comisión Europea y para garantizar unos niveles de seguridad comparables entre las diferentes Comunidades Autónomas, se podrán adoptar, previo informe favorable del Comité Fitosanitario Nacional:
Los métodos apropiados para los exámenes y análisis previstos en las letras b) y c) del párrafo primero del apartado 2 del artículo 3 y cualquier precisión de los procedimientos previstos en el párrafo segundo del apartado 2 del mismo.
Las medidas complementarias previstas en la letra c) del apartado 2 del artículo 5.
Las normas de desarrollo de la letra a) del apartado 2 del artículo 8 y las disposiciones aplicables a las muestras representativas a las que se refiere la letra b) del mismo apartado y artículo.
El Ministerio de Agricultura, Pesca y Alimentación solicitará su adopción a la Comisión Europea a través del cauce establecido en el artículo 16 bis de la Directiva 77/93/CEE, del Consejo, de 21 de diciembre de 1976, relativa a las medidas de protección contra la introducción en la Comunidad de organismos nocivos para los vegetales o productos vegetales y contra su propagación en el interior de la Comunidad.
[Bloque 16: #da]
Sin perjuicio de las notificaciones estipuladas en los apartados 3 de los artículos 3 y 5, en el apartado 2 del artículo 6 y en el artículo 11 los órganos competentes de las Comunidades Autónomas, comunicarán al Ministerio de Agricultura, Pesca y Alimentación:
a) Los resultados de las investigaciones a que se refiere el apartado 3 del artículo 6 del presente Real Decreto.
b) Los datos del registro de explotaciones, almacenes colectivos y centros de expedición afectados en cada Comunidad Autónoma.
c) Las medidas fitosanitarias realizadas por las Comunidades Autónomas a que se refiere el artículo 7 de este Real Decreto.
d) Los análisis establecidos en el artículo 8 de este Real Decreto, realizados por los órganos competentes de las Comunidades Autónomas.
[Bloque 17: #da-2]
El Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción en el territorio nacional y de la Comunidad Económica Europea de organismos nocivos para los vegetales o productos vegetales y el Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional serán aplicables sin perjuicio de las normas específicas del presente Real Decreto.
[Bloque 18: #da-3]
Lo dispuesto en el presente Real Decreto tendrá carácter de normativa básica, al amparo de lo establecido en el artículo 149.1.13.a de la Constitución, que reserva al Estado la competencia en materia de bases y coordinación de la planificación general de la actividad económica.
[Bloque 19: #df]
Se faculta al Ministro de Agricultura, Pesca y Alimentación para dictar, en el ámbito de sus competencias, las disposiciones necesarias para el desarrollo y aplicación del presente Real Decreto y, en particular, previo informe del Comité Fitosanitario Nacional, las normas provisionales de desarrollo de las letras a) y b) del apartado 2 del artículo 8 y, a la vista de la evolución de los conocimientos científicos o técnicos, las modificaciones que sea preciso introducir en los anexos del presente Real Decreto, en tanto la Comisión Europea no resuelva al respecto.
[Bloque 20: #df-2]
El presente Real Decreto entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
[Bloque 21: #fi]
Dado en Madrid a 22 de octubre de 1999.
JUAN CARLOS R.
El Ministro de Agricultura, Pesca y Alimentación,
JESÚS POSADA MORENO
[Bloque 22: #ai]
SECCIÓN I
Lista de plantas huésped de Ralstonia solanacearum (Smith) Yabuuchi et al.a las que se refiere el artículo 1
Plantas (incluidos los tubérculos), salvo las semillas verdaderas, de Solanum tuberosum L.: Patata.
Plantas, salvo las semillas y los frutos, de Lycopersicum lycopersicum (L.) Karsten ex Farw.: Tomate.
SECCIÓN II
Exámenes
1. Los exámenes oficiales contemplados en la letra a) del apartado 2 del artículo 3 se basarán en la biología del organismo, así como en los sistemas de producción concretos que se utilicen en la Comunidad Autónoma de que se trate, e incluirán lo siguiente:
i) en el caso de las patatas:
en los momentos oportunos, una inspección visual del cultivo en crecimiento, y/o muestras de patatas de siembra y de otras patatas durante la fase de crecimiento o almacenadas; estas muestras se someterán a una inspección visual oficial o bajo supervisión oficial, para lo cual se procederá a seccionar los tubérculos, y
en el caso de las patatas de siembra y, si procede, de otras patatas, análisis de laboratorio oficiales o bajo supervisión oficial en los que se utilice el método establecido en el anexo II del presente Real Decreto;
ii) en el caso de los tomates:
en los momentos oportunos, una inspección visual de, al menos, el cultivo en crecimiento de plantas destinadas a la replantación para utilización profesional.
2. La notificación de los exámenes oficiales dispuesta en el apartado 3 del artículo 3 incluirá los datos siguientes:
i) en el caso de los exámenes de patatas:
la superficie total estimada, en hectáreas, de los cultivos de patatas de siembra y de otras patatas,
la clasificación por categorías (de siembra y de consumo) y, en su caso, por regiones,
la cantidad de muestras tomadas para los análisis y el momento de su recogida,
el número de inspecciones visuales efectuadas en el campo,
el número de inspecciones visuales realizadas en tubérculos (y la cantidad de muestras);
ii) en el caso de los exámenes de, al menos, el cultivo en crecimiento de plantas de tomate destinadas a la replantación para utilización profesional:
la cantidad total estimada de plantas,
el número de inspecciones visuales;
iii) en el caso de los exámenes de plantas huésped del organismo distintas de la patata y el tomate, incluidas las solanáceas silvestres huésped:
la especie,
la cantidad de muestras tomadas y el momento de su recogida,
la zona o río objeto del muestreo, según proceda, el método de análisis;
iv) en el caso de los exámenes de aguas y de los vertidos de residuos líquidos procedentes de las instalaciones industriales de transformación o de embalaje:
la cantidad de muestras tomadas y el momento de su recogida,
la zona, río o ubicación de la instalación objeto del
muestreo, según corresponda, el método de análisis.
[Bloque 23: #ai-2]
ÁMBITO DE APLICACIÓN DEL MÉTODO
El presente método describe los diversos procedimientos relacionados con:
i) el diagnóstico de la podredumbre parda en los tubérculos de patata y de la marchitez bacteriana en las plantas de patata, tomate y otras plantas huésped,
ii) la detección de Ralstonia solanacearum (R. solanacearum) en muestras de tubérculos de patata, plantas de patata, tomate y otras plantas huésped, agua y suelo,
iii) la identificación de R. solanacearum.
PRINCIPIOS GENERALES
En los apéndices se presentan protocolos optimizados para los diferentes métodos y reactivos validados, así como información detallada para la preparación de materiales de prueba y control. En el apéndice 1 se presenta una lista de los laboratorios que se incluyeron en la optimización y validación de los protocolos.
Habida cuenta de que los protocolos implican la detección de un organismo de cuarentena y de que incluirán la utilización de cultivos viables de R. solanacearum como materiales de control, será preciso llevar a cabo los procedimientos bajo condiciones de cuarentena apropiadas, con instalaciones adecuadas de eliminación de residuos y en aplicación de las condiciones de obtención de los permisos apropiados emitidos por las autoridades oficiales de cuarentena de las plantas.
Los parámetros de las pruebas deben garantizar una detección coherente y reproducible de niveles de R. solanacearum en los límites establecidos en los métodos seleccionados.
Es imprescindible una preparación precisa de los controles positivos.
Asimismo, la realización de pruebas con arreglo a los niveles requeridos implica la utilización de los parámetros correctos, el mantenimiento y el calibrado del equipo, una preservación y manipulación cuidadosa de los reactivos y todas las medidas para evitar la contaminación entre las muestras, como por ejemplo la separación de los controles positivos de las muestras de ensayo. Deben aplicarse normas de control de la calidad para evitar errores administrativos y de otro tipo, especialmente de etiquetado y documentación.
Una sospecha de brote, tal como se menciona en el artículo 5, apartado 2, de este real decreto, implica la obtención de un resultado positivo de las pruebas de diagnóstico o selección efectuadas a una muestra tal como se especifica en los siguientes diagramas de flujo. Un resultado positivo en la primera prueba de selección (prueba IF, PCR/FISH, aislamiento selectivo) debe confirmarse con una segunda prueba de selección basada en un principio biológico diferente.
Si la primera prueba de selección proporciona un resultado positivo, se sospecha entonces la contaminación con R. solanacearum y debe efectuarse una segunda prueba de selección. Si la segunda prueba de selección proporciona un resultado positivo, se confirma entonces la sospecha (sospecha de presencia) y debe continuar la prueba con arreglo al método. Si la segunda prueba de selección proporciona un resultado negativo, se considera entonces que la muestra no está contaminada con R. solanacearum.
Una presencia confirmada, tal como se menciona en el artículo 6, apartado 1, de este real decreto, implica el aislamiento y la identificación de un cultivo puro de R. solanacearum con confirmación de patogenicidad.
SECCIÓN I
APLICACIÓN DEL MÉTODO
1. Método de detección para el diagnóstico de la podredumbre parda y la marchitez bacteriana (R. solanacearum) en tubérculos de patata y plantas de patata, tomate u otras plantas huésped con síntomas de podredumbre parda o marchitez bacteriana
El procedimiento de análisis está destinado a los tubérculos de patata y a las plantas que presentan síntomas típicos de la podredumbre parda o la marchitez vascular o que permiten la sospecha de su presencia. Incluye una prueba de selección rápida, el aislamiento del patógeno del tejido vascular infectado en un medio (selectivo) y, en caso de resultado positivo, la identificación del cultivo como R. solanacearum.

(1) Para la descripción de los síntomas véase la sección II.1.
(2) Las pruebas de diagnóstico rápido facilitan el diagnóstico de presunción, pero no son esenciales. Un resultado negativo no garantiza en todos los casos la inexistencia del patógeno.
(3) En la sección VI.A.1 se describe la prueba de la exudación para el líquido bacteriano del tejido vascular del tallo.
(4) En la sección VI.A.2 se describe la prueba de detección de gránulos de poli-β-hidroxibutirato en células bacterianas.
(5) En la sección VI.A.3 se describen las pruebas de aglutinación serológíca en líquido bacteriano o extractos de tejido sintomático.
(6) En la sección VI.A.5 se describe la prueba IF en líquido bacteriano suspendido en agua o extractos de tejido sintomático.
(7) En la sección VI.A.7 se describe la prueba FISH en líquido bacteriano suspendido en agua o extractos de tejido sintomático.
(8) En la sección VI.A.8 se describe la prueba ELISA en líquido bacteriano suspendido en agua o extractos de tejido sintomático.
(9) En la sección VI.A.6 se describe la prueba PCR en líquido bacteriano suspendido en agua o extractos de tejido sintomático.
(10) El patógeno suele aislarse con facilidad del material vegetal sintomático mediante dilución en placas (sección II.3).
(11) La morfología típica de la colonia se describe en la sección II.3.d.
(12) El aislamiento puede fallar en estados avanzados de infección debido a la competencia o el enmascaramiento por bacterias saprofitas. Sí los síntomas de la enfermedad son los típicos, pero el aislamiento es negativo, deberá repetirse el aislamiento, preferentemente valiéndose de una siembra en medio selectivo.
(13) La identificación fiable de cultivos puros posibles aislados de R. solanacearum, se efectúa utilizando las pruebas descritas en la sección VI.B. La caracterización subespecífíca de las cepas es optativa, pero se recomienda en cada caso nuevo.
(14) La prueba de patogenicidad se describe en la sección VI.C.
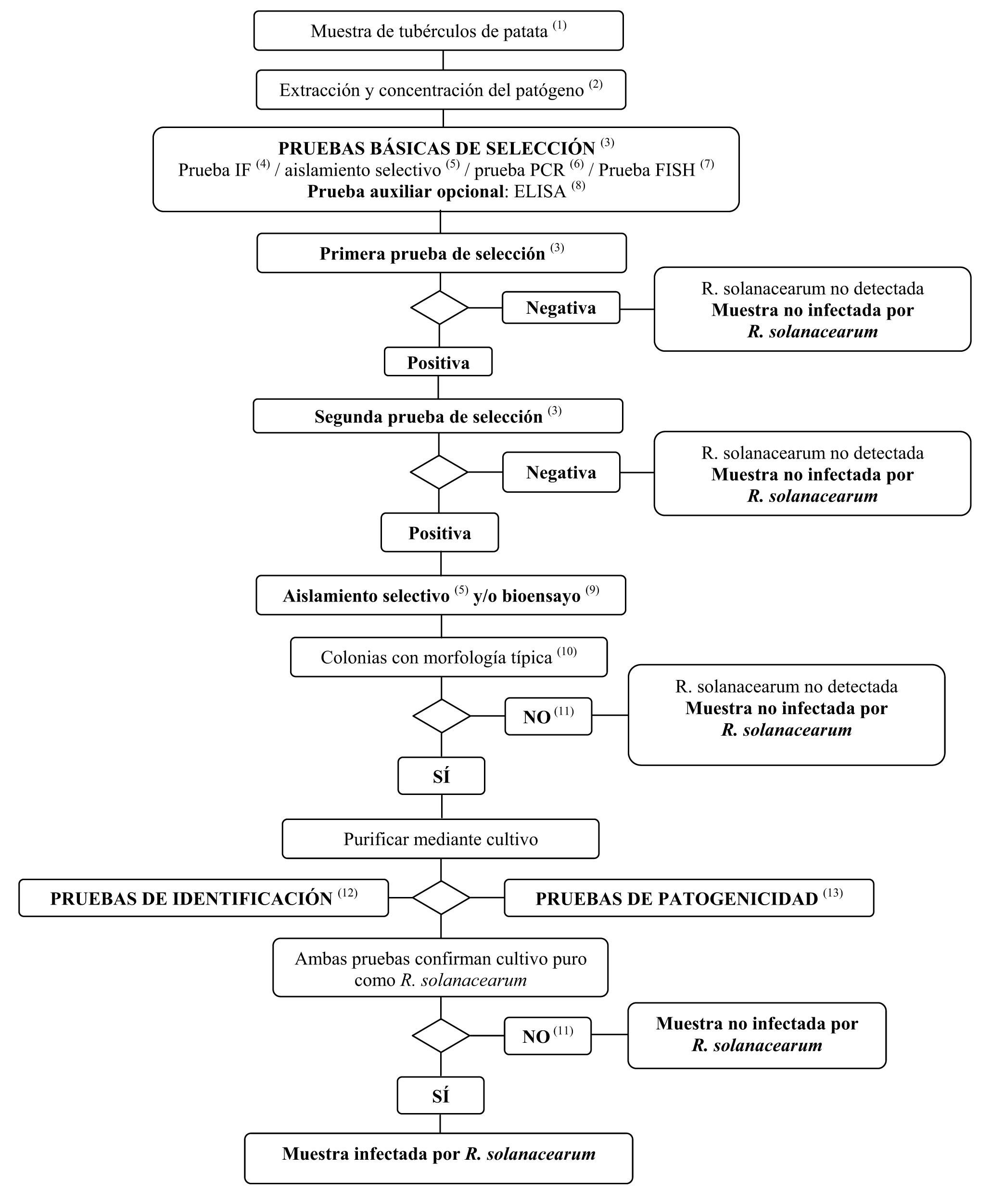
2. Método de detección e identificación de R. solanacearum en muestras asintomáticas de tubérculos de patata
Fundamento
El protocolo de análisis tiene por objeto la detección de infecciones latentes en tubérculos de patata. Un resultado positivo de un mínimo de dos pruebas de selección, basadas en diferentes principios biológicos, debe complementarse con el aislamiento del patógeno, seguido, en caso de aislamiento de colonias típicas, por la confirmación de un cultivo puro como R. solanacearum. Un resultado positivo de solamente una de las pruebas de selección no es suficiente para considerar sospechosa la muestra.
Las pruebas de selección y las pruebas de aislamiento deben permitir la detección de 103 a 104 células/ml de precipitado resuspendido, incluidas como controles positivos en cada serie de pruebas.
(1) El tamaño normal de la muestra es de 200 tubérculos, aunque eL procedimiento puede utilizarse con muestras más pequeñas si no se dispone de 200 tubérculos.
(2) En la sección III.1.1 se describen los métodos de extracción y concentración de patógenos.
(3) Si un mínimo de dos pruebas basadas en diferentes principios biológicos proporcionan resultados positivos, debe efectuarse el aislamiento y la confirmación. Efectúese como mínimo una prueba de selección. Cuando esta prueba dé resultados negativos, se considerará que la muestra es negativa. En caso de que la prueba dé resultados positivos, deberá efectuarse una segunda prueba de selección, o varias más, basadas en diferentes principios biológicos, con el fin de verificar el primer resultado positivo. Si la segunda prueba o las pruebas siguientes proporcionan resultados negativos, la muestra se considerará negativa. No será preciso efectuar otras pruebas.
(4) En la sección VI.A.5 se describe la prueba IF.
(5) En la sección VI.A.4 se describe la prueba de aislamiento selectivo.
(6) En la sección VI.A. 6 se describen las pruebas PCR.
(7) En la sección VI.A.7 se describe la prueba FISH.
(8) En la sección VI.A.8 se describen las pruebas ELISA.
(9) En la sección VI.A.9 se describe la prueba del bioensayo.
(10) La morfología típica de la colonia se describe en la sección II. 3. d.
(11) El aislamiento o los bioensayos pueden fallar debido a la competencia o la inhibición por bacterias saprofitas. Si se obtienen resultados positivos claros en las pruebas de selección, pero las pruebas de aislamiento dan resultados negativos, entonces deben repetirse las pruebas de aislamiento a partir del mismo precipitado o tomando más tejido vascular cerca de la parte basal de tubérculos cortados de la misma muestra y, en caso necesario, analizar otras muestras,
(12) La identificación fiable de cultivos puros aislados posibles de R. solanacearum, se efectúa utilizando las pruebas descritas en la sección VI.B.
(13) La prueba de patogenicidad se describe en la sección VI.C.
3. Método de detección e identificación de R. solanacearum en muestras asintomáticas de patatas, tomates y otras plantas huésped
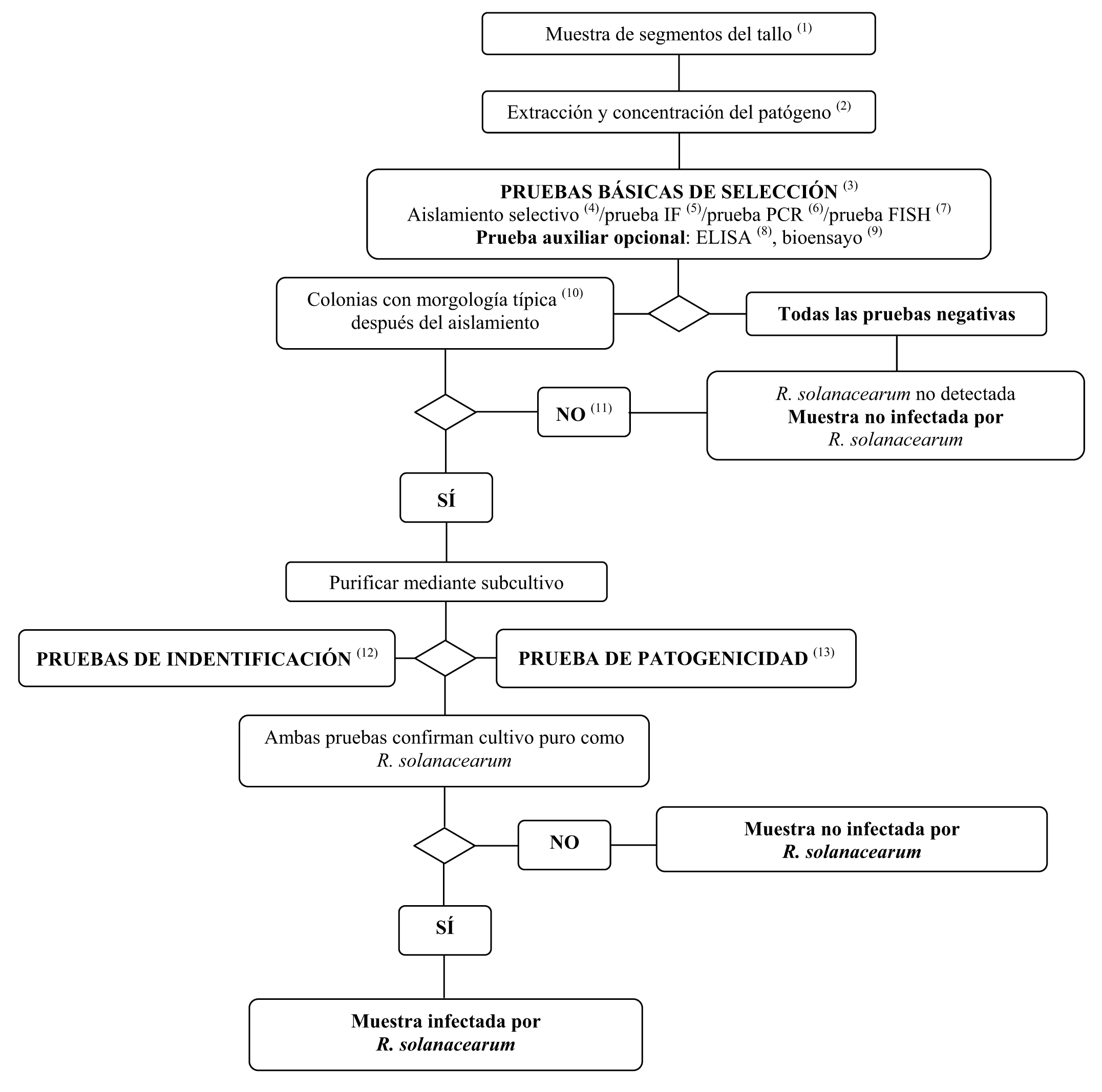
(1) Véase la sección III.2.1 para los tamaños recomendados de las muestras.
(2) En la sección III.2.1 se describen los métodos de extracción y concentración de patógenos.
(3) Si un mínimo de dos pruebas basadas en diferentes principios biológicos proporcionan resultados positivos, debe efectuarse el aislamiento y la confirmación. Efectúese como mínimo una prueba de selección. Cuando esta prueba dé resultados negativos, se considerará que la muestra es negativa. En caso de que la prueba dé resultados positivos, deberá efectuarse una segunda prueba de selección, o varias más, basadas en diferentes principios biológicos, con el fin de verificar el primer resultado positivo, Si la segunda prueba o las pruebas siguientes proporcionan resultados negativos, la muestra se considerará negativa. No será preciso efectuar otras pruebas.
(4) En la sección VI.A.4 se describe la prueba de aislamiento selectivo.
(5) En la sección VI.A.5 se describe la prueba IF.
(6) En la sección VI.A.6 se describen las pruebas PCR.
(7) En la sección VI.A.7 se describe la prueba FISH.
(8) En la sección VI.A.8 se describen las pruebas ELISA.
(9) En la sección VI.A.9 se describe la prueba del bioensayo.
(10) La morfología típica de la colonia se describe en la sección II.3.d.
(11) El aislamiento o los bioensayos pueden fallar debido a la competencia o la inhibición por bacterias saprofitas. Si se obtienen resultados positivos en las pruebas de selección, pero las pruebas de aislamiento dan resultados negativos, entonces deben repetirse las pruebas de aislamiento.
(12) La identificación fiable de cultivos puros posibles aislados de R. solanacearum, se efectúa utilizando las pruebas descritas en la sección VI.B.
(13) La prueba de patogenicidad se describe en la sección VI.C.
SECCIÓN II
MÉTODOS DETALLADOS DE DETECCIÓN DE R. SOLANACEARUM EN TUBÉRCULOS DE PATATA Y PLANTAS DE PATATA, TOMATE U OTRAS PLANTAS HUÉSPED CON SÍNTOMAS DE LA PODREDUMBRE PARDA O LA MARCHITEZ BACTERIANA
1. Síntomas (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main)
1.1 Síntomas en patata:
En planta de patata. La fase inicial de la infección en el campo se reconoce por un marchitamiento de las hojas en progresión ascendente hacia el extremo superior de la planta, bajo el efecto de las temperaturas diurnas altas, con una recuperación durante la noche. En las primeras fases del marchitamiento, las hojas siguen estando verdes, pero posteriormente se desarrolla necrosis parda y amarilleo. También se produce epinastia. El marchitamiento de un brote o de plantas enteras se hace rápidamente irreversible y ocasiona el colapso y la muerte de la planta. El tejido vascular de los tallos de las plantas marchitadas cortados transversalmente suele ser pardo, y de la superficie del corte brota un exudado mucoso bacteriano o este puede extraerse apretando el tallo. Si se coloca verticalmente un tallo cortado en agua, de los haces vasculares salen hilos viscosos.
En tubérculo de patata. Los tubérculos de patata deben cortarse transversalmente cerca de la parte basal (estolón) o bien longitudinalmente sobre el estolón. Posteriormente, la decoloración vascular adquiere un tono pardo más marcado y la necrosis puede extenderse al tejido parenquimático. En las fases avanzadas, la infección progresa desde la parte basal y los ojos, por las que pueden fluir exudados bacterianos, lo que hace que se adhieran partículas del suelo. Pueden aparecer en la piel lesiones ligeramente hundidas de color pardo rojizo debido al colapso interno de los tejidos vasculares. En las fases avanzadas de la enfermedad es habitual el desarrollo secundario de podredumbres blandas causadas por hongos y bacterias.
1.2 Síntomas en tomate
En planta de tomate. El primer síntoma visible es el aspecto flácido de las hojas más jóvenes. Si se producen condiciones medioambientales favorables para el patógeno (temperaturas del suelo de 25°C; humedad saturada), en un plazo de pocos días se produce epinastia y marchitamiento de un lado de la planta o de toda ella, lo que desemboca en un colapso total de la planta. En condiciones menos favorables (temperatura del suelo por debajo de 21°C), se produce un menor marchitamiento, pero pueden surgir numerosas raíces adventicias del tallo. En ocasiones se observan estrías húmedas desde la base del tallo, lo que demuestra la existencia de necrosis en el sistema vascular.
Al cortar transversalmente el tallo, los tejidos vasculares que presentan una decoloración parda exudan gotas de líquido bacteriano blanco o amarillento.
1.3 Sintomas en otros huéspedes
Plantas de Solanum dulcamara y S. nigrum. En condiciones naturales, en pocos casos se observan síntomas de marchitamiento en estos huéspedes herbáceos a no ser que la temperatura del suelo supere los 25°C o los niveles de inóculo sean extremadamente elevados (por ejemplo, para S. nigrum que crezca junto a plantas enfermas de patatas o tomates). Cuando se produce el marchitamiento, los síntomas son como los descritos para el tomate. Las plantas de S. dulcamara, que no se marchitan y que crecen con tallos y raíces en el agua, pueden mostrar una decoloración interna pardo claro de los tejidos vasculares en una sección transversal de la base del tallo, o de las partes del tallo que se encuentran bajo el agua. Pueden fluir bacterias de los tejidos vasculares cortados, o formar hilos viscosos, si el tallo cortado se coloca verticalmente en el agua, incluido en caso de inexistencia de síntomas de marchitamiento.
2. Pruebas de selección rápida
Las pruebas de selección rápida facilitan el diagnóstico de presunción, pero no son esenciales. Realícese una o más de las siguientes pruebas validadas:
2.1 Prueba de la exudación del tallo (Véase la sección VI.A.1.)
2.2 Prueba de la detección de gránulos de poli-βhidroxibutirato (PHB)
Los gránulos de PHB característicos en las células de R. solanacearum se visualizan tiñendo frotis de exudado bacteriano fijado con calor procedente de tejido infectado en un portaobjetos con azul Nilo A o negro Sudán B (véase la sección VI.A.2).
2.3 Pruebas de aglutinación serológica (Véase la sección VI.A.3.)
2.4 Otras pruebas
Otras pruebas de selección rápida apropiadas incluyen la prueba IF (véase la sección VI.A.5), la prueba FISH (véase la sección VI.A.7), las pruebas ELISA (véase la sección VI.A.8) y las pruebas PCR (véase la sección VI.A.6).
3. Proceso de aislamiento
a) Coger exudado o secciones de tejido decolorado del anillo vascular del tubérculo o de los haces vasculares del tallo de la planta de patata, de tomate o de otras plantas huésped en proceso de marchitamiento. Poner en suspensión en un volumen reducido de agua destilada estéril o en tampón fosfato 50 mM (apéndice 4) y dejar entre cinco y diez minutos.
b) Preparar una serie de diluciones decimales de la suspensión.
c) Echar 50-100 µl de la suspensión y las diluciones en un medio nutritivo general (NA, YPGA o SPA; véase el apéndice 2) y/o en un medio de tetrazolio de Kelman (apéndice 2) y/o un medio selectivo validado (por ejemplo, SMSA; véase el apéndice 2). Extender o hacer estrías con una técnica adecuada de dilución en placas. Si se considera útil, preparar un conjunto de placas distintas con un cultivo de una suspensión celular diluida de R. solanacearum biovar 2 como control positivo.
d) Incubar las placas entre dos y seis días a 28°C.
– En un medio nutritivo general, los aislados virulentos de R. solanacearum desarrollan colonias de color blanco nacarado, planas, irregulares y fluidas, que con frecuencia presentan los verticilos característicos en el centro. Las formas avirulentas de R. solanacearum forman colonias butirosas pequeñas, redondas y no fluidas, que son completamente blancas.
– En los medios de tretrazolio de Kelman y SMSA, los verticilos son de color rojo sangre. Las formas avirulentas de R. solanacearum forman colonias butirosas pequeñas, redondas y no fluidas, que son totalmente de color rojo oscuro.
4. Pruebas de identificación de R. solanacearum
Las pruebas para confirmar la identidad de presuntos aislados de R. solanacearum se muestran en la sección VI.B.
SECCIÓN III
1. Métodos detallados de detección e identificación de R. solanacearum en muestras asintomáticas de tubérculos de patata
1.1 Preparación de la muestra
Nota:
– El tamaño normal de la muestra es de 200 tubérculos. Un muestreo más intensivo requiere más pruebas en muestras de este tamaño. Un mayor número de tubérculos en la muestra producirá inhibición o una interpretación difícil de los resultados. Sin embargo, el procedimiento puede aplicarse convenientemente a muestras de menos de 200 tubérculos, cuando se disponga de pocos tubérculos.
– La validación de todos los métodos de detección descritos a continuación se basa en la realización de pruebas a muestras de 200 tubérculos.
– El extracto de patata descrito a continuación puede utilizarse también para la detección de la bacteria de la necrosis bacteriana de la patata, Clavibacter michiganensis subsp. sepedonicus.
Pretratamiento opcional previo a la preparación de la muestra:
a) incubación de muestras a 25-30°C, hasta un máximo de dos semanas antes de la realización de la prueba, con el fin de alentar la multiplicación de cualquier población de R. solanacearum;
b) lavar los tubérculos. Utilizar desinfectantes apropiados (compuestos de cloro cuando vaya a utilizarse la prueba PCR a fin de eliminar el ADN patógeno) y detergentes entre cada muestra. Secar al aire los tubérculos. Este procedimiento de lavado es especialmente útil (pero no obligatorio) para las muestras con exceso de tierra y si debe realizarse una prueba PCR o un procedimiento de aislamiento directo.
1.1.1 Quitar la epidermis de la parte basal (estolón) del tubérculo con un bisturí o un cuchillo limpio y desinfectado, de modo que los tejidos vasculares queden a la vista. Extraer con cuidado una cuña cónica pequeña de tejido vascular de la parte basal y extraer el mínimo volumen posible de tejido no vascular.
(véase el sitio web: http://forum.europa.eu.int/ Public/irc/sanco/Home/main).
Nota: Retirar los tubérculos (podridos) que presenten síntomas sospechosos de «podredumbre parda» y analizarlos por separado.
Si durante la extracción de la cuña de la parte basal se observan síntomas sospechosos de podredumbre parda, deberá efectuarse una inspección visual del tubérculo, y cortarse este cerca de la parte basal. Todo tubérculo cortado con síntomas sospechosos deberá guardarse durante un mínimo de dos días a temperatura ambiente a fin de permitir la suberización y almacenar refrigerado (a 4-10°C) en condiciones de cuarentena apropiadas. Todos los tubérculos, incluidos los que presenten síntomas sospechosos, deberán mantenerse con arreglo a lo establecido en el anexo III.
1.1.2 Colocar las cuñas de la parte basal en recipientes desechables no utilizados que puedan cerrarse y/o sellarse (en caso de reutilización de los recipientes, deberán limpiarse y desinfectarse por completo utilizando compuestos de cloro). Es conveniente procesar las cuñas inmediatamente. Si esto no es posible, almacenarlas en el recipiente, sin añadir ningún tampón, refrigeradas durante un período máximo de 72 horas o de 24 horas a temperatura ambiente.
Procesar las cuñas por uno de los métodos siguientes:
a) bien cubrir las cuñas con un volumen suficiente (aproximadamente 40 ml) de tampón de extracción (apéndice 4) y agitar en un agitador rotatorio (50-100 rpm) durante cuatro horas por debajo de 24°C o refrigeradas entre 16 y 24 horas,
o bien
b) homogeneizar las cuñas con un volumen suficiente (aproximadamente 40 ml) de tampón de extracción (apéndice 4) en una trituradora (por ejemplo, Waring o Ultra Thurax) o machacándolas en una bolsa de maceración desechable sellada (por ejemplo, Stomacher o Bioreba de politeno de gran calibre, 150 mm × 250 mm; esterilizada por radiación) utilizando un mazo de goma o un aparato de trituración adecuado (por ejemplo, Homex).
Nota: Existe un elevado riesgo de contaminación cruzada de muestras cuando se homogenizan las muestras utilizando una trituradora. Tomar precauciones a fin de evitar la generación de aerosoles o el vertido durante el proceso de extracción. Debe asegurarse que se utilizan para cada muestra recipientes y cuchillas de trituradora esterilizados. Si se utiliza la prueba PCR, evitar la transferencia de ADN en los recipientes o el aparato de trituración. Al utilizar PCR, se recomienda machacar el material en bolsas desechables y utilizar tubos desechables.
1.1.3 Se decanta el sobrenadante. Si es demasiado turbio, clarificarlo con una centrifugación a baja velocidad (no más de 180 g durante diez minutos a una temperatura entre 4-10°C) o mediante filtración al vacío (40-100 µm), lavando el filtro con tampón de extracción adicional (10 ml).
1.1.4 Concentrar las bacterias por centrifugación a 7.000 g durante 15 minutos (o 10.000 g durante diez minutos) a una temperatura entre 4-10°C y descartar el sobrenadante sin perturbar el sedimento.
1.1.5 Resuspender el precipitado en 1,5 ml de tampón de precipitado (apéndice 4). Utilizar 500 µl para pruebas de R. solanacearum, 500 µl para Clavibacter michiganensis subsp. sepedonicus y 500 µl para referencia. Añadir glicerol estéril a la concentración final de 10-25% (v/v) a los 500 µl de la alícuota de referencia y a la restante alícuota de prueba, mezclar y almacenar a una temperatura comprendida entre –16 a –24°C (semanas) o entre –68 a –86°C (meses). Mantener las alícuotas de prueba a entre 4-10°C durante la prueba.
No se aconseja congelar y descongelar repetidamente.
Si debe transportarse el extracto, entréguese en un recipiente frío en un plazo de 24 a 48 horas.
1.1.6 Es de capital importancia tratar por separado todos los controles y muestras positivos de R. solanacearum para evitar la contaminación. Esto se aplica a los portaobjetos IF y a todas las pruebas.
1.2 Análisis
Véase el diagrama de flujo y la descripción de las pruebas y los protocolos optimizados en los apéndices pertinentes:
Aislamiento selectivo (véase la sección VI.A.4)
Prueba IF (véase la sección VI.A.5)
Pruebas PCR (véase la sección VI.A.6)
Prueba FISH (véase la sección VI.A.7)
Pruebas ELISA (véase la sección VI.A.8)
Bioensayo (véase la sección VI.A.9)
2. Métodos detallados de detección e identificación de R. solanacearum en muestras asintomáticas de patatas, tomates y otras plantas huésped
2.1 Preparación de la muestra
Nota: Para la detección de poblaciones latentes de R. solanacearum se aconseja someter a prueba muestras mixtas. El procedimiento puede aplicarse convenientemente a muestras mixtas de hasta 200 partes del tallo. Cuando se efectúen exámenes, deberán basarse en una muestra estadísticamente representativa de la población de plantas investigada.
2.1.1 Colocar segmentos de tallo de 1-2 cm en un recipiente estéril cerrado con arreglo a los siguientes procedimientos de muestreo:
Plántulas de tomate de vivero: con un cuchillo limpio y desinfectado, cortar un segmento de 1 cm de la base de cada tallo, justo por encima del nivel del suelo.
Plantas de tomate cultivadas en el campo o en un invernadero: con un cuchillo limpio y desinfectado, arrancar el brote lateral más inferior de cada planta cortando justo por encima de la unión con el tallo principal. Cortar un segmento de 1 cm del extremo inferior de cada brote lateral.
Otros huéspedes: con un cuchillo limpio y desinfectado o con tijeras de podar, cortar un segmento de 1 cm de la base de cada tallo, justo por encima del nivel del suelo. En el caso de S. dulcamara o de otras plantas huésped que crecen en el agua, cortar secciones de 1-2 cm de los tallos bajo el agua o estolones con raíces acuáticas.
Cuando se muestree un lugar específico, se recomienda analizar una muestra estadísticamente representativa de un mínimo de diez plantas por punto de muestreo de cada huésped herbáceo potencial. La detección del patógeno será más fiable a finales de primavera, en verano y en otoño, aunque las infecciones naturales pueden detectarse durante todo el año en Solanum dulcamara perenne que crece en cursos de agua. Los huéspedes conocidos incluyen plantas de patata espontáneas (groundkeepers), Solanum dulcamara, S. nigrum, Datura stramonium y otros miembros de la familia Solanaceae. Otros huéspedes son Pelargonium spp. y Portulaca oleracea. Entre las especies herbáceas europeas que pueden albergar potencialmente poblaciones de R. solanacearum biovar 2/raza 3 en raíces y/o rizosferas, en condiciones medioambientales específicas, se incluyen: Atriplex hastata, Bidens pilosa, Cerastium glomeratum, Chenopodium album, Eupatorium cannabinum, Galinsoga parviflora, Ranunculus scleratus, Rorippa spp., Rumex spp., Silene alba, S. nutans., Tussilago farfarra y Urtica dioica.
Nota: Puede efectuarse en este momento el examen visual para detectar síntomas internos (coloración vascular o líquido bacteriano). Retirar todos los segmentos del tallo con síntomas y analizarlos por separado (véase la sección II).
2.1.2 Desinfectar brevemente los segmentos del tallo con etanol al 70% y secar inmediatamente con un pañuelo de papel. A continuación, procesar los segmentos del tallo mediante uno de los procedimientos siguientes:
a) cubrir los segmentos con un volumen suficiente (aproximadamente 40 ml) de tampón de extracción (apéndice 4) y agitar en un agitador rotatorio (50-100 rpm) durante cuatro horas por debajo de 24°C o refrigerados entre 16 y 24 horas,
o bien
b) procesar inmediatamente machacando los segmentos en una bolsa de maceración resistente (por ejemplo, Stomacher o Bioreba) con un volumen apropiado de tampón de extracción (apéndice 4) utilizando un mazo de goma o un aparato de trituración adecuado (por ejemplo, Homex). De no ser posible, almacenar los segmentos del tallo refrigerados durante un máximo de 72 horas o un máximo de 24 horas a temperatura ambiente.
2.1.3 Desechar el sobrenadante tras 15 minutos de sedimentación.
2.1.4 No suele ser necesaria otra clarificación del extracto o la concentración de la fracción bacteriana, pero puede conseguirse por filtración y/o centrifugación tal como se describe en la sección III.1.1.3 a 1.1.5.
2.1.5 Dividir el extracto de la muestra pura o concentrada en dos partes iguales. Mantener una mitad entre 4 y 10°C durante el análisis y almacenar la otra mitad con glicerol estéril al 10-25% (v/v) entre –16 y –24°C (semanas) o entre –68 y –86°C (mes) en caso de que deban efectuarse nuevas pruebas.
2.2 Análisis
Véase el diagrama de flujo y la descripción de las pruebas y los protocolos optimizados en los apéndices pertinentes:
Aislamiento selectivo (véase la sección VI.A.4)
Prueba IF (véase la sección VI.A.5)
Pruebas PCR (véase la sección VI.A.6)
Prueba FISH (véase la sección VI.A.7)
Pruebas ELISA (véase la sección VI.A.8)
Bioensayo (véase la sección VI.A.9)
SECCIÓN IV
1. Esquema del método de detección e identificación de R. solanacearum en el agua
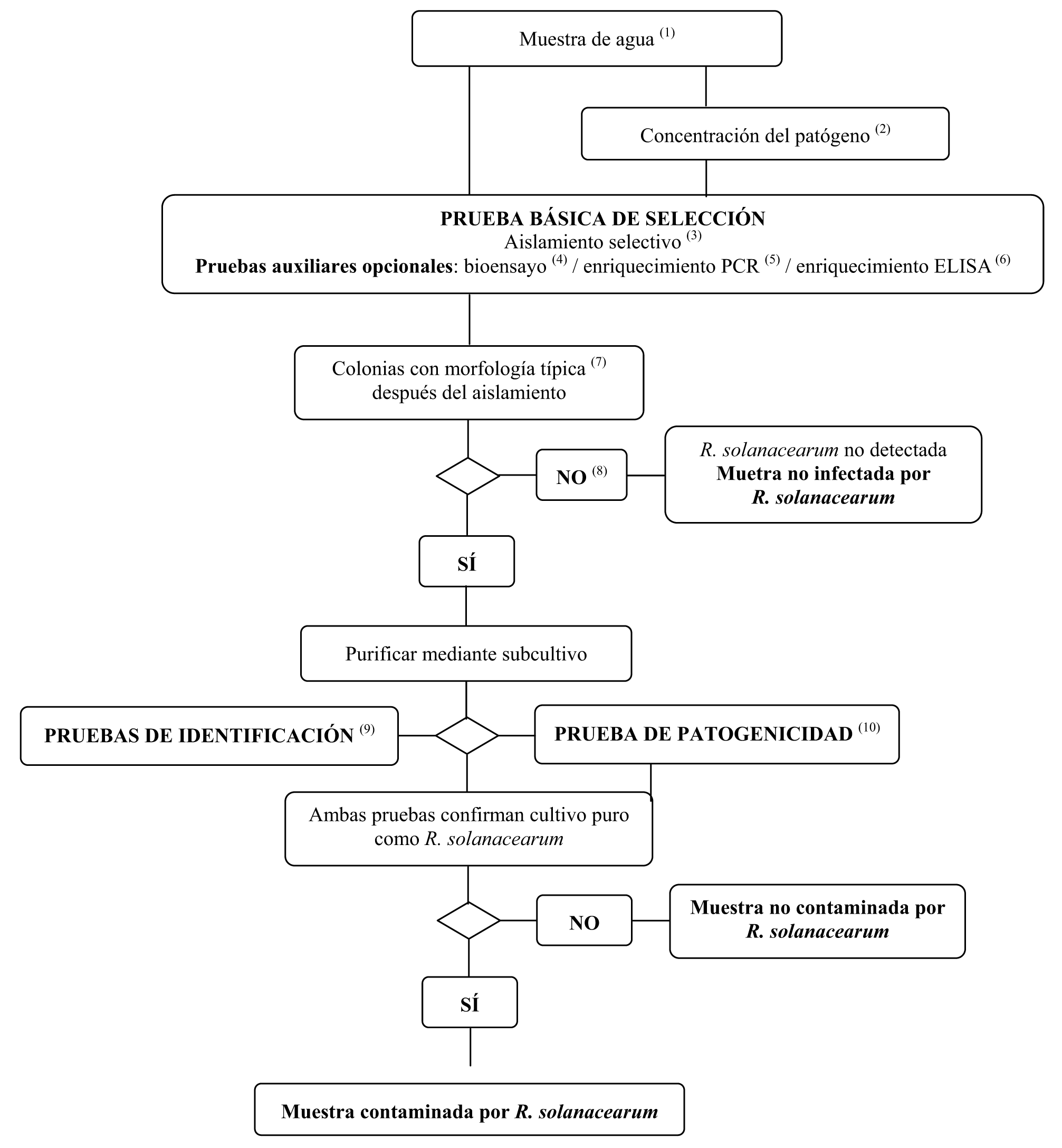
(1) Véase la sección IV.2.1 para los tamaños recomendados de las muestras.
(2) En la sección IV.2.1 se describen los métodos de concentración de patógenos. La concentración incrementa las poblaciones de patógenos y de bacterias saprofitas competidoras, y únicamente se recomienda si no provoca una inhibición de la prueba de aislamiento.
(3) En la sección VI.A.4 se describe la prueba de aislamiento selectivo.
(4) En la sección VI.A.9 se describe la prueba del bioensayo.
(5) En las secciones VI.A.4.2 y Vl.A.6 se describen los métodos de enriquecimiento PCR.
(6) En las secciones VI.A.4.2 y VI.A.8 se describen los métodos de enriquecimiento ELISA.
(7) La morfología típica de la colonia se describe en la sección II.3.d.
(8) El aislamiento puede fallar debido a la competencia o la inhibición por bacterias saprofitas. Si se sospecha que una elevada población saprofita afecta a la fiabilidad del aislamiento, repetir entonces las pruebas de aislamiento tras la dilución de la muestra en agua estéril.
(9) La identificación fiable de cultivos puros posibles aislados de R. solanacearum, se efectúa utilizando las pruebas descritas en la sección VI.B.
(10) La prueba de patogenicidad se describe en la sección VI.C.
2. Métodos de detección e identificación de R. solanacearum en el agua
Principio
El método validado de detección que se describe en la presente sección es aplicable a la detección del patógeno en muestras de aguas superficiales y puede aplicarse asimismo a las muestras para análisis del proceso de transformación de la patata o de aguas residuales. No obstante, es importante señalar que la sensibilidad previsible de la detección variará en función del sustrato. La sensibilidad de la prueba de aislamiento se ve afectada por las poblaciones de bacterias saprofitas competidoras, que son generalmente muy superiores en el proceso de transformación de la patata y las aguas residuales que en las aguas superficiales. Si bien se espera que el método que se describe a continuación solamente detecte 103 células por litro de aguas superficiales, la sensibilidad de la detección en el proceso de transformación de la patata o las aguas residuales será con toda probabilidad mucho menor. Por este motivo, se recomienda analizar las aguas residuales después de todo tratamiento de purificación (por ejemplo, sedimentación o filtración), durante el cual las poblaciones de bacterias saprofitas se reducen. Deberán tenerse en cuenta las limitaciones de sensibilidad del método de prueba a la hora de evaluar la fiabilidad de cualquier resultado negativo obtenido. Si bien se ha utilizado con éxito este método en trabajos de investigación para determinar la presencia o ausencia del patógeno en las aguas superficiales, deberán tenerse en cuenta sus limitaciones cuando se utilice en investigaciones similares del proceso de transformación de la patata o de aguas residuales.
2.1 Preparación de la muestra
Nota:
– La detección de R. solanacearum en las aguas superficiales es más fiable a finales de primavera, en verano y en otoño, cuando la temperatura del agua supera los 15°C.
– Un muestreo repetido en diferentes momentos durante los períodos mencionados en puntos de muestreo designados incrementará la fiabilidad de la detección al reducir los efectos de la variación climática.
– Ténganse en cuenta los efectos de las fuertes precipitaciones y la geografía del curso de agua a fin de evitar que se produzcan importantes efectos de dilución que puedan ocultar la presencia del patógeno.
– Tomar muestras de agua superficial en las inmediaciones de plantas huésped si estos huéspedes están presentes.
2.1.1 Recoger muestras de agua en puntos de muestreo seleccionados llenando botellas o tubos estériles desechables, a una profundidad, si es posible, por debajo de 30 cm y a 2 m de la orilla. Para los efluentes resultantes de la transformación de la patata y las aguas residuales, recoger muestras en el punto de vertido de las aguas residuales. Se recomiendan las muestras de hasta 500 ml por punto de muestreo. Si se prefieren muestras más pequeñas, se aconseja tomar muestras como mínimo en tres ocasiones por punto de muestreo, cada una de las cuales consistirá en dos submuestras duplicadas de un mínimo de 30 ml. Para un trabajo de investigación intensivo, seleccione como mínimo tres puntos de muestreo por 3 km de curso de agua y asegúrese de que también se toman muestras en los afluentes que desembocan en el curso de agua.
2.1.2 Transportar las muestras en un entorno fresco y oscuro (4-10°C) y analizarlas en un plazo de 24 horas.
2.1.3 Si es preciso, podrá concentrarse la fracción bacteriana utilizando uno de los métodos siguientes:
a) centrifugar 30-50 ml de submuestras de 10.000 g durante diez minutos (o 7.000 g durante 15 minutos), preferiblemente a 4-10°C, descartar el sobrenadante y resuspender el precipitado en 1 ml de tampón de precipitado (apéndice 4);
b) filtración por membrana (tamaño mínimo de los poros de 0,45 µm) y a continuación lavado del filtro en 5-10 ml de tampón de precipitado y retención de los lavados. Este método es adecuado para grandes volúmenes de agua que contengan bajos niveles de saprofitas.
No suele aconsejarse la concentración para muestras del proceso de transformación de la patata o de aguas residuales, ya que unas poblaciones mayores de bacterias saprofitas competidoras inhibirán la detección de R. solanacearum.
2.2 Análisis
Véase el diagrama de flujo y la descripción de las pruebas en los apéndices pertinentes.
SECCIÓN V
1. Esquema del método de detección e identificación de R. solanacearum en el suelo
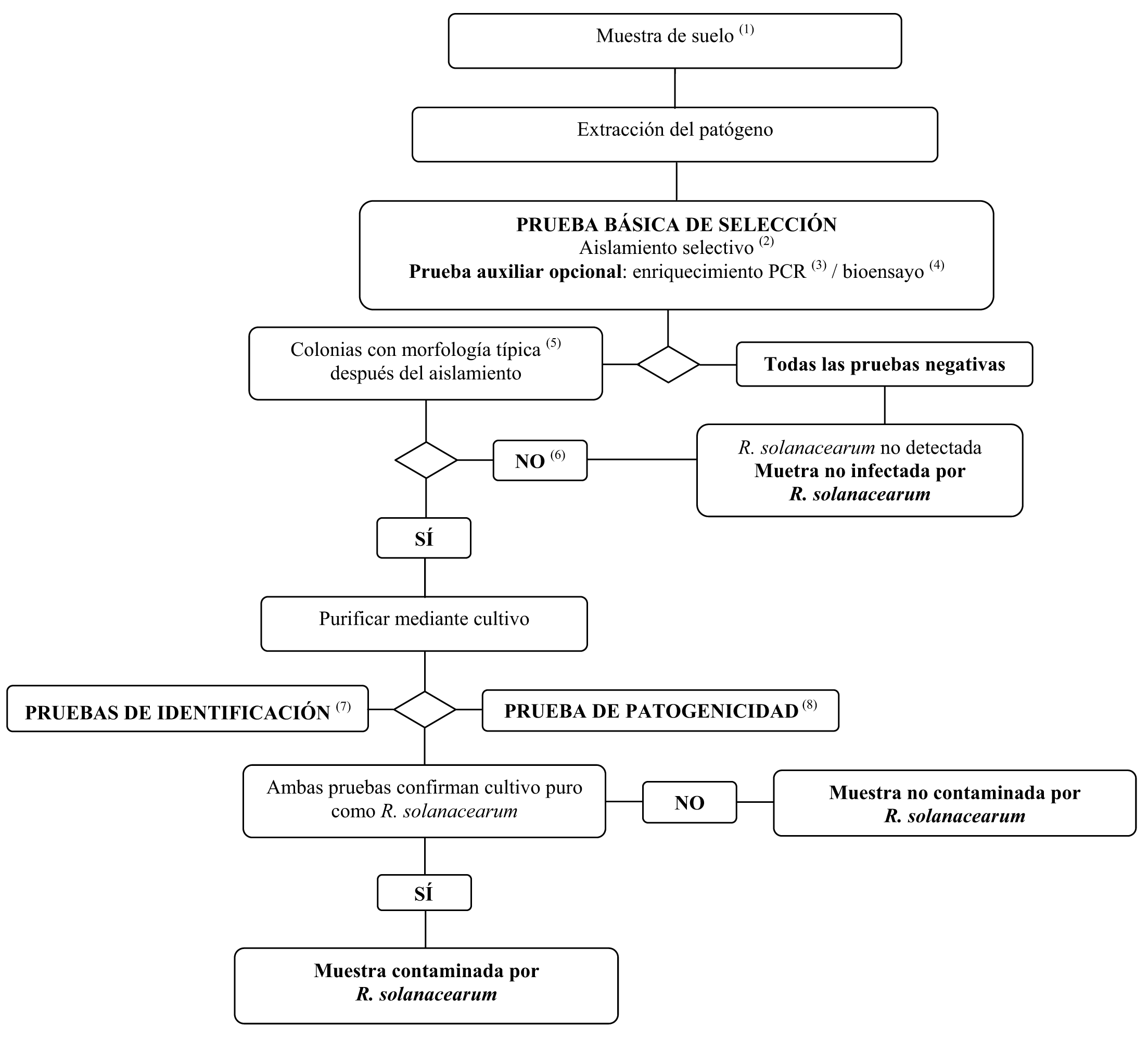
(1) Véase la sección V.2.1 para los tamaños recomendados de las muestras.
(2) En la sección VI.A.4 se describe la prueba de aislamiento selectivo.
(3) En las secciones VI.A.4.2 y VI.A.6 se describen los métodos de enriquecimiento PCR.
(4) En la sección VI.A.9 se describe la prueba del bioensayo.
(5) La morfología típica de la colonia se describe en la sección II.3.d.
(6) El aislamiento puede fallar debido a la competencia o la inhibición por bacterias saprofitas. Si se sospecha que una elevada población saprofita afecta a la fiabilidad del aislamiento, repetir entonces las pruebas de aislamiento tras la dilución de la muestra.
(7) La identificación fiable de cultivos puros posibles aislados de R. solanacearum, se efectúa utilizando las pruebas descritas en la sección VI.B.
(8) La prueba de patogenicidad se describe en la sección VI.C.
2. Métodos de detección e identificación de R. solanacearum en el suelo
Principios
El método validado de detección que se describe en la presente sección es aplicable a la detección del patógeno en muestras del suelo, pero también puede utilizarse para analizar muestras de residuos sólidos de la transformación de la patata o de lodos de depuradora. No obstante, debe señalarse que estos métodos no son lo suficientemente sensibles para asegurar la detección de poblaciones pequeñas y/o irregularmente distribuidas de R. solanacearum que pueden encontrarse en muestras naturalmente infectadas de estos sustratos.
Deberán tenerse en cuenta las limitaciones de sensibilidad de este método de prueba a la hora de evaluar la fiabilidad de cualquier resultado negativo obtenido, así como cuando se utilice en investigaciones para determinar la presencia o ausencia del patógeno en el suelo o los lodos. El método más fiable para determinar la presencia del patógeno en el suelo del campo es plantar un posible huésped del mismo y supervisar si se produce infección, pero incluso con este método no se detectarán niveles bajos de contaminación.
2.1 Preparación de la muestra
2.1.1 El muestreo del suelo del campo deberá seguir los principios habituales utilizados para el muestreo de nematodos. Para muestrear 0,3 ha, recoger muestras de 0,5 a 1 kg de suelo en 60 puntos a una profundidad de 10 a 20 cm (o de una cuadrícula de 7 × 7 metros). Si se sospecha la presencia del patógeno, incrementar el número de puntos de recogida a 120 por 0,3 ha. Mantener las muestras a una temperatura comprendida entre 12 y 15°C antes del análisis. Tomar muestras de la transformación de la patata y de lodos de depuradora, recogiendo un total de 1 kg de sitios que representen el volumen total de lodos que se analizará. Mezclar adecuadamente cada muestra antes del análisis.
2.1.2 Dispersar submuestras de 10 a 25 g de suelo o lodos mediante agitación rotatoria (250 rpm) en 60-150 ml de tampón de extracción (apéndice 4) durante un máximo de dos horas. En caso necesario, el añadido de 0,02% de Tween-20 estéril y de 10 a 20 g de grava estéril puede contribuir a la dispersión.
2.1.3 Mantener la suspensión a 4°C durante el análisis.
2.2 Análisis
Véase el diagrama de flujo y la descripción de las pruebas en los apéndices pertinentes.
SECCIÓN VI
PROTOCOLOS OPTIMIZADOS PARA LA DETECCIÓN E IDENTIFICACIÓN DE R. solanacearum
A. PRUEBAS DE DIAGNÓSTICO Y DETECCIÓN
1. Prueba de la exudación del tallo
La presencia de R. solanacearum en tallos de patata, tomate u otras plantas huésped marchitas puede observarse mediante la sencilla prueba de presunción que se indica a continuación: cortar el tallo justo por encima del nivel del suelo. Suspender la superficie del corte en un tubo de agua limpia. Observar si se produce la característica exudación espontánea de hilos de flujo bacteriano de los haces vasculares cortados unos minutos después.
2. Prueba de la detección de gránulos de poli-βßhidroxibutirato
1. Preparar un frotis de exudado bacteriano procedente del tejido infectado o de un cultivo de 48 horas en un medio YPGA o SPA (apéndice 2) en un portaobjetos.
2. Preparar frotis de control positivos de una cepa de biovar 2 de R. solanacearum y, si se considera útil, un frotis de control negativo de un PHB sp. negativo conocido.
3. Dejar que se seque al aire y pasar con rapidez varias veces por la llama la cara inferior del portaobjetos para fijar los frotis.
4. Teñir el preparado con azul Nilo A o negro Sudán B y observar microscópicamente tal como se describe a continuación.
Prueba del azul Nilo
a) Bañar cada portaobjetos con una solución acuosa de azul Nilo A al 1% e incubar durante diez minutos a 55°C.
b) Escurrir la solución de tinción. Lavar suavemente al grifo durante unos instantes. Eliminar el agua sobrante con un pañuelo de papel.
c) Bañar el frotis con ácido acético acuoso al 8% e incubar durante un minuto a temperatura ambiente.
d) Lavar suavemente al grifo durante unos instantes. Eliminar el agua sobrante con un pañuelo de papel.
e) Rehumedecer con una gota de agua y tapar con un cubreobjetos.
f) Examinar el frotis tintado con un microscopio epifluorescente a 450 nm con gota de aceite de inmersión,a 6001000 aumentos, utilizando un objetivo de inmersión en aceite o agua.
g) Observar si se produce la fluorescencia naranja brillante de los gránulos de PHB. Observar también con la luz normal transmitida para cerciorarse de que los gránulos son intracelulares y de que la morfología celular es la típica de R. solanacearum.
Prueba del negro Sudán
a) Bañar cada portaobjetos con una solución acuosa de negro Sudan B al 0,3% en etanol al 70% e incubar durante diez minutos a temperatura ambiente.
b) Escurrir la solución de tinción y lavar suavemente con agua del grifo durante unos instantes, eliminando el agua sobrante con un pañuelo de papel.
c) Sumergir brevemente los portaobjetos en xilol y secar con un pañuelo de papel. ¡Cuidado!: el xilol es nocivo, deben tomarse las precauciones de seguridad necesarias y debe trabajarse en una campana extractora de humos.
d) Bañar el frotis con safranina acuosa al 0,5% (p/v) y dejar durante diez minutos a temperatura ambiente. ¡Cuidado!: la safranina es nociva, deben tomarse las precauciones de seguridad necesarias y debe trabajarse en una campana extractora de humos.
e) Lavar suavemente al grifo durante unos instantes, secar con un pañuelo de papel y tapar con un cubreobjetos.
f) Examinar los frotis tintados con un microscopio óptico que utilice luz transmitida con aceite de inmersión, a 1000 aumentos, utilizando un objetivo de inmersión en aceite.
g) Observar si los gránulos de PHB de las células de R. solanacearum se tiñen de negro azulado con un teñido rosáceo de las paredes de las células.
3. Pruebas de aglutinación serológica
La mejor manera de observar la aglutinación de células de R. solanacearum en líquido bacteriano o extractos de tejido sintomático es utilizando anticuerpos validados (véase el apéndice 3) etiquetados con marcadores coloreados apropiados tales como células rojas de Staphylococcus aureus o partículas coloreadas de látex. Si se utiliza un equipo comercializado (véase el apéndice 3), siga las instrucciones del fabricante. En caso contrario, aplique el procedimiento siguiente:
a) mezclar gotas de una suspensión de anticuerpos etiquetados y líquido bacteriano (de aproximadamente 5 µl) en pocillos de portaobjetos de pocillos múltiples;
b) preparar controles positivos y negativos utilizando suspensiones de R. solanacearum biovar 2 y una cepa heteróloga;
c) observar si se produce aglutinación en las muestras positivas tras mezclar suavemente durante 15 segundos.
4. Aislamiento selectivo
4.1 Siembra en medio selectivo
Nota: Antes de utilizar este método por primera vez, efectúe pruebas preliminares a fin de garantizar una detección reproducible de 103 a 104 unidades formadoras de colonias de R. solanacearum por ml añadido a extractos de muestras que hayan dado anteriormente resultados negativos.
Utilizar un medio selectivo validado adecuado tal como SMSA (modificado por Elphinstone et al., 1996; véase el apéndice 2).
Es preciso diferenciar R. solanacearum de otras bacterias que pueden desarrollar colonias en el medio. Además, las colonias de R. solanacearum pueden mostrar morfologías atípicas si las placas están superpobladas o si también contienen bacterias antagonistas. Cuando se sospeche la existencia de efectos de la competencia o el antagonismo, deberá volver a analizarse la muestra con otro método.
Para lograr la máxima sensibilidad con este método, utilizar extractos de muestras recién preparados. Sin embargo, este método también puede aplicarse a extractos que se hayan almacenado con glicerol entre –68 y –86°C.
Como controles positivos, preparar diluciones decimales de una suspensión de 106 cfu por ml de una cepa virulenta biovar 2 de R. solanacearum (por ejemplo, NCPPB 4156 = PD 2762 = CFBP 3857). Para evitar toda posibilidad de contaminación, preparar controles positivos totalmente separados de las muestras que van a analizarse.
Deberá examinarse la adecuación para el crecimiento del patógeno de cada lote recién preparado de un medio selectivo antes de utilizarlo para analizar muestras rutinarias.
Procesar el material de control de la misma manera que la muestra o muestras.
4.1.1 Aplicar una técnica de dilución en placas apropiada a fin de garantizar la dilución de cualquier población saprofita formadora de colonias que pudiera existir. Extender 50-100 µl por placa de extracto de muestra y de cada dilución.
4.1.2 Incubar las placas a 28°C. Leer las placas 48 horas después, y posteriormente a diario hasta un máximo de seis días. Las colonias típicas de R. solanacearum en el medio SMSA son de color blanco lechoso, planas, irregulares y fluidas y, tras tres días de incubación, se vuelven de color rosa a rojo sangre en el centro con rayas o espirales internas (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Nota: En algunos casos se forman colonias atípicas de R. solanacearum en este medio. Estas pueden ser pequeñas, redondas, completamente rojas y no fluidas, o sólo parcialmente fluidas y, por tanto, difíciles de distinguir de las bacterias saprofitas formadoras de colonias.
4.1.3 Purificar las presuntas colonias de R. solanacearum tras el estriado o la dilución en placas en un medio nutritivo general a fin de obtener colonias aisladas (véase el apéndice 2).
4.1.4 Almacenar los cultivos a corto plazo en agua estéril (pH 6-8, sin cloro) a temperatura ambiente en la oscuridad, o a largo plazo en un medio crioprotector adecuado entre –68 y –86°C o liofilizado.
4.1.5 Identificar los presuntos cultivos (véase la sección VI. B) y efectuar una prueba de patogenicidad (véase la sección VI. C).
Interpretación de los resultados de la siembra en medio selectivo
La siembra en medio selectivo es negativa si no se observan colonias bacterianas al cabo de seis días ni se encuentran presuntas colonias típicas de R. solanacearum, siempre que no haya sospechas de inhibición producida por la competencia o el antagonismo de otras bacterias y que en los controles positivos se encuentren colonias típicas de R. solanacearum.
La siembra en medio selectivo es positiva si se aíslan presuntas colonias de R. solanacearum.
4.2 Procedimiento de enriquecimiento
Utilizar un medio de enriquecimiento validado como el caldo Wilbrink modificado (véase el apéndice 2).
Este procedimiento puede utilizarse para incrementar selectivamente las poblaciones de R. solanacearum en extractos de muestras e incrementar la sensibilidad de la detección. Asimismo, este procedimiento diluye efectivamente los inhibidores de la reacción PCR (1:100). Sin embargo, debe señalarse que el enriquecimiento de R. solanacearum puede fallar debido a la competencia o el antagonismo de organismos saprofitas, que en muchos casos se enriquecen simultáneamente. Por este motivo, el aislamiento de R. solanacearum a partir de cultivos de caldos enriquecidos puede resultar difícil. Además, debido a que pueden incrementarse las poblaciones de saprofitos serológicamente afines, se recomienda la utilización de anticuerpos monoclonales específicos en lugar de anticuerpos policlonales cuando se aplique la prueba ELISA.
4.2.1 Para el enriquecimiento PCR, transferir 100 µl de extracto de muestras a 10 ml de caldo de enriquecimiento (apéndice 2) previamente alicuotados en tubos o matraces sin ADN. Para el enriquecimiento ELISA, pueden utilizarse proporciones más elevadas de extracto de muestras en el caldo (por ejemplo, 100 µl en 1,0 ml de caldo de enriquecimiento).
4.2.2 Incubar durante 72 horas entre 27 y 30°C en un cultivo agitado o un cultivo estático manteniendo el tapón del tubo sin apretar para que haya aireación.
4.2.3 Mezclar adecuadamente antes de utilizar en las pruebas ELISA o PCR.
4.2.4 Tratar el caldo enriquecido de manera idéntica a la muestra o las muestras de las pruebas anteriormente mencionadas.
Nota: Si se prevé una inhibición o un enriquecimiento de R.solanacearum debido a las elevadas poblaciones de determinadas bacterias saprofitas competidoras, pueden conseguirse mejores resultados con el enriquecimiento de extractos de muestras antes de cualquier centrifugación o con otras medidas de concentración.
5. Prueba de inmunofluorescencia (prueba IF)
Principio
Se recomienda utilizar la prueba IF como principal prueba de selección debido a su capacidad demostrada para alcanzar los límites requeridos.
Cuando se utilice la prueba IF como principal prueba de selección y su lectura sea positiva, deberá efectuarse la prueba de aislamiento, PCR o FISH como segunda prueba de selección. Cuando se utilice la prueba IF como segunda prueba de selección y su lectura sea positiva, deberá efectuarse una nueva prueba con arreglo al diagrama de flujo para completar el análisis.
Nota: Utilizar una fuente validada de anticuerpos de R. solanacearum (véase el sitio web: http://forum.europa.eu.int/ Public/irc/sanco/ Home/main). Se recomienda determinar el título para cada nuevo lote de anticuerpos. El título se define como la dilución más elevada en la que se produce una reacción óptima cuando se analiza una suspensión que contenga de 105 a 106 células por ml de la cepa homóloga de R. solanacearum, utilizando un conjugado de isotiocianato de fluoresceína (FITC) apropiado, según las recomendaciones del fabricante. Todo el antisuero policlonal validado debe presentar un título IF de al menos 1:2000. Durante el análisis, deberán utilizarse los anticuerpos en diluciones de trabajo cercanas o equivalentes al título.
La prueba debería efectuarse en extractos de muestras recién preparados. En caso necesario, puede realizarse con éxito enextractos almacenados entre –68 y –86°C en glicerol. El glicerol puede eliminarse de la muestra si se añade 1 ml de tampón de precipitado (véase el apéndice 4), se recentrifuga durante 15 minutos a 7.000 g y se resuspende en un volumen equivalente de tampón de precipitado. En muchos casos no es necesario efectuar este procedimiento, especialmente si las muestras se han fijado en los portaobjetos mediante flameado.
Preparar en otro portaobjetos controles positivos de la cepa homóloga o de cualquier otra cepa de referencia de R. solanacearum, suspendida en extracto de patata, tal como se especifica en el apéndice 3, punto B, y opcionalmente en tampón.
Cuando sea posible, deberá utilizarse tejido naturalmente infectado (mantenido por liofilización o congelación entre –16 y –24°C) como control similar en el mismo portaobjetos.
Pueden utilizarse como controles negativos alícuotas de extracto de muestras que hayan dado anteriormente resultados negativos de R. solanacearum.
En el apéndice 3 se enumeran los materiales normalizados de control positivo y negativo que pueden utilizarse en esta prueba.
Utilizar portaobjetos de pocillos múltiples, de preferencia con diez pocillos de 6 mm de diámetro como mínimo.
Procesar el material de control de la misma manera que la muestra o muestras.
5.1 Preparar los portaobjetos según uno de los procedimientos siguientes
i) Para precipitados con una cantidad relativamente pequeña de sedimento de almidón:
Echar con una pipeta un volumen normalizado medido (15 µl es suficiente para pocillos de 6 mm de diámetro; aumentar el volumen si el diámetro es mayor) de una dilución de 1/100 del precipitado de patata resuspendido en el primer pocillo. A continuación, echar con una pipeta un volumen similar de precipitado sin diluir (1/1) en los pocillos restantes de la fila. La segunda fila puede utilizarse como duplicado o para una segunda muestra, tal como se indica en la figura 1.
ii) Para otros precipitados:
Preparar diluciones decimales (1/10 y 1/100) del precipitado resuspendido en tampón de precipitado. Echar con una pipeta un volumen normalizado medido (15 µl es suficiente para pocillos de 6 mm de diámetro; aumentar el volumen si el diámetro es mayor) del precipitado resuspendido y de cada dilución en una fila de pocillos. La segunda fila puede utilizarse como duplicado o para una segunda muestra, tal como se indica en la figura 2.
5.2 Secar las gotitas a temperatura ambiente o calentándolas entre 40 y 45°C. Fijar las células bacterianas al portaobjetos calentándolo (15 minutos a 60°C), flameándolo con etanol del 95% o con arreglo a las instrucciones específicas de los suministradores de los anticuerpos.
En caso necesario, pueden almacenarse a continuación portaobjetos fijos en un recipiente desecado durante el menor tiempo que resulte necesario (hasta un máximo de 3 meses) antes de efectuar nuevas pruebas.
5.3 Procedimiento IF
i) Si el portaobjetos se ha preparado según el punto 5.1.i):
Preparar un conjunto de diluciones a 1/2. El primer pocillo deberá contener 1/2 del título (T/2), los otros ¼ del título (T/4), 1/2 del título (T/2), el título (T) y el doble del título (2T).
ii) Si el portaobjetos se ha preparado según el punto 5.1.ii):
Preparar la dilución de trabajo (DT) del anticuerpo en el tampón IF. La dilución de trabajo afecta a la especificidad.
Figura 1. Preparación del portaobjetos con arreglo a los puntos 5.1.i) y 5.3.i)
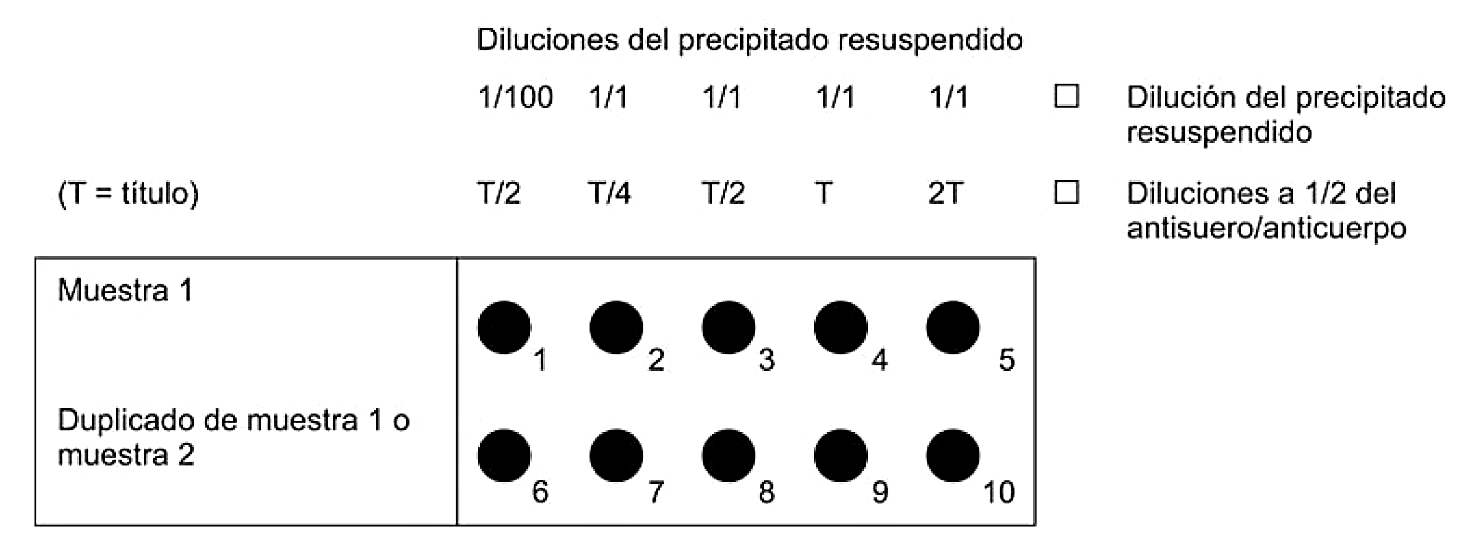
Figura 2. Preparación del portaobjetos con arreglo a los puntos 5.1.ii) y 5.3.ii)

5.3.1 Colocar los portaobjetos en un pañuelo de papel humedecido. Cubrir cada pocillo completamente con la dilución o diluciones de anticuerpos. El volumen de anticuerpos aplicado en cada pocillo debe ser como mínimo equivalente al volumen de extracto aplicado.
En caso de que no existan instrucciones específicas de los suministradores de los anticuerpos deberá aplicarse el siguiente procedimiento:
5.3.2 Dejar en incubación los portaobjetos en papel húmedo durante 30 minutos a temperatura ambiente (18-25°C).
5.3.3 Sacudir las gotitas de cada portaobjetos y enjuagar cuidadosamente con tampón IF. Lavar por inmersión durante cinco minutos en tampón IF-Tween (apéndice 4) y posteriormente en tampón IF. Evitar la transferencia de aerosoles o gotitas que pudiera provocar contaminaciones cruzadas. Eliminar cuidadosamente el exceso de humedad secándolo suavemente.
5.3.4 Colocar los portaobjetos en papel húmedo. Cubrir los pocillos con la dilución del conjugado FITC utilizado para determinar el título. El volumen de conjugado aplicado en los pocillos debe ser idéntico al volumen de anticuerpos aplicado.
5.3.5 Dejar en incubación los portaobjetos en papel húmedo durante 30 minutos a temperatura ambiente (18-25°C).
5.3.6 Sacudir las gotitas de conjugado del portaobjetos. Enjuagar y lavar como antes (5.3.3).
Eliminar cuidadosamente el exceso de humedad.
5.3.7 Echar con una pipeta 5 a 10 µl de tampón fosfato glicerol de 0,1 M (apéndice 4) o un volumen de solución comercial que proteja la fluorescencia (antifading) en cada pocillo y colocar un cubreobjetos.
5.4 Lectura de la prueba IF
5.4.1 Examinar los portaobjetos en un microscopio epifluorescente con filtros adecuados para que se produzca la excitación del FITC, con aceite o agua de inmersión y a 500-1 000 aumentos. Recorrer los pocillos a lo largo de dos diámetros perpendiculares entre sí y alrededor del perímetro. En el caso de muestras que presenten un bajo número de células o ninguna, deben observarse como mínimo 40 campos microscópicos.
En primer lugar, comprobar el control positivo. Las células deben ser fluorescentes brillantes y estar completamente teñidas en el título de anticuerpos o la dilución de trabajo determinados. La prueba IF (sección VI.A.5) debe repetirse si la tinción no es correcta.
5.4.2 Comprobar si hay células fluorescentes brillantes con morfología característica de R. solanacearum en los pocillos de los portaobjetos (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main). La intensidad de la fluorescencia debe ser equivalente a la de la cepa de control positivo en la misma dilución de anticuerpos. Deberán descartarse las células que presenten una tinción incompleta o cuya fluorescencia sea escasa.
Deberá repetirse la prueba si se sospecha que se ha producido cualquier posible contaminación. Este puede ser el caso cuando todos los portaobjetos de un lote muestren células positivas debido a la contaminación del tampón o si se encuentran células positivas (fuera de los pocillos de los portaobjetos) en la superficie.
5.4.3 Existen varios problemas inherentes a las características específicas de la prueba de inmunofluorescencia. En los precipitados de cuñas basales de patata y los precipitados de segmentos del tallo pueden aparecer poblaciones de base de células fluorescentes de morfología atípica y bacterias saprofitas con reacción cruzada cuyo tamaño y morfología sean similares a los de R. solanacearum.
5.4.4 Tener solamente en cuenta las células fluorescentes con tamaño y morfología típicos en el título o la dilución de trabajo de los anticuerpos, tal como se describe en 5.3.
5.4.5 Interpretación de la lectura de la prueba IF:
i) si se encuentran células fluorescentes brillantes con morfología característica, estimar el número medio de células típicas por campo microscópico y calcular el número de células típicas por ml de precipitado resuspendido (apéndice 5).
La lectura IF es positiva en las muestras con un mínimo de 5 × 103 células típicas por ml de precipitado resuspendido. Se considera entonces que la muestra puede estar contaminada y deben efectuarse otras pruebas,
ii) la lectura IF es negativa en las muestras con menos de 5 × 103 células por ml de precipitado resuspendido, y se considera negativa la muestra. No es preciso efectuar más pruebas.
6. Prueba de reacción en cadena de la polimerasa (prueba PCR)
Principios
Cuando se utilice la prueba PCR como principal prueba de selección y dé resultados positivos, deberá efectuarse la prueba de aislamiento o la IF como segunda prueba obligatoria de selección. Cuando se utilice la PCR como segunda prueba de selección y dé resultados positivos, deberán efectuarse las pruebas establecidas en el diagrama de flujo para completar el diagnóstico.
La aplicación de este método como principal método de selección sólo se recomienda en el caso de que se hayan adquirido conocimientos especializados del mismo.
Nota: Las pruebas preliminares realizadas con este método deberían permitir la detección reproducible de 103 a 104 células de R. solanacearum por ml añadidas a los extractos de muestras que previamente proporcionaron resultados negativos. Puede ser necesario llevar a cabo experimentos de optimización para lograr niveles máximos de sensibilidad y especificidad en todos los laboratorios.
Utilizar reactivos y protocolos PCR validados (véase el apéndice 6). Seleccionar preferiblemente un método con control interno.
Tomar las precauciones adecuadas para evitar la contaminación de la muestra con el ADN buscado. La prueba PCR debe ser efectuada por técnicos experimentados, en laboratorios especializados en biología molecular, con el fin de reducir al máximo la posibilidad de contaminación con el ADN buscado.
Como muestras finales del procedimiento siempre deben efectuarse controles negativos (para la extracción de ADN y los procedimientos PCR) que dejen constancia de si se ha producido arrastre de ADN.
En la prueba PCR deben incluirse los siguientes controles negativos:
– extracto de la muestra que previamente haya proporcionado resultados negativos para R. solanacearum,
– controles de los tampones utilizados para extraer la bacteria y el ADN de la muestra,
– mezcla para la reacción PCR.
Deben incluirse los siguientes controles positivos:
– alícuotas de precipitados resuspendidos a los que se ha añadido R. solanacearum (para la preparación véase el apéndice 3, punto B),
– una suspensión de 106 células por ml de R. solanacearum en agua de un aislado virulento (por ejemplo, NCPPB 4156 = PD 2762 = CFBP 3857; véase el apéndice 3, punto B),
– siempre que sea posible, utilizar asimismo ADN extraído de las muestras de control positivas en la prueba PCR.
Para evitar toda posible contaminación, preparar los controles positivos en un entorno distinto al de las muestras que vayan a analizarse.
Los extractos de muestras deben contener la cantidad mínima de tierra posible. En determinados casos puede ser recomendable preparar los extractos a partir de patatas lavadas cuando vayan a utilizarse protocolos PCR.
En el apéndice 3 se enumeran los materiales normalizados de control positivo y negativo que pueden utilizarse en esta prueba.
6.1 Métodos de purificación del ADN
Utilizar muestras de control positivas y negativas como se indica más arriba (véase el apéndice 3).
Procesar el material de control de la misma manera que la muestra o muestras.
Existen diferentes métodos para purificar el ADN buscado a partir de sustratos de muestras complejas, separando de esta manera los inhibidores de PCR y otras reacciones enzimáticas y concentrando el ADN buscado en el extracto de la muestra. Se ha optimizado el método siguiente para su utilización con los métodos PCR validados mostrados en el apéndice 6.
a) Método de Pastrik (2000)
1) verter con una pipeta 220 µl de tampón de lisis [100 mM NaCl, 10 mM Tris-HCl (pH 8,0), 1 mM EDTA (pH 8,0)] en un tubo eppendorf de 1,5 ml;
2) añadir 100 µl de extracto de muestra y colocar en un calentador o al baño maría a 95°C durante diez minutos;
3) colocar el tubo en hielo durante cinco minutos;
4) añadir 80 µl de solución estándar de lisozima (50 mg de lisozima por ml en 10 mM Tris HCl, pH 8,0) e incubar a 37°C durante 30 minutos;
5) añadir 220 µl de solución A Easy DNA® (Invitrogen), mezclar adecuadamente por agitación e incubar a 65°C durante 30 minutos;
6) añadir 100 µl de solución B Easy DNA® (Invitrogen) y agitar vigorosamente hasta que el precipitado se mueva libremente en el tubo y la muestra sea uniformemente viscosa;
7) añadir 500 µl de cloroformo y agitar hasta que disminuya la viscosidad y la mezcla sea homogénea;
8) centrifugar a 15.000 g durante 20 minutos a 4°C para separar las fases y formar la interfase;
9) transferir la fase superior a un tubo Eppendorf sin utilizar;
10) añadir 1 ml de etanol al 100% (– 20°C), agitar brevemente e incubar en hielo durante diez minutos;
11) centrifugar a 15.000 g durante 20 minutos a 4°C y retirar el etanol del precipitado;
12) añadir 500 µl de etanol al 80% (– 20°C) y mezclar invirtiendo el tubo;
13) centrifugar a 15.000 g durante diez minutos a 4°C, guardar el precipitado y retirar el etanol;
14) dejar que el precipitado se seque al aire o en un Speed Vac de ADN;
15) resuspender el precipitado en 100 µl de agua ultrapura estéril y dejar a temperatura ambiente durante un mínimo de 20 minutos;
16) almacenar a –20°C hasta que se necesite para la prueba PCR;
17) centrifugar todo precipitado blanco y utilizar 5 µl del sobrenadante que contenga ADN para la prueba PCR.
b) Otros métodos
Pueden aplicarse otros métodos de extracción del ADN, como por ejemplo Qiagen DNeasy Plant Kit, siempre que se haya demostrado que son igual de eficaces en la purificación del ADN a partir de muestras de control que contengan de 103 a 104 células patógenas por ml.
6.2 PCR
6.2.1 Preparar plantillas de ensayo y de control para la prueba PCR con arreglo a los protocolos validados (sección VI.A.6). Preparar una dilución decimal de extracto de ADN de la muestra (1:10 en agua ultrapura).
6.2.2 Preparar la mezcla de reacción PCR apropiada en un entorno sin contaminación de acuerdo con los protocolos publicados (apéndice 6). Cuando sea posible, se recomienda utilizar un protocolo PCR multiplex que incorpore asimismo un control interno de la prueba PCR.
6.2.3 Añadir de 2 a 5 µl de extracto de ADN por 25 µl de reacción PCR en tubos PCR estériles con arreglo a los protocolos PCR (véase el apéndice 6).
6.2.4 Incorporar una muestra de control negativo que contenga sólo mezcla de reacción PCR y añadir la misma fuente de agua ultrapura utilizada en la mezcla PCR en lugar de la muestra.
6.2.5 Colocar los tubos en el mismo termociclador utilizado en las pruebas preliminares y aplicar el programa PCR optimizado adecuado (apéndice 6).
6.3 Análisis del producto de la PCR
6.3.1 Resolver los amplicones PCR mediante electroforesis en gel de agarosa. Aplicar como mínimo 12 µl de mezcla de reacción de ADN amplificada de cada muestra mezclada con 3 µl de tampón de carga (apéndice 6) en 2,0% (w/v) de geles de agarosa en un tampón de tris-acetatoEDTA (TAE) (apéndice 6) a 5-8 V por cm. Utilizar un marcador de ADN adecuado, por ejemplo, 100 pb ladder.
6.3.2 Revelar las bandas de ADN tiñéndolas con bromuro de etidio (0,5 mg/l) durante 30 a 60 minutos, tomando las precauciones adecuadas para el manejo de este mutágeno.
6.3.3 Observar el gel teñido mediante transiluminación en UV de onda corta (λ = 302 nm) para productos de la PCR amplificados del tamaño esperado (apéndice 6) y anotar los resultados.
6.3.4 En relación con todos los nuevos descubrimientos o casos, para verificar la autenticidad del amplicón PCR efectuar un análisis de la enzima de restricción en una muestra del ADN restante amplificado incubando a la temperatura óptima y durante el tiempo necesario con una enzima y un tampón apropiados (véase el apéndice 6). Resolver los fragmentos digeridos mediante electroforesis en gel de agarosa, al igual que antes, y observar el patrón característico del fragmento de restricción con transiluminación UV una vez teñido con bromuro de etidio y comparar con el control positivo no digerido y digerido.
Interpretación de los resultados de la prueba PCR
La prueba PCR es negativa si el amplicón PCR específico de R. solanacearum del tamaño esperado no se detecta en la muestra en cuestión pero sí se detecta en todas las muestras de controles positivos (en caso de PCR multiplex con cebadores de control interno específicos de la planta, se debe amplificar con la muestra en cuestión un segundo producto PCR del tamaño esperado).
La prueba PCR es positiva si se detecta el amplicón PCR específico de R. solanacearum del tamaño y patrón de restricción esperado (cuando se exija), siempre que no se amplifique a partir de ninguna de las muestras de control negativo. La confirmación fiable de un resultado positivo puede obtenerse también repitiendo la prueba con un segundo conjunto de cebadores de la PCR (apéndice 6).
Nota: Puede sospecharse la inhibición de la PCR si el amplicón esperado se obtiene a partir de la muestra de control positivo que contiene R. solanacearum en agua, pero se obtienen resultados negativos de los controles positivos con R. solanacearum en extracto de patata. En protocolos PCR multiplex con controles PCR internos, la inhibición de la reacción se indica cuando no se obtiene ninguno de los dos amplicones.
Puede sospecharse la existencia de contaminación si el amplicón esperado se obtiene a partir de uno o varios de los controles negativos.
7. Prueba de hibridación fluorescente in situ (prueba FISH)
Principio
Cuando se utilice la prueba FISH como primera prueba de selección y esta proporcione resultados positivos, deberá efectuarse la prueba de aislamiento o la prueba IF como segunda prueba obligatoria de selección. Cuando se utilice la prueba FISH como segunda prueba de selección y dé resultados positivos, deberán efectuarse las pruebas establecidas en el diagrama de flujo para completar el diagnóstico.
Nota: Utilizar oligosondas específicas para R. solanacearum validadas (véase el apéndice 7). Las pruebas preliminares realizadas con este método deberían permitir la detección reproducible de al menos 103 a 104 células de R. solanacearum por ml añadidas a los extractos de muestras que hayan dado anteriormente resultados negativos.
El procedimiento siguiente debería efectuarse, a ser posible, con extracto de muestra recién preparado, pero también puede realizarse con éxito con extracto de muestra que se haya almacenado en glicerol a una temperatura comprendida entre –16 y –24°C o entre –68 y –86°C.
Utilizar como controles negativos alícuotas de extracto de muestras que hayan dado previamente resultados negativos para R. solanacearum.
Como controles positivos, preparar suspensiones que contengan de 105 a 106 células por ml de R. solanacearum biovar 2 (por ejemplo la cepa NCPPB 4156 = PD 2762 = CFBP 3857; véase el apéndice 3) en tampón de fosfato de 0,01 M de un cultivo de tres a cinco días. Preparar en otro portaobjetos controles positivos de la cepa homóloga o de cualquier otra cepa de referencia de R. solanacearum, suspendida en extracto de patata, tal como se especifica en el apéndice 3, punto B.
El uso de una oligosonda eubacteriana con etiqueta FITC ofrece un control para el proceso de hibridación, ya que teñirá todas las eubacterias presentes en la muestra.
En el apéndice 3, punto A, se enumeran los materiales normalizados de control positivo y negativo que pueden utilizarse en esta prueba.
Procesar el material de control de la misma manera que la muestra o muestras.
7.1 Fijación del extracto de patata
El protocolo siguiente se basa en Wullings et al. (1998).
7.1.1 Preparar la solución de fijación (véase el apéndice 7).
7.1.2 Verter 100 µl de cada extracto de muestra en un tubo eppendorf y centrifugar durante siete minutos a 7 000 g.
7.1.3 Separar el sobrenadante y disolver el precipitado en 200 µl de solución fijadora preparada con menos de 24 horas de antelación. Agitar e incubar durante una hora en el refrigerador.
7.1.4 Centrifugar durante siete minutos a 7 000 g, separar el sobrenadante y resuspender el precipitado en 75 µl de tampón de fosfato de concentración 0,01 M (véase el apéndice 7).
7.1.5 Colocar 16 µl de las suspensiones fijadas en un portaobjetos múltiple limpio, tal como muestra la figura 7.1. Aplicar dos muestras diferentes por portaobjetos sin diluir y utilizar 10 µl para realizar una dilución a 1:100 (en tampón de fosfato de concentración 0,01 M). La solución de la muestra restante (49 µl) puede almacenarse a –20°C tras la adición de 1 volumen de etanol al 96 %. En caso de que sea necesario repetir la prueba FISH, separar el etanol mediante centrifugación y añadir un volumen equivalente de tampón de fosfato de concentración 0,01 M (mezclar mediante agitación).
Figura 7.1. Distribución del portaobjetos para la prueba FISH.
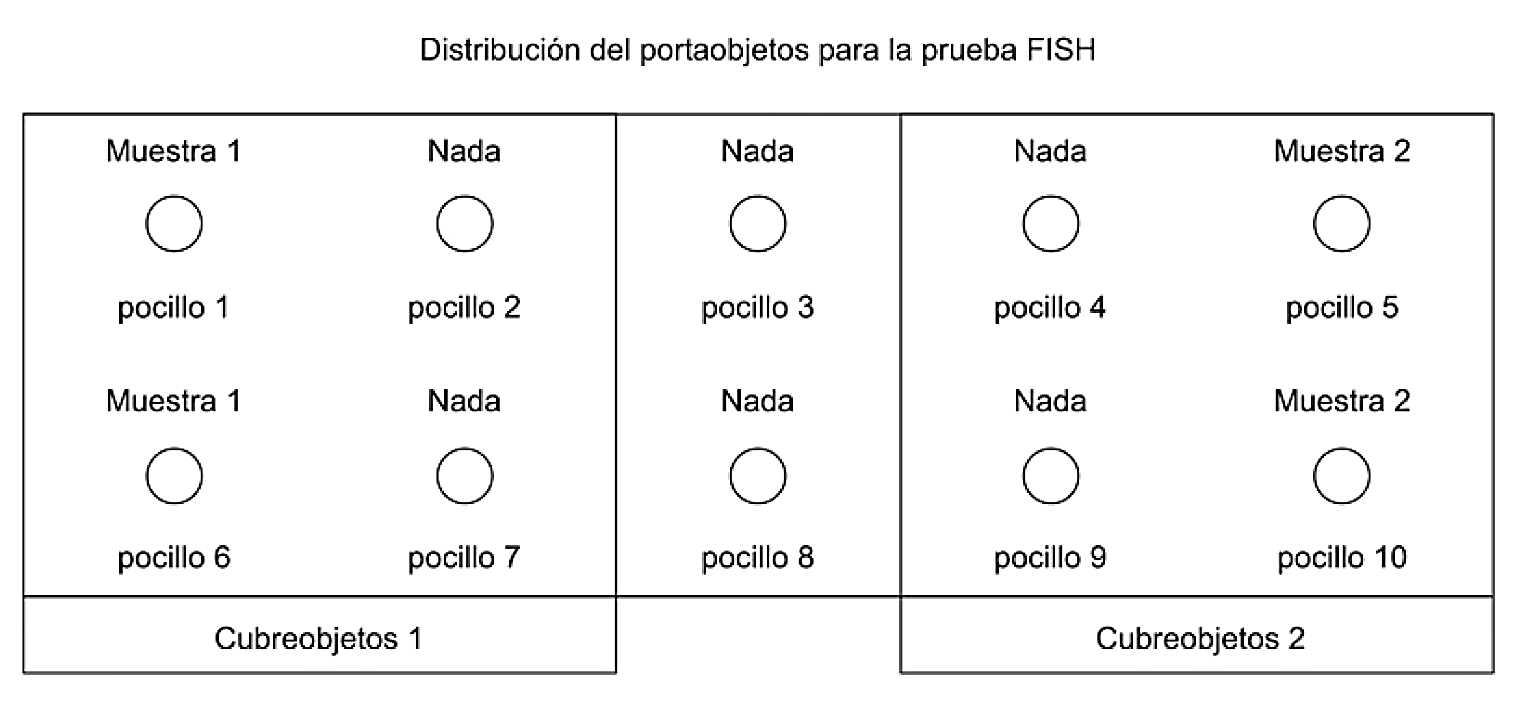
7.1.6 Secar los portaobjetos al aire (o con secador de portaobjetos a 37°C) y fijarlos flameándolos.
El procedimiento puede interrumpirse en esta fase, pudiéndose proseguir con la hibridación al día siguiente. Los portaobjetos deben almacenarse secos y sin polvo a temperatura ambiente.
7.2 Hibridación
7.2.1 Deshidratar las células en series de etanol escalonadas al 50%, 80% y 96% durante un minuto cada una. Secar las preparaciones en un portaobjetos.
7.2.2 Preparar una cámara de incubación húmeda recubriendo el fondo de una caja hermética con papel de seda o de filtro empapado en 1x hybmix (apéndice 7). Preincubar la caja en el horno de hibridación a 45°C durante un mínimo de diez minutos.
7.2.3 Aplicar 10 µl de solución de hibridación (apéndice 7) a ocho pocillos (pocillos 1, 2, 4, 5, 6, 7, 9 y 10; véase la figura 7.1) de cada portaobjetos dejando vacíos los dos pocillos centrales (3 y 8).
7.2.4 Aplicar cubreobjetos (24 × 24 mm) al primer y a los cuatro últimos pocillos evitando la entrada de aire. Colocar los portaobjetos en la cámara húmeda precalentada y dejar que se produzca la hibridación durante cinco horas a 45°C en la oscuridad.
7.2.5 Preparar tres vasos de precipitado que contengan 1 l de agua Milli Q (grado molecular), 1 l de 1x hybmix (334 ml 3x hybmix y 666 ml agua Milli Q) y 1 l de 1/8x hybmix (42 ml 3x hybmix y 958 ml agua Milli Q). Preincubarlos al baño maría a 45°C.
7.2.6 Quitar los cubreobjetos de las preparaciones y colocar estas en un portaobjetos.
7.2.7 Lavar el exceso de sonda mediante incubación durante 15 minutos en el vaso de precipitado con 1x hybmix a 45°C.
7.2.8 Transferir el portaobjetos a una solución de lavado de hybmix a 1/8 e incubar durante otros 15 minutos.
7.2.9 Sumergir las preparaciones brevemente en agua Milli Q y colocarlas en papel de filtro. Eliminar el exceso de humedad cubriendo la superficie con cuidado con papel de filtro. Verter de 5 a 10 µl de solución de montaje protectora de la fluorescencia (por ejemplo Vectashield, Vecta Laboratories, CA, USA, o equivalente) en cada pocillo y aplicar un cubreobjetos grande (24 × 60 mm) sobre la totalidad de la preparación.
7.3 Lectura de la prueba FISH
7.3.1 Los portaobjetos deben examinarse inmediatamente utilizando un microscopio epifluorescente a 630 o 1.000 aumentos con aceite de inmersión. Con un filtro adecuado para isotiocianato de fluoresceína (FITC), las células eubacterianas (incluida la mayoría de las células gramnegativas) de la muestra aparecen teñidas de verde fluorescente. Utilizando un filtro para tetrametilrodamina-5-isotiocianato, las células de R. solanacearum marcadas con Cy3 aparecen teñidas de rojo fluorescente. Comparar la morfología de las células con la de los controles positivos. Las células deben ser fluorescentes brillantes y estar completamente teñidas. La prueba FISH (sección VI.A.7) debe repetirse si la tinción es aberrante. Recorrer los pocillos a lo largo de dos diámetros perpendiculares entre sí y alrededor del perímetro. En el caso de muestras que presenten un bajo número de células o ninguna, deben observarse como mínimo 40 campos microscópicos.
7.3.2 Comprobar si hay células fluorescentes brillantes con la morfología característica de R. solanacearum en los pocillos de los portaobjetos (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main). La intensidad de la fluorescencia debe ser equivalente o mejor que la de la cepa de control positivo. Deberán descartarse las células que presenten una tinción incompleta o cuya fluorescencia sea escasa.
7.3.3 Deberá repetirse la prueba si se sospecha que se ha producido cualquier posible contaminación. Este puede ser el caso cuando todos los portaobjetos de un lote muestren células positivas debido a la contaminación del tampón o si se encuentran células positivas (fuera de los pocillos de los portaobjetos) en la superficie.
7.3.4 Existen varios problemas inherentes a la especificidad de la prueba FISH. En los precipitados de cuñas basales de patata y de segmentos del tallo pueden aparecer poblaciones de base de células fluorescentes de morfología atípica y bacterias saprofitas con reacción cruzada cuyo tamaño y morfología sean similares a los de R. solanacearum, aunque con mucha menor frecuencia que en la prueba IF.
7.3.5 Ténganse en cuenta únicamente las células fluorescentes de tamaño y morfología típicos.
7.3.6 Interpretación de los resultados de la prueba FISH.
i) Se obtendrán resultados válidos en la prueba FISH siempre que en todos los controles positivos y en ninguno de los controles negativos se observen células teñidas de verde fluorescente brillante, cuyo tamaño y morfología sean los típicos de las de R. solanacearum, cuando se utilice el filtro FITC, y células teñidas de rojo fluorescente brillante cuando se utilice el filtro de rodamina. Si se encuentran células fluorescentes brillantes con morfología característica, estimar el número medio de células típicas por campo microscópico y calcular el número de células típicas por ml de precipitado resuspendido (apéndice 4). Las muestras que presenten al menos 5 × 103 células típicas por ml de precipitado resuspendido se consideran potencialmente contaminadas. Es preciso efectuar nuevas pruebas. Las muestras que presenten menos de 5 × 103 células típicas por ml de precipitado resuspendido se consideran negativas.
ii) Los resultados de la prueba FISH serán negativos cuando no se observen células teñidas de rojo fluorescente brillante con un tamaño y morfología típicos de R. solanacearum utilizando el filtro de rodamina, siempre que se observen células teñidas de rojo fluorescente brillante típicas en las preparaciones de control positivo cuando se utilice el filtro de rodamina.
8. Pruebas de ensayo de inmunoabsorción enzimática (ELISA)
Principio
Las pruebas ELISA solamente pueden utilizarse como prueba opcional además de las pruebas IF, PCR o FISH, debido a la sensibilidad relativamente baja de esta prueba. Cuando se utilice ELISA-DASI, es obligatorio efectuar un enriquecimiento y utilizar anticuerpos monoclonales (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main). Puede resultar de utilidad efectuar un enriquecimiento de las muestras antes de utilizar la prueba ELISA, a fin de incrementar la sensibilidad de la prueba, pero puede fracasar debido a la competencia de otros organismos en la muestra.
Nota: Utilizar una fuente validada de anticuerpos de R. solanacearum (véase el sitio web: http://forum.europa.eu.int/ Public/irc/sanco/Home/main). Se recomienda determinar el título para cada nuevo lote de anticuerpos. El título se define como la dilución más elevada en la que se produce una re-acción óptima cuando se analiza una suspensión que contenga de 105 a 106 células por ml de la cepa homóloga de R. solanacearum, utilizando conjugados de anticuerpos secundarios apropiados, según las recomendaciones del fabricante. Durante el análisis, deben utilizarse los anticuerpos en diluciones de trabajo cercanas o equivalentes a la formulación comercial.
Determinar el título de los anticuerpos en una suspensión de 105 a 106 células por ml de la cepa homóloga de R. solanacearum.
Incluir una muestra de extracto que haya dado previamente resultados negativos para R. solanacearum y una suspensión de una bacteria que no tenga reacción cruzada en tampón fosfato salino (PBS) como controles negativos.
Como control positivo utilizar alícuotas de extracto de muestra que haya dado previamente resultados negativos, mezcladas con 103 a 104 células por ml de R. solanacearum biovar 2 (por ejemplo, cepa NCPPB 4156 = PD 2762 = CFBP 3857; véase el apéndice 3, puntos A y B). Para la comparación de los resultados de cada placa utilizar una suspensión normalizada de 105 a 106 células por ml en PBS de R. solanacearum. Debe asegurarse que los controles positivos estén bien separados en la placa de microtitulación de la muestra o las muestras analizadas.
En el apéndice 3, punto A, se enumeran los materiales normalizados de control positivo y negativo que pueden utilizarse en esta prueba.
Procesar el material de control de la misma manera que la muestra o muestras.
Se han validado dos protocolos ELISA:
a) ELISA indirecto (Robinson Smith et al., 1995):
1) utilizar de 100 a 200 µl de alícuotas de extracto de muestra. (Si se calienta a 100°C durante cuatro minutos al baño maría o un calentador pueden reducirse en algunos casos los resultados no específicos.);
2) añadir un volumen igual de tampón de tapizado de doble concentración (apéndice 4) y agitar;
3) aplicar 100 µl de alícuotas en al menos dos pocillos de una placa de microtitulación (por ejemplo, Nunc-Polysorp o equivalente) e incubar durante una hora a 37°C o durante una noche a 4°C;
4) quitar los extractos de los pocillos. Lavar estos tres veces con PBS-Tween (apéndice 4), dejando en ellos la última solución de lavado durante al menos cinco minutos;
5) preparar la dilución adecuada de anticuerpos contra R. solanacearum en tampón de bloqueo (apéndice 4). Para anticuerpos comerciales validados, utilizar las diluciones recomendadas (normalmente una concentración que duplique el título);
6) añadir 100 µl a cada pocillo e incubar durante una hora a 37°C;
7) quitar la solución de anticuerpos de los pocillos y lavar como se describe en el punto 4;
8) preparar la dilución adecuada de conjugado de fosfatasa alcalina de anticuerpos secundarios en tampón de bloqueo. Añadir 100 µl a cada pocillo e incubar durante una hora a 37°C;
9) quitar los anticuerpos conjugados de los pocillos y lavar como se describe en el punto 4;
10) añadir 100 µl de solución de sustrato de fosfatasa alcalina (apéndice 4) a cada pocillo. Incubar en la oscuridad a temperatura ambiente y leer la absorbencia a 405 nm a intervalos regulares durante 90 minutos.
b) ELISA-DASI (doble sandwich de anticuerpos indirecto):
1) preparar la dilución adecuada de inmunoglobulinas policlonales contra R. solanacearum en tampón de bloqueo de pH 9,6 (apéndice 4). Añadir 200 µl a cada pocillo. Incubar a 37°C de cuatro a cinco horas o a 4°C durante 16 horas;
2) lavar tres veces los pocillos con PBS-Tween (apéndice 4).
Añadir 190 µl de extracto de muestra en al menos dos pocillos. Añadir asimismo controles positivos y negativos en dos pocillos de cada placa. Incubar durante 16 horas a 4°C;
3) lavar tres veces los pocillos con PBS-Tween (apéndice 4);
4) preparar una dilución apropiada de anticuerpos monoclonales específicos de R. solanacearum en PBS (apéndice 4) que contenga asimismo 0,5% de seroalbúmina bovina (BSA) y añadir 190 µl a cada pocillo. Incubar a 37°C durante dos horas;
5) lavar tres veces los pocillos con PBS-Tween (apéndice 4);
6) preparar una dilución apropiada de inmunoglobulinas anti-ratón conjugadas con fosfatasa alcalina en PBS. Añadir 190 µl a cada pocillo. Incubar a 37°C durante dos horas;
7) lavar tres veces los pocillos con PBS-Tween (apéndice 4);
8) preparar una solución de sustrato de fosfatasa alcalina que contenga 1 mg de p-nitrofenil fosfato por ml de tampón de substrato (apéndice 4). Añadir 200 µl a cada pocillo. Incubar en la oscuridad a temperatura ambiente y leer la absorbencia a 405 nm a intervalos regulares durante 90 minutos.
Interpretación de los resultados de la prueba ELISA
La prueba ELISA es negativa si la lectura media de la densidad óptica (DO) de los pocillos de cada muestra duplicada es < 2 veces la DO del pocillo de control del extracto de muestra negativa, siempre y cuando todas las DO de los controles positivos sean superiores a 1,0 (tras 90 minutos de incubación con el substrato) y sean más de dos veces superiores a la DO obtenida a partir de extractos de muestra negativa.
La prueba ELISA es positiva si las lecturas medias de la DO de los pocillos de cada muestra duplicada es > 2 veces la DO en el pocillo del extracto de muestra negativa, siempre y cuando las lecturas de DO en todos los pocillos de control negativo sean < 2 veces las de los pocillos de control positivo.
Las lecturas ELISA negativas en pocillos de control positivo indican que no se ha efectuado correctamente la prueba o que ha estado inhibida. Las lecturas ELISA positivas en pocillos de control negativo indican que se ha producido contaminación cruzada o unión de anticuerpos no específicos.
9. Prueba de bioensayo
Nota: Las pruebas preliminares realizadas con este método deberían permitir la detección reproducible de 103 a 104 unidades formadoras de colonias de R. solanacearum por ml añadidas a los extractos de muestras que previamente proporcionaron resultados negativos (para la preparación véase el apéndice 3).
Se puede alcanzar la máxima sensibilidad de detección cuando se utilicen extractos de muestras que se acaben de preparar y cuando las condiciones de cultivo sean las óptimas. No obstante, este método puede aplicarse también con éxito a extractos que se hayan almacenado en glicerol a una temperatura comprendida entre –68 y –86°C.
El protocolo siguiente se basa en Janse (1988):
9.1 Utilizar diez plantas de prueba de un cultivar de tomate sensible (por ejemplo, Moneymaker o cultivar con sensibilidad equivalente determinado por el laboratorio de análisis) en la fase de la tercera hoja verdadera para cada muestra. Para más detalles de cultivo, véase el apéndice 8. Otra alternativa es utilizar berenjenas (por ejemplo, cultivar Black Beauty o cultivares con sensibilidad equivalente), únicamente plantas en fase de hoja 23 hasta la plena expansión de la tercera hoja verdadera. Se ha observado que los síntomas son menos graves y que se desarrollan más lentamente en la berenjena. Por tanto, cuando sea posible se recomienda utilizar plántulas de tomate.
9.2 Distribuir 100 µl de extracto de muestra entre las plantas analizadas.
9.2.1 Inoculación con jeringa.
Inocular los tallos de las patatas justo por encima de los cotiledones con una jeringa provista de una aguja hipodérmica (no menos de 23G). Distribuir la muestra entre las plantas analizadas.
9.2.2 Inoculación en estrías.
Sosteniendo la planta entre dos dedos, aplíquese con una pipeta una gota (de unos 5-10 µl) del precipitado en suspensión en el tallo situado entre los cotiledones y la primera hoja.
Con un bisturí estéril practicar una incisión diagonal de aproximadamente 1,0 cm de largo y una profundidad de aproximadamente 2/3 del grosor del tallo, comenzando el corte a partir de la gota del precipitado.
Sellar el corte con vaselina estéril utilizando una jeringa.
9.3 Inocular con la misma técnica cinco plantones con una suspensión acuosa de 105 a 106 células por ml preparada a partir de un cultivo de 48 horas de una cepa biovar 2 virulenta de R. solanacearum como control positivo y con tampón de precipitado (apéndice 4) como control negativo. Separar las plantas de control positivo y negativo de las otras para evitar la contaminación cruzada.
9.4 Cultivar las plantas de prueba en instalaciones de cuarentena hasta un máximo de cuatro semanas entre 25 y 30°C con elevada humedad relativa, regándolas adecuadamente para evitar que se aneguen o se marchiten por deficiencia hídrica. Para evitar la contaminación se deben incubar las plantas de control positivo y negativo en bancos claramente separados en un invernadero o cámara de cultivo; en el caso de que se disponga de un espacio reducido, garantizar la estricta separación entre tratamientos. En el caso de que deban incubarse juntas plantas para distintas muestras, deben separarse con las pantallas adecuadas. Durante la fertilización, el riego, la inspección y cualquier otra manipulación deben extremarse las precauciones para evitar la contaminación cruzada. Es esencial mantener los invernaderos y las cámaras libres de toda plaga de insectos, ya que estos pueden transmitir la bacteria de una muestra a otra.
Comprobar si se aprecian síntomas de marchitamiento, epinastia, clorosis y/o crecimiento reducido.
9.5 Aislarlas de las plantas infectadas (sección II.3) e identificar cultivos purificados de presunta R. solanacearum (sección VI. B).
9.6 Si no se observan síntomas después de tres semanas, efectuar una prueba IF/PCR/Aislamiento en una muestra mixta de secciones de 1 cm del tallo de cada planta analizada, tomadas por encima del punto de inoculación. Si la prueba es positiva, efectuar una dilución en placas (sección 4.1).
9.7 Identificar cualquier cultivo purificado de presunta R. solanacearum (sección VI. B).
Interpretación de los resultados de la prueba del bioensayo
Se obtienen resultados válidos de la prueba del bioensayo cuando las plantas del control positivo muestran síntomas típicos, pueden reaislarse las bacterias de estas plantas y no se encuentran síntomas en los controles negativos.
La prueba del bioensayo es negativa si las plantas analizadas no están infectadas por R. solanacearum, siempre que se detecte R. solanacearum en los controles positivos.
La prueba del bioensayo es positiva si las plantas analizadas están infectadas por R. solanacearum.
B. PRUEBAS DE IDENTIFICACIÓN
Identificar cultivos puros de aislados de presunta R. solanacearum utilizando al menos dos de las pruebas siguientes basadas en principios biológicos diferentes.
Cuando proceda, incluir cepas de referencia conocidas para cada prueba efectuada (véase el apéndice 3).
1. Pruebas de identificación nutricional y enzimática
Determinar las propiedades fenotípicas siguientes que estén universalmente presentes o ausentes en R. solanacearum, de acuerdo con los métodos de Lelliott y Stead (1987), Klement et al. (1990) y Schaad (2001).
| Pruebas | Resultado esperado |
|---|---|
| Producción de pigmento fluorescente | – |
| Inclusiones de poli-β-hidroxibutirato | + |
| Prueba de la oxidación/fermentación | O+/F– |
| (O/F) | |
| Actividad catalasa | + |
| Prueba de oxidasa de Kovac | + |
| Reducción de nitratos | + |
| Utilización de citratos | + |
| Crecimiento a 40°C | – |
| Crecimiento en NaCl al 1% | + |
| Crecimiento en NaCl al 2% | – |
| Actividad de dihidrolasa de arginina | – |
| Licuefacción de la gelatina | – |
| Hidrólisis del almidón | – |
| Hidrólisis de la esculina | – |
| Producción de levano | – |
2. Prueba IF
2.1 Preparar una suspensión de aproximadamente 106 células por ml en tampón IF (apéndice 4).
2.2 Preparar una serie de diluciones a 1/2 de un antisuero adecuado (véase el sitio web: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
2.3 Aplicar el procedimiento IF (sección VI.A.5).
2.4 La prueba IF será positiva si el título IF del cultivo es equivalente al del control positivo.
3. Prueba ELISA
Nota: Si solamente se efectúan dos pruebas de identificación, no debe utilizarse ninguna otra prueba serológica además de este método.
3.1 Preparar una suspensión de aproximadamente 108 células por ml en 1X PBS (apéndice 4).
3.2 Llevar a cabo un procedimiento ELISA adecuado con un anticuerpo monoclonal específico de R. solanacearum.
3.3 La prueba ELISA será positiva si la lectura ELISA obtenida del cultivo es como mínimo la mitad de la obtenida para el control positivo.
4. Prueba PCR
4.1 Preparar una suspensión de aproximadamente 106 células por ml en agua estéril de grado molecular.
4.2 Calentar 100 µl de la suspensión celular en tubos cerrados en un calentador o al baño maría a 100°C durante cuatro minutos. Las muestras pueden almacenarse entonces a una temperatura de –16 a –24°C hasta que sea necesario.
4.3 Aplicar los procedimientos PCR adecuados para amplificar los amplicones específicos de R. solanacearum [por ejemplo, Seal et al. (1993); Pastrik y Maiss (2000); Pastrik et al. (2002); Boudazin et al. (1999); Opina et al. (1997); Weller et al. (1999)].
4.4 Se logrará la identificación positiva de R. solanacearum si los amplicones de la PCR son del mismo tamaño y tienen los mismos polimorfismos de la longitud del fragmento de restricción que los de la cepa de control positivo.
5. Prueba FISH
5.1 Preparar una suspensión de aproximadamente 106 células por ml en agua ultrapura.
5.2 Aplicar el procedimiento FISH (sección VI.A.7) con al menos dos oligosondas específicas para R. solanacearum(apéndice 7).
5.3 La prueba FISH será positiva si se obtienen las mismas reacciones del cultivo y el control positivo.
6. Perfiles de ácidos grasos (Fatty acid profiling o FAP)
6.1 Mantener el cultivo en agar de tripticasa de soja (Oxoide) durante 48 horas a 28°C.
6.2 Aplicar un procedimiento FAP adecuado (Janse, 1991; Stead, 1992).
6.3 La prueba FAP será positiva si el perfil del presunto cultivo es idéntico al del control positivo. Los ácidos grasos cuya presencia es característica son 14:0 3OH, 16:0 2OH, 16:1 2OH y 18:1 2OH, y la ausencia de 16:0 3OH es altamente indicativa de Ralstonia sp.
7. Métodos de caracterización de las cepas
Se recomienda efectuar la caracterización de las cepas con uno de los métodos siguientes para cada nuevo caso de aislamiento de R. solanacearum.
Cuando proceda, incluir cepas de referencia conocidas para cada prueba efectuada (véase el apéndice 3).
7.1 Determinación de los biovares
R. solanacearum se separa en biovares en función de la capacidad para utilizar y/o oxidar tres disacáridos y tres hexosas alcohólicas (Hayward, 1964 y Hayward et al., 1990). Los medios nutritivos para la prueba del biovar se describen en el apéndice 2. Esta prueba puede efectuarse con éxito inoculando los medios por perforación con cultivos puros de aislados de R. solanacearum e incubando a 28°C. Si los medios se distribuyen en placas estériles de cultivo de células de 96 pocillos (200 µl por pocillo) puede observarse en un plazo de 72 horas un cambio de color, del verde oliva al amarillo, lo que indica un resultado positivo de la prueba.
| Biovar | |||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Utilización de: | |||||
| Maltosa | - | + | + | - | + |
| Lactosa | - | + | + | - | + |
| D (+) Celobiosa | - | + | + | - | + |
| Manitol | - | - | + | + | + |
| Sorbitol | - | - | + | + | - |
| Dulcitol | - | - | + | + | - |
El biovar 2 se diferencia en subfenotipos mediante pruebas adicionales
| Biovar 2A (distribución mundial) | Biovar 2A (en Chile y Colombia) | Biovar 2T (en áreas tropicales) | |
|---|---|---|---|
| Utilización de trehalosa | - | + | + |
| Utilización de meso-inositol | + | - | + |
| Utilización de D (-) ribosa | - | - | + |
| Actividad pectolítica | baja | baja | alta |
(1) Véase Lelliott y Stead (1987).
7.2 Obtención de la huella dactilar genómica
La diferenciación molecular de las cepas en el complejo de R. solanacearum puede conseguirse mediante diferentes técnicas, entre las que se incluyen:
7.2.1 Análisis de los polimorfismos de la longitud del fragmento de restricción (RFLP) (Cook et al., 1989).
7.2.2 PCR de secuencia repetitiva utilizando cebadores REP, BOX y ERIC (Louws et al., 1995; Smith et al., 1995).
7.2.3 Análisis de los polimorfismos de la longitud del fragmento amplificado (AFLP) (Van der Wolf et al., 1998).
7.3 Métodos PCR
Pueden utilizarse cebadores específicos de PCR (Pastrik et al, 2002; véase el apéndice 6) para diferenciar cepas que pertenezcan a la división 1 (biovares 3, 4 y 5) y la división 2 (biovares 1, 2A y 2T) de R. solanacearum, tal como se define originalmente con el análisis RFLP (Cook et al., 1989) y la secuenciación de 16S rADN (Taghavi et al., 1996).
C. PRUEBA DE CONFIRMACIÓN DE PATOGENICIDAD
Como confirmación final del diagnóstico de R. solanacearum y para la evaluación de la virulencia de cultivos identificados como R. solanacearum debe realizarse la prueba de patogenicidad:
1) preparar un inóculo de aproximadamente 106 células por ml de cultivos de 24 a 48 horas a partir del aislado que se vaya a someter a prueba y una cepa de control positivo adecuada de R. solanacearum (por ejemplo, NCPPB 4156 = PD 2762 = CFBP 3857; véase el apéndice 3);
2) inocular entre cinco y diez tallos de plántulas de tomate o berenjena sensibles en la fase de la tercera hoja verdadera (véase la sección VI.A.9);
3) incubar durante un máximo de dos semanas a una temperatura de 25 a 28°C, con humedad relativa alta y riego adecuado, evitando tanto el estancamiento del agua como el estrés provocado por la sequía. Con los cultivos puros deberá obtenerse el marchitamiento típico en el plazo de 15 días. Si después de este período no se presentan los síntomas, no podrá confirmarse que el cultivo es una forma patógena de R. solanacearum;
4) comprobar si se aprecian síntomas de marchitamiento y/o epinastia, clorosis y crecimiento reducido;
5) aislar las plantas sintomáticas separando una sección de tallo que esté 2 cm por encima del punto de inoculación. Dilacerar y suspender en un pequeño volumen de agua destilada estéril o en tampón fosfato 50 mM (apéndice 4). Aislar de la suspensión mediante dilución, extendiendo o haciendo estrías en un medio adecuado, preferentemente en un medio selectivo (apéndice 2), incubar entre 48 y 72 horas a 28°C y examinar la formación de colonias típicas de R. solanacearum.
Apéndice 1
Laboratorios que han participado en la optimización y la validación de los protocolos
| Laboratorio (1) | Ciudad | País |
|---|---|---|
| Agentur für Gesundheit und Ernährungssicherheit | Viena y Linz | Austria |
| Departement Gewasbescherming | Merelbeke | Bélgica |
| Plantedirektoratet | Lyngby | Dinamarca |
| Central Science Laboratory | York | Inglaterra |
| Scottish Agricultural Science Agency | Edimburgo | Escocia |
| Laboratoire National de la Protection des Végétaux, Unité Bactériologie | Angers | Francia |
| Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre | Le Rheu | Francia |
| Biologische Bundesanstalt | Kleinmachnow | Alemania |
| Pflanzenschutzamt Hannover | Hannover | Alemania |
| State Laboratory | Dublín | Irlanda |
| Dipartimento di Scienze e Tecnologie Agroambientali | Bolonia | Italia |
| Regione Veneto Unità Periferica per i Servizi Fitosanitari | Verona | Italia |
| Nederlandse Algemene Keuringsdienst | Emmeloord | Países Bajos |
| Plantenziektenkundige Dienst | Wageningen | Países Bajos |
| Direcção-Geral de Protecção das Culturas | Lisboa | Portugal |
| Centro de Diagnóstico de Aldearrubia | Salamanca | España |
| Instituto Valenciano de Investigaciones Agrarias | Valencia | España |
| Swedish University of Agricultural Sciences | Uppsala | Suecia |
(1) Científicos de contacto: véase el sitio web http://forum.europa.eu.int/Public/irc/sanco/Home/main.
Apéndice 2
Medios para el aislamiento y el cultivo de R. solanacearum
a) Medios de cultivo en general
Agar nutritivo (NA)
Agar nutritivo (Difco): 23,0 g.
Agua destilada: 1,0 l.
Disolver los ingredientes y esterilizar en autoclave a 121°C durante 15 minutos.
Agar de levadura, glucosa, peptona (YPGA)
Extracto de levadura (Difco): 5,0 g.
Bacto-peptona (Difco): 5,0 g.
D(+)-glucosa (monohidrato): 10,0 g.
Bacto-agar (Difco): 15,0 g.
Agua destilada: 1,0 l.
Disolver los ingredientes y esterilizar en autoclave a 121°C durante 15 minutos.
Agar de sacarosa y peptona (SPA)
Sacarosa: 20,0 g.
Bacto-peptona (Difco): 5,0 g.
K2HPO4: 0,5 g.
MgSO4.7H2O: 0,25 g.
Bacto-agar (Difco) 15,0 g.
Agua destilada: 1,0 l.
pH 7,2-7,4
Disolver los ingredientes y esterilizar en autoclave a 121°C durante 15 minutos.
Medio de tetrazolio de Kelman
Casaminoácidos (Difco): 1,0 g.
Bacto-peptona (Difco): 10,0 g.
Dextrosa: 5,0 g.
Bacto-agar (Difco): 15,0 g.
Agua destilada: 1,0 l.
Cristal violeta (Sigma): 5 mg por l.
Polimixina-B-Sulfato: (Sigma P-1004) 600.000 U (aproximadamente 100 mg) por l.
Bacitracina (Sigma B-0125): 1 250 U (aproxim. 25 mg) por l.
Cloranfenicol (Sigma C-3175): 5 mg por l.
Penicilina-G (Sigma P-3032): 825 U (aproximadamente 0,5 mg) por l.
Cloruro de 2,3,5-trifenil tetrazolio (Sigma) 50 mg por l.
Disolver los ingredientes y esterilizar en autoclave a 121°C durante 15 minutos.
Enfriar a 50°C y añadir una solución de cloruro de 2,3,5-trifenil tetrazolio (Sigma), esterilizada por filtración, para conseguir una concentración final de 50 mg/l.
b) Medios de cultivo selectivo validados
Medio SMSA (Englebrecht, 1994, modificado por Elphinstone et al., 1996).
Medio de base
Casaminoácidos (Difco): 1,0 g.
Bacto-peptona (Difco): 10,0 g.
Glicerol: 5,0 ml.
Bacto-agar (Difco) (véase la nota 2): 15,0 g.
Agua destilada: 1,0 l.
Disolver los ingredientes y esterilizar en autoclave a 121°C durante 15 minutos.
Enfriar a 50°C y añadir soluciones estándar acuosas, esterilizadas por filtración, de los siguientes ingredientes, a fin de obtener las concentraciones finales especificadas.
Nota:
1. La utilización de reactivos diferentes de los especificados arriba puede afectar al crecimiento de R. solanacearum.
2. Puede utilizarse Agar oxoide #1 en lugar de Bactoagar (Difco). En este caso, el crecimiento de R. solanacearum será más lento, aunque también puede reducirse el crecimiento de saprofitas competidoras. Las colonias típicas de R. solanacearum pueden necesitar de uno a dos días más para formarse y la coloración rojiza puede ser más ligera y difusa que en Bacto-agar.
3. Si se incrementa la concentración de bacitracina a 2 500 U por l pueden reducirse las poblaciones de bacterias competidoras sin que se vea afectado el crecimiento de R. solanacearum.
Almacenar los medios y las soluciones estándar de antibióticos a 4°C en la oscuridad y utilizar en el plazo de un mes.
Las placas deberán carecer de condensación de superficie antes de su utilización.
Evitar un secado excesivo de las placas.
Deberá efectuarse un control de calidad tras la preparación de cada nuevo lote de medio mediante siembra de una suspensión de un cultivo de referencia de R. solanacearum (véase el apéndice 3) y observación de la formación de colonias típicas después de incubación a 28°C de dos a cinco días.
c) Medios de enriquecimiento validados
Caldo SMSA (Elphinstone et al., 1996)
Preparar como para medio de agar selectivo SMSA pero omitir Bacto-agar y cloruro de 2,3,5-tetrazolio.
Caldo Wilbrink modificado (Caruso et al., 2002).
Sacarosa: 10 g.
Peptona proteosa: 5 g.
K2HPO4: 0,5 g.
MgSO4: 0,25 g.
NaNO3: 0,25 g.
Agua destilada: 1 l.
Esterilizar en autoclave a 121°C durante 15 minutos y enfriar a 50°C.
Añadir soluciones estándar de antibióticos como para el caldo SMSA.
Apéndice 3
A. Material de control normalizado comercialmente disponible
a) Aislados bacterianos
Se recomiendan los siguientes aislados bacterianos para su utilización como material normalizado de referencia, bien como controles positivos (cuadro 1) o durante la optimización de las pruebas para evitar reacciones cruzadas (cuadro 2). Todas las cepas están comercializadas por:
1. National Collection of Plant Pathogenic Bacteria (NCPPB), Central Science Laboratory, York, Reino Unido.
2. Culture Collection of the Plant Protection Service (PD), Wageningen, Países Bajos.
3. Collection Française de Bactéries Phytopathogènes (CFBP) — INRA Station Phytobactériologie, Angers, Francia.
Cuadro 1. Panel de referencia SMT de aislados de R. solanacearum
| Código NCPPB | SMT# | Otros códigos | País de origen | Biovar |
|---|---|---|---|---|
| NCPPB 4153 | 6 | CFBP 4582, Pr 3020, EURS11 | Egipto | 2 |
| NCPPB 4154 | 10 | CFBP 4585, 550, EURS21 | Turquía | 2 |
| NCPPB 3857 | 12 | CFBP 4587, Pr 1140, EURS26 | Inglaterra | 2 |
| NCPPB 1584 | 23 | CFBP 4598, EURS49 | Chipre | 2 |
| NCPPB 2505 | 24 | CFBP 4599, EURS50 | Suecia | 2 |
| NCPPB 4155 | 26 | CFBP 4601, 502, EURS55 | Bélgica | 2 |
| NCPPB 4156 (*) | 71(*) | PD 2762, CFBP 3857 | Países Bajos | 2 |
| NCPPB 4157 | 66 | LNPV 15.59 | Francia | 2 |
| NCPPB 4158 | 39 | CFBP 4608, Port 448, EURS80, NCPPB 4066 | Portugal | 2 |
| NCPPB 4160 | 69 | IVIA-1632-2 | España | 2 |
| NCPPB 4161 | 76 | B3B | Alemania | 2 |
| NCPPB 325 | 41 | CFBP 2047, KEL60-1, R842 | Estados Unidos | 1 |
| NCPPB 3967 | 42 | CFBP 4610, R285, GONg7 | Costa Rica | 1 |
| NCPPB 4028 | 43 | CFBP 4611, R303/571, CIP310, SEQ205 | Colombia | 2 |
| NCPPB 3985 | 44 | CFBP 4612, R578, CIP312 | Perú | 2T |
| NCPPB 3989 | 45 | CFBP 4613, R568, CIP226 | Brasil | 2T |
| NCPPB 3996 | 46 | CFBP 3928, R276/355, CIP72, SEQ225 | Perú | 3 |
| NCPPB 3997 | 47 | CFBP 4614, R280/363, CIP49, HAY0131a | Australia | 3 |
| NCPPB 4029 | 48 | CFBP 4615, R297/349, CIP121, CMIb2861 | Sri Lanka | 4 |
| NCPPB 4005 | 49 | CFBP 4616, R470 | Filipinas | 4 |
| NCPPB 4011 | 50 | CFBP 4617, R288, HEmps2 | China | 5 |
(*) Utilizar como cepa normalizada de referencia de R. solanacearum biovar 2 (raza 3).
Nota: La autenticidad de las cepas mencionadas solamente puede garantizarse.
Cuadro 2. Panel de referencia SMT de bacterias serológica o genéticamente relacionadas para su utilización en la optimización de las pruebas de detección
| Código NCPPB | SMT # | Otro código | Identificación |
|---|---|---|---|
| NCPPB 4162 | 51 | CFBP 1954 | Bacillus polymyxa (1) |
| NCPPB 4163 | 52 | CFBP 1538 | Pseudomonas marginalis pv. Marginalis (1) |
| NCPPB 4164 | – | CFBP 2227 | Burkholderia cepacia (2) |
| NCPPB 4165 | – | CFBP 2459 | Ralstonia pickettii (2) |
| NCPPB 4166 | 58 |
CFBP 3567 CSL Pr1150 |
Ralstonia pickettii (1) |
| NCPPB 4167 | 60 |
CFBP 4618 PD 2778 |
Ralstonia sp. (1) |
| NCPPB 1127 | 53 | CFBP 3575 | Burkholderia andropogonis (1) |
| NCPPB 353 | 54 | CFBP 3572 | Burkholderia caryophylli (1) |
| NCPPB 945 | 55 | CFBP 3569 | Burkholderia cepacia (1) |
| NCPPB 3708 | 56 | CFBP 3574 | Burkholderia glumae (1) |
| NCPPB 3590 | 57 | CFBP 3573 | Burkholderia plantarii (1) |
| NCPPB 3726 | 59 | CFBP 3568 | Banana Blood Disease Bacterium (1) (2) (3) |
| NCPPB 4168 | 61 |
CFBP 4619 IPO S339 |
Enterobacter sp. (1) |
| NCPPB 4169 | 62 | IPO 1695 | Enterobacter sp. (1) |
| NCPPB 4170 | 63 |
CFBP 4621 IPO S306 |
Ochrobactrum anthropi (1) (2) |
| NCPPB 4171 | 64 |
CFBP 4622 IPO 1693 |
Curtobacterium sp. (1) (2) |
| NCPPB 4172 | 65 | IPO 1 696.ª | Pseudomonas sp. (1) |
| NCPPB 4173 | – | PD 2318 | Aureobacterium sp. (2) |
| NCPPB 4174 | 81 | IVIA 1844.06 | Flavobacterium sp. (1) (2) |
(1) Cepa que puede presentar reacción cruzada en pruebas serológicas (IF y/o ELISA) con antisueros policlonales.
(2) Cepa de la que puede amplificarse el producto de la PCR en algunos laboratorios de un tamaño similar al esperado utilizando cebadores específicos OLI1 y Y-2 (véase el apéndice 6).
(3) Probablemente tendrá reacciones cruzadas en la mayor parte de las pruebas, pero solamente se conoce su aparición en bananas en Indonesia.
b) Material de control normalizado comercialmente disponible
El siguiente material de control normalizado puede obtenerse a partir de un cultivo NCPPB:
Congelar precipitado seco de extracto de patata a partir de 200 tubérculos de patata sanos como control negativo para todas las pruebas.
Congelar precipitado seco de extracto de patata a partir de 200 tubérculos de patata sanos que contengan de 103 a 104 y 104 a 106 células de R. solanacearum biovar 2 (por ejemplo, cepa NCPPB 4156 = PD 2762 = CFBP 3857) como controles positivos para pruebas serológicas y PCR. Teniendo en cuenta que la viabilidad de las células se ve afectada durante la criodesecación, no son adecuados como controles normalizados para pruebas de aislamiento o de bioensayo.
Utilizar suspensiones fijadas con formalina de R. solanacearum biovar 2 (cepa NCPPB 4156 = PD 2762 = CFBP 3857) de 106 células por ml como controles positivos para pruebas serológicas.
B. Preparación de controles positivos y negativos
Preparar un cultivo de 48 horas de una cepa virulenta de R. solanacearum raza 3/biovar 2 (por ejemplo, cepa NCPPB 4156 = PD 2762 = CFBP 3857) en medio base SMSA y suspender en tampón fosfato 10 mM para obtener una densidad celular de aproximadamente 2 × 108 cfu por ml. Esto se obtiene normalmente mediante una suspensión ligeramente turbia equivalente a una densidad óptica de 0,15 a 600 nm.
Separar las cuñas basales de 200 tubérculos de una variedad de piel blanca conocida por estar exenta de R. solanacearum.
Procesar las cuñas basales como es habitual y resuspender el precipitado en 10 ml.
Preparar diez microviales estériles de 1,5 ml con 900 µl del precipitado resuspendido.
Transferir 100 µl de la suspensión de R. solanacearum al primer microvial. Homogeneizar por agitación.
Establecer niveles decimales de contaminación realizando nuevas diluciones en los cinco microviales siguientes.
Los seis microviales contaminados se utilizarán como controles positivos. Los cuatro microviales no contaminados se utilizarán como controles negativos. Etiquetar los microviales como corresponda.
Preparar alícuotas de 100 µl en microviales estériles de 1,5 ml para obtener de este modo nueve réplicas de cada muestra de control. Almacenar a una temperatura de –16 a –24°C hasta que se vayan a utilizar.
La presencia y la cuantificación de R. solanacearum en las muestras de control deberá confirmarse en primer lugar mediante una prueba IF.
Para la prueba PCR, extraer ADN de las muestras de control positivas y negativas para cada serie de muestras de ensayo.
Para las pruebas IF y FISH, realizar ensayos con las muestras de control positivas y negativas para cada serie de muestras de ensayo.
En las pruebas IF, FISH y PCR, debe detectarse R. solanacearum en al menos 106 y 104 células/ml de los controles positivos y en ninguno de los controles negativos.
Apéndice 4
Tampones para procedimientos de ensayo
GENERAL: Los tampones esterilizados que no se hayan abierto pueden almacenarse hasta un año.
1. Tampones para el procedimiento de extracción
1.1 Tampón de extracción (tampón fosfato 50 mM, pH 7,0)
Este tampón se utiliza para la extracción de la bacteria del tejido de las plantas mediante la homogeneización o la agitación.
Na2HPO4 (anhidro): 4,26 g.
KH2PO4: 2,72 g.
Agua destilada: 1,00 l.
Disolver los ingredientes, verificar el pH y esterilizar en autoclave a 121°C durante 15 minutos.
Los siguientes componentes adicionales pueden resultar útiles:
| Finalidad | Cantidad (por l) | |
|---|---|---|
| Copos de Lubrol | Defloculante (*) | 0,5 g |
| Compuesto DC silicona antiespumante | Antiespumante (*) | 1,0 ml |
| Pirofosfato tetrasódico | Antioxidante | 1,0 g |
| Polivinilpirrolidona-40000 (PVP-40) | Unir los inhibidores PCR | 50 g |
(*) Para su utilización en el método de extracción por homogeneización.
1.2 Tampón de precipitado (tampón fosfato 10 mM, pH 7,2)
Este tampón se utiliza para la resuspensión y la dilución de extractos de cuñas basales de tubérculos de patata tras la concentración en un precipitado mediante centrifugación.
Na2HPO4.12H2O: 2,7 g.
NaH2PO4.2H2O: 0,4 g.
Agua destilada: 1,0 l.
Disolver los ingredientes, verificar el pH y esterilizar en autoclave a 121°C durante 15 minutos.
2. Tampones para la prueba IF
2.1 Tampón IF [tampón fosfato salino (PBS) 10 mM, pH 7,2]
Este tampón se utiliza para la dilución de anticuerpos.
Na2HPO4.12H2O: 2,7 g.
NaH2PO4.2H2O: 0,4 g.
NaCl: 8,0 g.
Agua destilada: 1,0 l.
Disolver los ingredientes, verificar el pH y esterilizar en autoclave a 121°C durante 15 minutos.
2.2 Tampón IF-Tween
Este tampón se utiliza para lavar los portaobjetos.
Añadir 0,1% de Tween 20 al tampón IF.
2.3 Solución de glicerol con tampón de fosfato, pH 7,6
Este tampón se utiliza como fluido de montaje en los pocillos de los portaobjetos de IF para aumentar la fluorescencia.
Na2HPO4.12H2O: 3,2 g.
NaH2PO4.2H2O: 0,15 g.
Glicerol: 50 ml.
Agua destilada: 100 ml.
En el mercado pueden encontrarse soluciones de montaje que protegen la fluorescencia, como, por ejemplo, Vectashield® (Vector Laboratories) o Citifluor® (Leica).
3 Tampones para la prueba ELISA-indirecto
3.1 Tampón fuerza doble para tapizado, pH 9,6
Na2CO3: 6,36 g.
NaHCO3: 11,72 g.
Agua destilada: 1,00 l.
Disolver los ingredientes, verificar el pH y esterilizar en autoclave a 121°C durante 15 minutos.
Puede añadirse como antioxidante sulfito de sodio (0,2%) si es necesario para evitar la acumulación de compuestos aromáticos oxidados.
3.2 Tampón fosfato salino (PBS), 10X pH 7,4
NaCl: 80,0 g.
KH2PO4: 2,0 g.
Na2HPO4.12H2O: 29,0 g.
KCl: 2,0 g.
Agua destilada: 1,0 l.
3.3 PBS-Tween
PBS 10X: 100 ml.
Tween 20 al 10%: 5 ml.
Agua destilada: 895 ml.
3.4 Tampón de bloqueo (anticuerpos) (debe prepararse en el momento de su utilización)
PBS 10X: 10,0 ml.
Polivinilpirrolidona-44000: 2,0 g.
(PVP-44).
Tween 20 al 10 %: 0,5 ml.
Leche en polvo: 0,5 g.
Agua destilada completar hasta: 100 ml.
3.5 Solución de sustrato fosfatasa alcalina, pH 9,8
Dietanolamina: 97 ml.
Agua destilada: 800 ml.
Mezclar y ajustar el pH a 9,8 con HCl concentrado.
Completar hasta 1 litro con agua destilada.
Añadir 0,2 g de MgCl2.
Disolver dos pastillas de 5 mg de sustrato fosfatasa (Sigma) por cada 15 ml de solución.
4 Tampones para la prueba ELISA-DASI
4.1 Tampón de tapizado, pH 9,6
Na2CO3: 1,59 g.
NaHCO3: 2,93 g.
Agua destilada: 1000 ml.
Disolver los ingredientes y comprobar el pH.
4.2 Tampón fosfato salino (PBS), 10X pH 7,2-7,4
NaCl: 80,0 g.
NaH2PO4.2H2O: 4,0 g.
Na2HPO4.12H2O: 27,0 g.
Agua destilada: 1000 ml.
4.3 PBS-Tween
10X PBS: 50 ml.
Tween 20 al 10%: 5 ml.
Agua destilada: 950 ml.
4.4 Tampón de sustrato, pH 9,8
Dietanolamina: 100 ml.
Agua destilada: 900 ml.
Mezclar y ajustar el pH a 9,8 con HCl concentrado.
Apéndice 5
Determinación del nivel de contaminación en las pruebas IF y FISH
1. Contar el número medio de células fluorescentes típicas por campo de visión (c).
2. Calcular el número de células fluorescentes típicas por pocillo del portaobjetos del microscopio (C):
donde:
S = superficie del pocillo del portaobjetos múltiple.
s = superficie del campo del objetivo.
donde:
i = coeficiente de campo (varía de 8 a 24 dependiendo del tipo ocular).
K = coeficiente del tubo (1 o 1,25).
G = aumentos del objetivo (100x, 40x, etc.).
3. Calcular el número de células fluorescentes típicas por ml de precipitado resuspendido (N):
donde:
y = volumen de precipitado resuspendido en cada pocillo.
F = factor de dilución del precipitado resuspendido.
Apéndice 6
Protocolos y reactivos PCR validados
Nota: Las pruebas preliminares deberán permitir la detección reproducible de al menos 103 a 104 células de R. solanacearum por ml de extracto de muestra.
Por otra parte, las pruebas preliminares no deben proporcionar resultados positivos falsos con respecto a un conjunto de cepas bacterianas seleccionadas (véase el apéndice 3).
1. Protocolo PCR de Seal et al. (1993)
1.1 Cebadores del oligonucleótido
Cebador directo OLI-1 5'-GGG GGT AGC TTG CTA CCT GCC-3'
Cebador reverso Y-2 5'-CCC ACT GCT GCC TCC CGT AGG AGT-3'
Tamaño esperado del amplicón de los moldes de ADN de R. solanacearum = 288 pb.
1.2 Mezcla para la reacción PCR
| Reactivo | Cantidad por reacción | Concentración final |
|---|---|---|
| Agua ultrapura estéril | 17,65 µl | |
| 10x tampón PCR (1) (15 mM MgCl2) | 2,5 µl | 1x (1,5 mM MgCl2) |
| Mezcla dNTP (20 mM) | 0,25 µl | 0,2 mM |
| Cebador OLI-1 (20 µM) | 1,25 µl | 1µM |
| Cebador Y-2 (20 µM) | 1,25 µl | 1µM |
| Polimerasa Taq (5 U/µl) (1) | 0,1 µl | 0,5 U |
| Volumen de muestra | 2,0 µl | |
| Volumen total | 25 µl |
(1) El método se validó utilizando polimerasa Taq de Perkin Elmer (AmpliTaq) y Gibco BRL.
1.3 Condiciones de reacción PCR
Aplicar el siguiente programa:
1 ciclo de:
i) 2 minutos a 96°C (desnaturalización del molde de ADN)
35 ciclos de:
ii) 20 segundos a 94°C (desnaturalización del molde de ADN)
iii) 20 segundos a 68°C (hibridación de los cebadores)
iv) 30 segundos a 72°C (extensión de la copia)
1 ciclo de:
v) 10 minutos a 72°C (extensión final)
vi) mantener a 4°C
Nota: Este programa se optimizó para utilizarlo con un termociclador Perkin Elmer 9600. Puede ser preciso modificar la duración de los ciclos ii), iii) y iv) para su utilización con otros modelos.
1.4 Análisis de la enzima de restricción del amplicón
Los productos PCR amplificados a partir de ADN de R. solanacearum producen un polimorfismo de la longitud del fragmento de restricción característico con la enzima Ava II tras la incubación a 37°C.
2 Protocolo PCR de Pastrik y Maiss (2000)
2.1 Cebadores del oligonucleótido
Cebador directo Ps-1 5'- agt cga acg gca gcg ggg g -3'
Cebador reverso Ps-2 5'- ggg gat ttc aca tcg gtc ttg ca -3'
Tamaño esperado del amplicón de los moldes de ADN de R.solanacearum = 553 pb.
2.2 Mezcla para la reacción PCR.
| Reactivo | Cantidad por reacción | Concentración final |
|---|---|---|
| Agua ultrapura estéril | 16,025 µl | |
| 10x tampón PCR (1) | 2,5 µl | 1x (1,5 mM MgCl2) |
| BSA (fracción V) (10%) | 0,25 µl | 0,1% |
| Mezcla d-nTP (20 mM) | 0,125 µl | 0,1 mM |
| Cebador Ps-1 (10 µM) | 0,5 µl | 0,2 µM |
| Cebador Ps-2 (10 µM) | 0,5 µl | 0,2 µM |
| Polimerasa Taq (5 U/µl) (1) | 0,1 µl | 0,5 U |
| Volumen de muestra | 5,0 µl | |
| Volumen total | 25,0 µl |
(1) Los métodos se validaron utilizando polimerasa Taq de Perkin Elmer (AmpliTaq) y Gibco BRL.
Nota: Originalmente optimizado para termociclador MJ Research PTC 200 con polimerasa Gibco Taq.
También pueden utilizarse Perkin Elmer AmpliTaq y tampón con las mismas concentraciones.
2.3 Condiciones de reacción PCR
Aplicar el siguiente programa:
1 ciclo de:
i) 5 minutos a 95°C (desnaturalización del molde de ADN)
35 ciclos de:
ii) 30 segundos a 95°C (desnaturalización del molde de ADN)
iii) 30 segundos a 68°C (hibridación de los cebadores)
iv) 45 segundos a 72°C (extensión de la copia)
1 ciclo de:
v) 5 minutos a 72°C (extensión final)
vi) mantener a 4°C.
Nota: Este programa está optimizado para utilizarlo con un termociclador MJ Research PTC 200. Puede ser preciso modificar la duración de los ciclos ii), iii) y iv) para su utilización con otros modelos.
2.4 Análisis de la enzima de restricción del amplicón
Los productos PCR amplificados a partir de ADN de R. solanacearum producen un polimorfismo de la longitud del fragmento de restricción característico con la enzima Taq I tras la incubación a 65°C durante 30 minutos. Los fragmentos de restricción obtenidos a partir del fragmento específico de R. solanacearum tienen un tamaño de 457 pb y 96 pb.
3. Protocolo PCR multiplex con control PCR interno (Pastrik et al., 2002)
3.1 Cebadores del oligonucleótido
Cebador directo RS-1-F 5'- ACT AAC GAA GCA GAG ATG CAT TA -3'
Cebador reverso RS-1-R 5'- CCC AGT CAC GGC AGA GAC T -3'
Cebador directo NS-5-F 5'- AAC TTA AAG GAA TTG ACG GAA G -3'
Cebador reverso NS-6-R 5'- GCA TCA CAG ACC TGT TAT TGC CTC -3'
Tamaño esperado del amplicón de los moldes de ADN de R. solanacearum = 718 pb (conjunto de cebadores RS).
Tamaño esperado del amplicón de control PCR interno 18S rARN = 310 pb (conjunto de cebadores NS).
3.2 Mezcla para la reacción PCR
| Reactivo | Cantidad por reacción | Concentración final |
|---|---|---|
| Agua ultrapura estéril | 12,625 µl | |
| 10x tampón PCR (1) (15 mM MgCl2) | 2,5 µl | 1x (1,5 mM MgCl2) |
| BSA (fracción V) (10 %) | 0,25 µl | 0,1% |
| Mezcla d-nTP (20 mM) | 0,125 µl | 0,1 mM |
| Cebador RS-1-F (10 µM) | 2,0 µl | 0,8 µM |
| Cebador RS-1-R (10 µM) | 2,0 µl | 0,8 µM |
| Cebador NS-5-F (10 µM) (2) | 0,15 µl | 0,06 µM |
| Cebador NS-6-R (10 µM) (2) | 0,15 µl | 0,06 µM |
| Polimerasa Taq (5 U/µl) (1) | 0,2 µl | 1,0 U |
| Volumen de muestra | 5,0 µl | |
| Volumen total | 25,0 µl |
(1) Los métodos se validaron utilizando polimerasa Taq de Perkin Elmer (AmpliTaq) y Gibco BRL.
(2) La concentración de los cebadores NS-5-F y NS-6-R se optimizó para la extracción de cuñas basales de patata utilizando el método de homogeneización y purificación del ADN de acuerdo con Pastrik (2000) (véase la sección VI.A.6.1.a). Será necesario proceder a la reoptimización de las concentraciones de reactivos si se utilizan la extracción por agitación u otros métodos de aislamientodel ADN.
3.3 Condiciones de reacción PCR
Aplicar el siguiente programa:
1 ciclo de:
i) 5 minutos a 95°C (desnaturalización del molde de ADN)
35 ciclos de:
ii) 30 segundos a 95°C (desnaturalización del molde de ADN)
iii) 30 segundos a 58°C (hibridación de los cebadores)
iv) 45 segundos a 72°C (extensión de la copia)
1 ciclo de:
v) 5 minutos a 72°C (extensión final)
vi) mantener a 4°C.
Nota: Este programa está optimizado para utilizarlo con un termociclador MJ Research PTC 200. Puede ser preciso modificar la duración de los ciclos ii), iii) y iv) para su utilización con otros modelos.
3.4 Análisis de la enzima de restricción del amplicón
Los productos PCR amplificados a partir de ADN de R. solanacearum producen un polimorfismo de la longitud del fragmento de restricción característico con la enzima Bsm I o un Isoschizomere (por ejemplo, Mva 1269 I) tras la incubación a 65°C durante 30 minutos.
4. Protocolo PCR específico del biovar de R. solanacearum (Pastrik et al, 2001)
4.1 Cebadores del oligonucleótido
Cebador directo Rs-1-F 5'- ACT AAC GAA GCA GAG ATG CAT TA -3'
Cebador reverso Rs-1-R 5'- CCC AGT CAC GGC AGA GAC T -3'
Cebador reverso Rs-3-R 5'- TTC ACG GCA AGA TCG CTC -3'
Tamaño esperado del amplicón de los moldes de ADN de R. solanacearum:
con Rs-1-F/Rs-1-R = 718 pb
con Rs-1-F/Rs-3-R = 716 pb.
4.2 Mezcla para la reacción PCR
a) Biovar 1/2 específico PCR
| Reactivo | Cantidad por reacción | Concentración final |
|---|---|---|
| Agua ultrapura estéril | 12,925 µl | |
| 10X tampón PCR (1) | 2,5 µl | 1x (1,5 mM MgCl2) |
| BSA (fracción V) (10%) | 0,25 µl | 0,1% |
| Mezcla d-NTP (20 mM) | 0,125 µl | 0,1 mM |
| Cebador Rs-1-F (10 µM) | 2 µl | 0,8 µM |
| Cebador Rs-1-R (10 µM) | 2 µl | 0,8 µM |
| Polimerasa Taq (5 U/µl) (1) | 0,2 µl | 1 U |
| Volumen de muestra | 5,0 µl | |
| Volumen total | 25,0 µl |
(1) Los métodos se validaron utilizando polimerasa Taq de Perkin Elmer (AmpliTaq) y Gibco BRL.
b) Biovar 3/4/5 específico PCR
| Reactivo | Cantidad por reacción | Concentración final |
|---|---|---|
| Agua ultrapura estéril | 14,925 µl | |
| 10X tampón PCR (1) | 2,5 µl | 1x (1,5 mM MgCl2) |
| BSA (fracción V) (10%) | 0,25 µl | 0,1% |
| Mezcla dNTP (20 mM) | 0,125 µl | 0,1 mM |
| Cebador Rs-1-F (10 µM) | 1 µl | 0,4 µM |
| Cebador Rs-3-R (10 µM) | 1 µl | 0,4 µM |
| Polimerasa Taq (5 U/µl) (1) | 0,2 µl | 1 U |
| Volumen de muestra | 5,0 µl | |
| Volumen total | 25,0 µl |
(1) Los métodos se validaron utilizando polimerasa Taq de Perkin Elmer (AmpliTaq) y Gibco BRL.
4.3 Condiciones de reacción PCR
Aplicar el siguiente programa a las reacciones específicas de biovar 1/2 y biovar 3/4/5:
1 ciclo de:
i) 5 minutos a 95°C (desnaturalización del molde de ADN)
35 ciclos de:
ii) 30 segundos a 95°C (desnaturalización del molde de ADN)
iii) 30 segundos a 58°C (hibridación de los cebadores)
iv) 45 segundos a 72°C (extensión de la copia)
1 ciclo de:
v) 5 minutos a 72°C (extensión final)
vi) mantener a 4°C.
Nota: Este programa se optimizó para utilizarlo con un termociclador MJ Research PTC 200. Puede ser preciso modificar la duración de los ciclos ii), iii) y iv) para su utilización con otros modelos.
4.4 Análisis de la enzima de restricción del amplicón
Los productos PCR amplificados a partir de ADN de R. solanacearum utilizando cebadores Rs-1-F y Rs-1-R producen un polimorfismo de la longitud del fragmento de restricción característico con la enzima Bsm I o un Isoschizomere (por ejemplo, Mva 1269 I) tras la incubación a 65°C durante 30 minutos. Los productos PCR amplificados a partir de ADN de R. solanacearum utilizando los cebadores Rs-1-F y Rs-3R no poseen sitios de restricción.
5. Preparación del tampón de carga
5.1 Azul de bromofenol (solución estándar al 10%)
Azul de bromofenol: 5 g.
Agua bidestilada: 50 ml.
5.2 Tampón de carga
Glicerol (86 %): 3,5 ml.
Azul de bromofenol (5,1) : 300 µl.
Agua bidestilada: 6,2 ml.
6. 10X tampón de tris acetato EDTA (TAE), pH 8,0
Tampón tris: 48,40 g.
Ácido acético glacial: 11,42 ml.
EDTA (sal disódica) : 3,72 g.
Agua destilada: 1,00 l.
Diluir a 1X antes de utilizarlo.
Se encuentra también disponible en el mercado (por ejemplo, Invitrogen o equivalente).
Apéndice 7
Reactivos validados para la prueba FISH
1. Oligosondas
Sonda específica para R. solanacearum OLI-1-CY3:
5'- GGC AGG TAG CAA GCT ACC CCC-3'
Sonda eubacteriana no específica EUB-338-FITC:
5'- GCT GCC TCC CGT AGG AGT -3'
2. Solución fijadora
¡ADVERTENCIA! LA SOLUCIÓN FIJADORA CONTIENE PARAFORMALDEHÍDO QUE ES TÓXICO. UTILIZAR GUANTES Y NO INHALAR. SE RECOMIENDA TRABAJAR EN UNA CAMPANA EXTRACTORA DE GASES.
i) Calentar 9 ml de agua de grado molecular, por ejemplo agua ultrapura, a 60°C aproximadamente y añadir 0,4 g de paraformaldehído. El paraformaldehído se disuelve cuando se añaden 5 gotas de 1N NaOH y se remueve con un agitador magnético.
ii) Ajustar el pH a 7,0 mediante la adición de 1 ml de tampón de fosfato de concentración 0,01 M y 5 gotas de 1N HCl. Verificar el pH con bandas indicadoras y ajustar si fuese necesario con HCl o NaOH. ¡ADVERTENCIA! NO UTILIZAR UN MEDIDOR DE PH EN SOLUCIONES QUE CONTENGAN PARAFORMALDEHÍDO.
iii) Filtrar la solución con un filtro de membrana de 0,22µm y mantener libre de polvo a 4°C hasta nueva utilización.
3. 3X Hybmix
NaCl: 2,7 M.
Tris-HCl: 60 mM (pH 7,4).
EDTA (filtro esterilizado con autoclave): 15 mM.
Diluir a 1X como se precisa.
4. Solución de hibridación
1X Hybmix.
Dodecilsulfato sódico (SDS): 0,01%.
Formamida: 30%.
Sonda EUB 338: 5 ng/µl.
Sonda OLI-1 o OLI-2: 5 ng/µl.
Preparar las cantidades de solución de hibridación de acuerdo con los cálculos de la tabla 1. Para cada portaobjetos (que contenga dos muestras distintas por duplicado) se precisan 90 µl de solución de hibridación. IMPORTANTE: DEBE TENERSE EN CUENTA QUE LA FORMAMIDA ES MUY TÓXICA, POR LO QUE DEBEN UTILIZARSE GUANTES Y TOMARSE LAS PRECAUCIONES DE SEGURIDAD NECESARIAS.
Tabla 1: Cantidades sugeridas para la preparación de la mezcla de hibridación
| Número de portaobjetos | 1 | 4 | 6 | 8 | 10 |
|---|---|---|---|---|---|
| Agua ultrapura estéril | 23,1 | 92,4 | 138,6 | 184,8 | 231,0 |
| 3X hybmix | 30,0 | 120,0 | 180,0 | 240,0 | 300,0 |
| SDS al 1% | 0,9 | 3,6 | 5,4 | 7,2 | 9,0 |
| Formamida | 27,0 | 108,0 | 162,0 | 216,0 | 270,0 |
| Sonda EUB 338 (100 ng/µl) | 4,5 | 18,0 | 27,0 | 36,0 | 45,0 |
| Sonda OLI-1 u OLI-2 (100 ng/µl) | 4,5 | 18,0 | 27,0 | 36,0 | 45,0 |
| Volumen total (µl) | 90,0 | 360,0 | 540,0 | 720,0 | 900,0 |
Nota: Almacenar todas las soluciones que contengan oligosondas fotosensibles en la oscuridad a –20°C.
Proteger de la luz del sol o eléctrica directa durante su utilización.
5. Tampón fosfato 0,1 M, pH 7,0
Na2HPO4: 8,52 g.
KH2PO4: 5,44 g.
Agua destilada: 1,00 l.
Disolver los ingredientes, verificar el pH y esterilizar en autoclave a 121°C durante 15 minutos.
Apéndice 8
Condiciones de cultivo para el tomate y la berenjena
Sembrar semillas de tomate (Lycopersicon esculentum) o berenjena (Solanum melongena) en compost pasteurizado de semillas. Trasplantar las plántulas con los cotiledones completamente abiertos (10 a 14 días) en compost pasteurizado de tiesto.
Las berenjenas o tomates deben cultivarse en un invernadero que cumpla las siguientes condiciones medioambientales antes de la inoculación:
Duración diurna: 14 horas o día natural si es de mayor duración
Temperatura:
diurna: 21 a 24°C.
nocturna:14 a 18°C.
Variedad de tomate sensible: ‘Moneymaker’.
Variedad de berenjena sensible:‘Black Beauty’.
Proveedores: véase el sitio web: http://forum.europa.eu.int/ Public/irc/sanco/Home/main.
REFERENCIAS
1. Amann, R.I., L. Krumholz and D.A. Stahl. 1990. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic and environmental studies in microbiology. J. Bacteriol. 172: 762-770.
2. Anon. 1998. Council Directive 98/57/EC of 20 July 1998 on the control of Ralstonia solanacearum (Smith) Yabuuchi et al. Official Journal of the European Communities L235, 1-39.
3. Boudazin, G., A.C. Le Roux, K. Josi, P. Labarre and B. Jouan. 1999. Design of division specific primers of Ralstonia solanacearum and application to the identification of European isolates. European Journal of Plant Pathology 105; 373-380.
4. Caruso, P., Gorris, M.T., Cambra, M., Palomo, J.L., Collar, J and Lopez, M.M. 2002. Enrichment Double-Antibody Sandwich Indirect Enzyme-Linked Immunosorbent Assay That Uses a Specific Monoclonal Antibody for sensitive Detection of Ralstonia solanacearum in Asymptomatic Potato Tubers. Applied and Environmental Microbiology, 68, 36343638.
5. Cook, D., Barlow, E. and Sequeira, L. 1989. Genetic diversity of Pseudomonas solanacearum: detection of restriction fragment length polymorphisms with DNA probes that specify virulence and the hypersensitive response. Molecular Plant-Microbe Interactions 1:113-121.
6. Elphinstone, J.G., Hennessy, J., Wilson, J.K. and Stead, D.E. 1996. Sensitivity of detection of Ralstonia solanacearum in potato tuber extracts. EPPO Bulletin 26; 663678.
7. Englebrecht, M.C. (1994) Modification of a semiselective medium for the isolation and quantification of Pseudomonas solanacearum. In: A.C. Hayward (ed.) Bacterial Wilt Newsletter 10, 3-5. Australian Centre for International Agricultural Research, Canberra, Australia.
8. Hayward, A.C. 1964. Characteristics of Pseudomonas solanacearum. Journal of Applied Bacteriology 27; 265277.
9. Hayward, A.C., El-Nashaar, H.M., Nydegger, U. and De Lindo, L. 1990. Variation in nitrate metabolism in biovars of Pseudomonas solanacearum. Journal of Applied Bacteriology 69; 269-280.
10. Ito, S., Y. Ushijima, T. Fujii, S. Tanaka, M. KameyaIwaki, S. Yoshiwara and F. Kishi. 1998. Detection of viable cells of Ralstonia solanacearum in soil using a semi-selective medium and a PCR technique. J. Phytopathology 146; 379384.
11. Janse, J.D. (1988) A detection method for Pseudomonas solanacearum in symptomless potato tubers and some data on its sensitivity and specificity. Bulletin OEPP/EPPO Bulletin 18, 343-351.
12. Janse, J.D. 1991. Infraand intra-specific classification of Pseudomonas solanacaerum strains using whole cell fatty-acid analysis. Systematic and Applied Microbiology 14; 335-345.
13. Kelman, A. 1954. The relationship of pathogenicity of Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology 44; 693-695.
14. Klement Z.; Rudolph, K and D.C. Sands, 1990. Methods in Phytobacteriology. Akadémiai Kiadó, Budapest, 568 pp.
15. Lelliott, R.A. and Stead, D.E. 1987. Methods for the diagnosis of bacterial diseases of plants. Blackwell scientific Publications Ltd., Oxford. 216 pp.
16. López, M.M., Gorris, M.T., Llop, P., Cubero, J., Vicedo, B., Cambra, M., 1997. Selective enrichment improves selective isolation, serological and molecular detection of plant pathogenic bacteria. In: H.W. Dehne et al., (eds). Klewer Academic Publishers. pp. 117-121.
17. Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J., 1994. Specific genomic fingerprints of phytopathogenic Xanthomonas and Pseudomonas pathovars and strains generated with repetitive sequences and PCR. Applied and Environmental Microbiology, 60, 2286-2295.
18. Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J. 1995. Differentiation of genomic structure by repPCR fingerprinting to rapidly classify Xanthomonas campestris pv. vesicatoria. Phytopathology 85; 528-536.
19. Opina, N., F. Tavner, G. Holloway, J.-F Wang, T.-H Li, R. Maghirang, M. Fegan, A.C. Hayward, V. Krishnapillai, W.F. Hong, B.W. Holloway, J.N. Timmis. 1997. A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (formerly Pseudomonas solanacearum). As Pac. J. Mol. Biol. Biotechnol. 5; 19-33.
20. Pastrik, K.H. and Maiss, E. 2000. Detection of R. solanacearum in potato tubers by polymerase chain reaction. J. Phytopathology 148; 619-626.
21. Pastrik, K.H., Elphinstone, J.G. and Pukall, R. 2002. Sequence analysis and detection of Ralstonia solanacearum by multiplex PCR amplification of 16S-23S ribosomal intergenic spacer region with internal positive control. European Journal of Plant Pathology 108, 831-842.
22. Robinson-Smith, A., Jones, P., Elphinstone, J.G. and Forde, S.M.D. (1995) Production of antibodies to Pseudomonassolanacearum, the causative agent of bacterial wilt. Food and Agricultural Immunology 7, 67-79.
23. Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. 3. ed.; St. Paul, Minnesota: 373 pp.
24. Seal, S.E., L.A. Jackson, J.P.W. Young, and M.J. Daniels. 1993. Detection of Pseudomonas solanacearum, Pseudomonas syzygii, Pseudomonas pickettii and Blood Disease Bacterium by partial 16S rRNA sequencing: construction of oligonucleotide primers for sensitive detection by polymerase chain reaction. J. Gen. Microbiol. 139: 15871594.
25. Smith, J.J., Offord, L.C., Holderness, M. and Saddler, G.S. 1995. Genetic diversity of Burkholderia solanacearum (synonymPseudomonas solanacearum) race 3 in Kenya. Applied and Environmental Microbiology 61; 4262-4268.
26. Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295.
27. Taghavi, M., Hayward, A.C., Sly, L.I., Fegan, M. 1996. Analysiss of the phylogenetic relationships of strains of Burkholderia solanacearum, Pseudomonas syzygii, and the blood disease bacterium of banana based on 16S rRNA gene sequences. International Journal of Systematic Bacteriology 46; 10-15.
28. Van Der Wolf, J.M., Bonants, P.J.M., Smith, J.J., Hagenaar, M., Nijhuis, E., Van Beckhoven, J.R.C., Saddler, G.S., Trigalet, A., Feuillade, R. 1998. Genetic diversity of Ralstonia solanacearum Race 3 in Western Europe as determined by AFLP, RC-PFGE and rep-PCR. In: Prior, P., Allen, C. and Elphinstone, J. (eds.) Bacterial wilt disease: Molecular and Ecological Aspects. Springer (Berlin) pp. 4449.
29. Weller, S.A., Elphinstone, J.G., Smith, N., Stead, D.E. and Boonham, N. 1999. Detection of Ralstonia solanacearum strains using an automated and quantitative flourogenic 5’ nuclease TaqMan assay. Applied and Environmental Microbiology 66; 2853-2858.
30. Wullings, B.A., A.R. van Beuningen, J.D. Janse and A.D.L. Akkermans. 1998. Detection of R. solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64: 4546-4554.
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
[Bloque 24: #ai-3]
1. En cada caso de foco sospechoso para el que se haya realizado una o varias pruebas de selección con resultados positivos de acuerdo con los métodos establecidos en el anexo II para el material vegetal enumerado y para todos los otros casos, y se espere recibir confirmación o refutación por aplicación de los citados métodos, se deberá proceder a la retención y adecuada conservación, hasta completar los métodos mencionados, de:
– todos los tubérculos de los que se hayan obtenido muestras y, siempre que sea posible, todas las plantas de las que se hayan obtenido muestras,
– cualquier extracto sobrante y cualquier material adicional que se haya preparado para la prueba o pruebas de selección, como por ejemplo placas de inmunofluorescencia, y
– toda la documentación pertinente.
La retención de los tubérculos permitirá que se puedan llevar a cabo pruebas de variedades cuando se estime oportuno.
2. En el caso de confirmación de la presencia del organismo, se procederá a la retención y adecuada conservación hasta un mes después, como mínimo, en virtud del procedimiento establecido en el artículo 6, apartado 2:
– del material especificado en el punto 1, y
– de una muestra de las berenjenas o los tomates infectados inoculados con extracto de tubérculo o de planta, cuando sea adecuado, y
– del cultivo aislado del organismo.
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
[Bloque 25: #ai-4]
Los elementos de la investigación que dispone el artículo 6, apartado 1, letra a), inciso i), serán, cuando proceda, los siguientes:
i) lugares de producción:
– en los que se estén cultivando o se hayan cultivado patatas que estén relacionadas clónicamente con aquellas en las que se haya comprobado la infección por el organismo,
– en los que se estén cultivando o se hayan cultivado tomates que procedan de las mismas fuentes que aquellos en los que se haya comprobado la infección por el organismo,
– en los que se estén cultivando o se hayan cultivado patatas o tomates que se hayan puesto bajo control oficial por sospecharse la presencia del organismo,
– en los que se estén cultivando o se hayan cultivado patatas que estén relacionadas clónicamente con las que hayan sido cultivadas en lugares de producción de los que se sospeche la infección por el organismo,
– en los que se cultiven patatas o tomates y que estén localizados en las proximidades de los lugares de producción infectados, incluidos aquellos en los que se compartan equipos e instalaciones de producción directamente o por intervención de un contratista común,
– en los que se utilicen para las labores de riego o rociamiento aguas de superficie de cualquier fuente en la que se haya confirmado o de la que se sospeche la infección por el organismo,
– en los que se utilicen para las labores de riego o rociamiento aguas de superficie de una fuente explotada en común con lugares de producción en los que se haya confirmado o de los que se sospeche la infección por el organismo,
– que estén o hayan sido anegados con aguas de superficie en las que se haya confirmado o de las que se sospeche la infección por el organismo, y
ii) las aguas de superficie que se utilicen para el riego o rociamiento, o para la anegación, de un campo o campos o de un lugar o lugares de producción en los que se haya confirmado la infección
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
[Bloque 26: #av]
1. Al determinar, con arreglo al artículo 6, apartado 1, letra a), inciso iii), y al artículo 6, apartado 1, letra c), inciso iii), el alcance de la contaminación probable, se incluirán los elementos siguientes:
– el material vegetal indicado obtenido en un lugar de producción que haya sido declarado contaminado en virtud del artículo 6, apartado 1, letra a), inciso ii),
– el lugar o lugares de producción que tengan una relación de producción con el material vegetal indicado que haya sido declarado contaminado en virtud del artículo 6, apartado 1, letra a), inciso ii), incluidos aquellos lugares que compartan equipos e instalaciones de producción directamente o por intervención de un contratista común,
– el material vegetal indicado que se haya producido en el lugar o lugares de producción contemplados en el guión anterior o que estuviera presente en tales lugares durante el tiempo en que el material vegetal indicado declarado contaminado en virtud del artículo 6, apartado 1, letra a), inciso ii), se hallara presente en el lugar de producción mencionado en el primer guión,
– las instalaciones que hayan manipulado el material vegetal indicado procedente de los lugares de producción a los que se refieren los guiones anteriores,
– cualquier maquinaria, vehículo, buque, almacén o unidades de estos y cualesquiera otros objetos, incluido el material de embalaje, que puedan haber estado en contacto con el material vegetal indicado declarado contaminado en virtud del artículo 6, apartado 1, letra a), inciso ii),
– cualquier material vegetal indicado que haya sido almacenado o haya estado en contacto con cualquiera de las estructuras y los objetos mencionados en el guión anterior antes de la limpieza y desinfección de estos,
– como resultado de la investigación y de los análisis contemplados en el artículo 6, apartado 1, letra a), inciso i), en el caso de las patatas, aquellos tubérculos o plantas que tengan una relación clonal fraterna o parental y, en el caso del tomate, aquellas plantas que procedan de las mismas fuentes que el material vegetal indicado declarado contaminado en virtud del artículo 6, apartado 1, letra a), inciso ii), y para las cuales, aunque las pruebas de detección del organismo hayan sido negativas, parezca probable la contaminación a través de un vínculo clonal. Puede efectuarse una prueba de variedades para verificar la identidad de los tubérculos o plantas contaminados que estén relacionados clónicamente,
– el lugar o lugares de producción del material vegetal indicado a que se refiere el guión anterior,
– el lugar o lugares de producción del material vegetal indicado en los que se utilicen para las labores de riego o rociamiento aguas que hayan sido declaradas contaminadas en virtud del artículo 6, apartado 1, letra c), inciso ii),
– el material vegetal indicado producido en campos anegados con aguas de superficie en las que se haya confirmado la contaminación.
2. Para la determinación de la posible propagación a la que se refieren el artículo 6, apartado 1, letra a), inciso iv), y el artículo 6, apartado 1, letra c), inciso iii), deberán tenerse en cuenta los elementos siguientes:
i) en los casos previstos en el artículo 6, apartado 1, letra a), inciso iv):
– la proximidad de otros lugares de producción en los que se cultive el material vegetal indicado,
– la producción y utilización comunes de existencias de patatas de siembra,
– los lugares de producción en los que se utilicen aguas de superficie para el riego o rociamiento del material vegetal indicado cuando exista o haya existido el riesgo de escorrentía, o de anegamiento, de aguas superficiales procedentes de un lugar o lugares de producción que hayan sido declarados contaminados en virtud del artículo 6, apartado 1, letra a), inciso ii),
ii) en los casos en que se hayan declarado contaminadas aguas de superficie en virtud del artículo 6, apartado 1, letra c), inciso ii):
– el lugar o lugares productores del material vegetal indicado contiguos a las aguas superficiales declaradas contaminadas, o que corran el riesgo de ser anegados por estas aguas,
– cualquier fuente de riego separada que se comunique de alguna forma con las aguas superficiales declaradas contaminadas,
– masas de agua conectadas con el agua superficial declarada contaminada, teniendo en cuenta:
• la dirección y el nivel de flujo del agua declarada contaminada,
• la presencia de solanáceas silvestres huésped.
3. La notificación a la que se refiere el artículo 6, apartado 2, deberá:
– efectuarse de manera inmediata una vez que la presencia del organismo haya sido confirmada por las pruebas de laboratorio con arreglo a los métodos expuestos en el anexo II, y deberá recoger, como mínimo:
• para las patatas:
a) el nombre de la variedad del lote,
b) el tipo (de consumo, de siembra, etc.) y, en su caso, la categoría de siembra,
• para las tomateras: el nombre de la variedad del lote y, en su caso, la categoría,
– sin perjuicio de los requisitos de notificación de la sospecha de la presencia del organismo previstos en el artículo 5, apartado 3:
• la Comunidad Autónoma en la que se haya confirmado la presencia del organismo, cuando exista un riesgo de contaminación del material vegetal indicado hacia otra u otras Comunidades Autónomas, transmitirá inmediatamente a las Comunidades Autónomas afectadas la información necesaria para cumplir el artículo 6, apartado 3, que incluye:
a) el nombre de la variedad del lote de patatas o tomates,
b) el nombre y la dirección del expedidor y del destinatario,
c) la fecha de entrega del lote de patatas o tomates,
d) el tamaño del lote de patatas o tomates entregado,
e) una copia del pasaporte fitosanitario o, como mínimo, de su número, cuando sea apropiado o, en su caso, el número de registro del productor o comerciante y una copia del aviso de entrega.
Cuando se suministre dicha información, la Comunidad Autónoma informará de ello inmediatamente al Ministerio de Agricultura, Pesca y Alimentación.
• la Comunidad Autónoma en la que se haya confirmado la presencia del organismo, cuando exista el riesgo de contaminación del material vegetal indicado hacia otro u otros Estados Miembros, transmitirá inmediatamente al Ministerio de Agricultura, Pesca y Alimentación y este a su vez, a través del cauce correspondiente a los Estados Miembros afectados la información necesaria para, cumplir el artículo 6, apartado 3, que incluye:
a) el nombre de la variedad del lote de patatas o tomates,
b) el nombre y la dirección del expedidor y del destinatario,
c) la fecha de entrega del lote de patatas o tomates,
d) el tamaño del lote de patatas o tomates entregado,
e) una copia del pasaporte fitosanitario o, como mínimo, de su número, cuando sea apropiado o, en su caso, el número de registro del productor o comerciante y una copia del aviso de entrega.
Cuando se suministre dicha información, el Ministerio de Agricultura, Pesca y Alimentación informará de ello inmediatamente a la Comisión.
• cuando exista el riesgo de contaminación del material vegetal indicado procedentes de otro u otros Estados Miembros a raíz de la correspondiente notificación o notificaciones de los mismos, el Ministerio de Agricultura, Pesca y Alimentación comunicará la información recibida a las Comunidades Autónomas interesadas para, cumplir el artículo 6, apartado 3.
4. Cuando hayan finalizado todas las investigaciones, y al objeto de posibilitar la notificación adicional (complementaria), las comunidades autónomas facilitarán, para cada caso:
a) la fecha en la que se confirmó la contaminación;
b) una breve descripción de la investigación llevada a cabo para identificar la fuente y posible propagación de la contaminación, incluido el nivel de muestreo efectuado;
c) información sobre la fuente o fuentes de contaminación determinadas o presuntas;
d) detalles relativos al alcance de la contaminación declarada, incluido el número de lugares de producción y, en el caso de las patatas, el número de lotes, con la indicación de la variedad y, en el caso de las patatas de siembra, la categoría;
e) detalles relativos a la delimitación de la zona, incluido el número de lugares de producción no declarados contaminados pero incluidos en la zona;
f) detalles relativos a la designación del agua, incluido el nombre y la ubicación de la masa de agua y el alcance de la prohibición de riego/designación;
g) en el caso de cualquier partida o lote de tomateras declarado como contaminado, los certificados prescritos en el artículo 10, apartado 1, letra a), del Real Decreto 58/2005, de 21 de enero, por el que se adoptan medidas de protección contra la introducción y difusión en el territorio nacional y de la Comunidad Europea de organismos nocivos para los vegetales o productos vegetales, así como para la exportación y tránsito hacia países terceros, y el número de pasaporte, de acuerdo con la lista que se recoge en el anexo V, parte A, sección I, punto 2.2, del Real Decreto 58/2005, de 21 de enero.
h) cualesquiera otros datos que requiera el Ministerio de Agricultura, Pesca y Alimentación o, en su caso, la Comisión relativos al brote o los brotes confirmados.
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
[Bloque 27: #av-2]
1. Las disposiciones mencionadas en el artículo 7, apartado 1, serán las siguientes:
– la utilización como piensos, previo tratamiento térmico adecuado, de forma que no haya riesgo alguno de supervivencia del organismo,
o
– la eliminación en un vertedero de eliminación de residuos autorizado oficialmente en donde no exista ningún riesgo identificable de escape del organismo al medio ambiente, por ejemplo, a través de filtración a tierras agrícolas ni de contacto con fuentes de agua que puedan utilizarse para el riego de dichas tierras,
o
– la incineración,
o
– la transformación industrial mediante entrega directa e inmediata a una planta de transformación dotada de instalaciones de eliminación de residuos autorizadas oficialmente, para las que se establezca la ausencia de riesgos detectables de propagación del organismo, y de un sistema de limpieza y desinfección de los vehículos de transporte, al menos,
u
– otras medidas, siempre que se descarte el posible riesgo de propagación del organismo; dichas medidas y su justificación se notificarán inmediatamente al Ministerio de Agricultura, Pesca y Alimentación y este a su vez, a través del cauce correspondiente, a la Comisión y a los demás Estados miembros.
Cualquier residuo restante asociado con las opciones anteriores y derivado de ellas se eliminará con métodos autorizados oficialmente de conformidad con el anexo VII de este real decreto.
2. El uso adecuado o la eliminación del material vegetal indicado dispuestos en el artículo 7, apartado 2, deberán efectuarse bajo el control de los organismos oficiales responsables interesados, así como con la oportuna comunicación entre estos organismos para garantizar en todo momento dicho control, y con la aprobación del organismo oficial responsable de la Comunidad Autónoma donde vayan a envasarse o transformarse las patatas, en lo que se refiere a los vertederos citados en los guiones primero y segundo, y consistirán en lo siguiente:
i) en el caso de los tubérculos de patata:
– la utilización como patatas de consumo destinadas al consumo, envasadas para su distribución y venta directa sin cambio de envase, en un lugar dotado de instalaciones de eliminación de residuos adecuadas. Las patatas destinadas a la siembra sólo pueden manipularse en el mismo lugar si esto se realiza separadamente o tras la limpieza y desinfección,
o
– su uso como patatas de consumo para la transformación industrial y destinadas a la entrega directa e inmediata a una planta de transformación dotada de instalaciones de eliminación de residuos adecuadas y de un sistema de limpieza y desinfección de los vehículos de transporte, al menos,
o
– algún otro tipo de uso o eliminación, siempre que se establezca que no existe ningún riesgo identificable de propagación del organismo, y previa aprobación de los citados organismos oficiales responsables,
ii) en el caso de las otras partes de las plantas, incluidos los detritos del tallo y de las hojas,
– la destrucción,
o
– cualquier otro uso o eliminación, a condición de que se garantice que no existe riesgo identificable de dispersar el organismo, y previa aprobación de los citados organismos oficiales responsables.
3. Los métodos adecuados para la descontaminación de los objetos a los que se refiere el artículo 7, apartado 3, consistirán en una limpieza y, en su caso, una desinfección que permitan descartar todo riesgo identificable de propagación del organismo; estas operaciones se efectuarán bajo la supervisión de los organismos oficiales responsables de las Comunidades Autónomas.
4. La serie de medidas mencionadas en el artículo 7, apartado 4, que deberán aplicar las Comunidades Autónomas dentro de la zona o zonas delimitadas que se hayan establecido en virtud del artículo 6, apartado 1, letra a), inciso iv), y del artículo 6, apartado 1, letra c), inciso iii), serán las siguientes:
4.1 En los casos en que, en virtud del artículo 6, apartado 1, letra a), inciso ii), se hayan declarado contaminados lugares de producción, las medidas consistirán en lo siguiente:
a) en los campos o unidades de producción de cultivos protegidos que se hayan declarado contaminados en virtud de esa misma disposición:
i) durante al menos los cuatro años de cultivo siguientes a la declaración de la contaminación:
– se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas que puedan ser huésped del organismo, incluidas las malas hierbas solanáceas,
y
– no se plantarán:
• tubérculos, plantas ni semillas propiamente dichas de patata,
• tomateras y semillas de tomateras,
• teniendo en cuenta la biología del organismo.
• otras plantas huésped,
• plantas de especies de Brassica para las que exista un riesgo identificado de supervivencia del organismo,
• otros cultivos para los que exista un riesgo identificado de propagación del organismo,
– en la primera temporada de cultivo de patatas o tomates siguiente al período indicado en el guión anterior, y siempre que se haya comprobado que, durante al menos los dos años de vegetación inmediatamente, anteriores a la plantación, el campo estuvo libre de patatas y tomateras espontáneas y de otras plantas huésped del organismo, incluidas las malas hierbas solanáceas:
• en el caso de las patatas, solamente se autorizará la producción de patatas de consumo,
• en el caso de las patatas y los tomates, los tubérculos de patata cosechados, o las tomateras, según corresponda, serán analizados de conformidad con el procedimiento detallado en el anexo II,
– en la temporada de cultivo de patatas o tomates siguiente a la indicada en el guión anterior y tras un ciclo de rotación adecuado, que será de un mínimo de dos años si se cultivan patatas de siembra, se efectuará un examen oficial tal como se dispone el artículo 3, apartado 1,
o
ii) durante los cinco años de cultivo siguientes al de la declaración de la contaminación:
– se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas que puedan contener naturalmente el organismo, incluidas las malas hierbas solanáceas,
y
– durante los tres primeros años, se dejará y mantendrá el campo, bien en barbecho completo, bien para el cultivo de cereales, con arreglo al riesgo que se haya determinado, bien como pasto permanente, con siega intensa y frecuente o pastoreo intensivo, o bien como pastizal para la producción de semillas y, a continuación, en los dos años subsiguientes, se plantarán plantas que no sean huésped del organismo para las que no exista ningún riesgo identificado de supervivencia o propagación de este,
– en la primera temporada de cultivo de patatas o tomates siguiente al período indicado en el guión anterior y, siempre que se haya comprobado que, durante al menos los dos años de vegetación inmediatamente anteriores a la plantación, el campo estuvo libre de patatas y tomateras espontáneas y de otras plantas huésped del organismo, incluidas las malas hierbas solanáceas:
• en el caso de las patatas, se autorizará la producción de patatas de siembra y de consumo,
• los tubérculos de patata cosechados, o las tomateras, según corresponda, serán analizados de conformidad con el procedimiento detallado en el anexo II;
b) en el resto de los campos del lugar de producción contaminado y a condición de que los organismos oficiales competentes tengan la certeza de que se ha eliminado adecuadamente el riesgo de plantas de patata y de tomate espontáneas y de cualquier otra planta que pueda contener naturalmente el organismo, incluidas las malas hierbas solanáceas:
– durante el año de cultivo siguiente al de declaración de contaminación.
– o bien no se plantarán tubérculos, plantas ni semillas propiamente dichas de patata, ni cualquier otra planta que pueda contener naturalmente el organismo,
o
– en el caso de los tubérculos de patata, se podrá plantar patata de siembra oficialmente certificada, pero sólo para la producción de patata de consumo,
– en el caso de las tomateras, solamente se plantarán tomateras obtenidas de semillas que cumplan los requisitos de la Directiva 2000/29/CE del Consejo, de 8 de mayo de 2000, relativa a las medidas de protección contra la introducción en la Comunidad de organismos nocivos para los vegetales o productos vegetales y contra su propagación en el interior de la Comunidad, para la producción de fruto,
– durante el segundo año de cultivo siguiente al de declaración de contaminación.
– en el caso de las patatas, solamente se plantarán, para la producción de patatas de siembra o de consumo, patatas de siembra certificadas o patatas de siembra analizadas para determinar la inexistencia de podredumbre parda y cultivadas bajo control oficial en lugares de producción diferentes de los mencionados en el punto 4.1,
– en el caso de los tomates, solamente se plantarán tomateras obtenidas de semillas que cumplan los requisitos de la Directiva 2000/29/CE o, si se han propagado vegetativamente, de tomateras producidas a partir de esas semillas y cultivadas bajo control oficial en lugares de producción diferentes de los mencionados en el punto 4.1, para la producción de plantas o de fruto,
– durante al menos los tres años de cultivo siguientes a la declaración de la contaminación.
– en el caso de las patatas, se plantarán para la producción de patatas de siembra o de consumo exclusivamente patatas de siembra certificadas o patatas de siembra que se hayan cultivado bajo control oficial a partir de patatas de siembra certificadas,
– en el caso de los tomates, solamente se plantarán tomateras obtenidas de semillas que cumplan los requisitos de la Directiva 2000/29/CE o tomateras cultivadas bajo control oficial a partir de estas plantas, para la producción de plantas o de fruto,
– en cada uno de los años de cultivo mencionados en los guiones anteriores, se tomarán medidas para eliminar las plantas de patata espontáneas y otras plantas que puedan contener naturalmente el organismo, si existen, y se efectuará una inspección oficial del cultivo en crecimiento en los momentos pertinentes y, en cada campo de patatas, se efectuarán pruebas oficiales de las patatas cosechadas con arreglo al procedimiento detallado en el anexo II;
c) inmediatamente después de la declaración de contaminación prevista en el artículo 6, apartado 1, letra a), inciso ii), y tras el primer año de cultivo siguiente:
– toda la maquinaria e instalaciones de almacenamiento del lugar de producción que se utilicen en la producción de patatas o tomates se limpiarán y, en su caso, desinfectarán utilizando métodos adecuados de la forma que se dispone en el punto 3,
– con el fin de impedir la propagación del organismo, se efectuarán controles oficiales de los planes de riego y rociamiento y, en caso necesario, se prohibirán los mismos;
d) en el caso de las unidades de producción de cultivos protegidos que hayan sido declaradas contaminadas en virtud del artículo 6, apartado 1, letra a), inciso ii), y en las que sea posible una sustitución total de los medios de cultivo:
– no se plantarán tubérculos, plantas ni semillas propiamente dichas de patata, ni otras plantas que puedan ser huésped del organismo, incluidas tomateras y semillas de tomateras, a menos que, por una parte, la unidad de producción se haya sometido a medidas oficialmente supervisadas que, teniendo por objeto la eliminación del organismo y la retirada de todo el material vegetal huésped, incluyan, como mínimo, un cambio completo de los medios de cultivo y una limpieza y, en su caso, una desinfección de tales unidades y de todo el equipo y que, por otra parte, los organismos oficiales responsables hayan dado subsiguientemente su autorización para la producción de patatas o tomates,
y
– además, la producción procederá, en el caso de la patata, de patatas de siembra certificadas o de minitubérculos o microplantas obtenidos de fuentes analizadas,
– en cuanto a la producción de tomates, la producción deberá proceder de semillas que cumplan los requisitos de la Directiva 2000/29/CE o, si se han propagado vegetativamente, de tomateras producidas a partir de estas semillas y cultivadas bajo control oficial,
– con el fin de impedir la propagación del organismo, se efectuarán controles oficiales de los planes de riego y rociamiento y, en caso necesario, se prohibirán los mismos.
4.2 Dentro de la zona delimitada, y sin perjuicio de las medidas dispuestas en el punto 4.1, las Comunidades Autónomas:
a) inmediatamente después de la declaración de contaminación, garantizarán que se limpie y desinfecte toda la maquinaria e instalaciones de almacenamiento de la explotación que se hayan utilizado para la producción de patatas y tomates, como resulte adecuado y con los métodos apropiados, según lo dispuesto en el punto 3;
b) inmediatamente y durante al menos tres años de cultivo después de la declaración de contaminación:
ba) en los casos en que la delimitación de la zona se haya efectuado en virtud del artículo 6, apartado 1, letra a), inciso iv):
– garantizarán que sus organismos oficiales responsables supervisen las instalaciones que cultiven, almacenen o manipulen tubérculos de patata o tomates, así como aquellas otras instalaciones que utilicen en el marco de un contrato maquinaria para la producción de patatas o tomates,
– requerirán que, para todos los cultivos de patata dentro de la zona delimitada, se planten exclusivamente semillas certificadas o semillas cultivadas bajo control oficial, y se efectúe un análisis después de cosechar los cultivos de patatas de siembra en lugares de producción determinados como probablemente contaminados según el artículo 6, apartado 1, letra a), inciso iii),
– exigirán que se manipulen por separado las existencias de patatas de siembra y de patatas de consumo recolectadas en todas las explotaciones de la zona o, cuando sea adecuado, que se efectúe una desinfección entre la manipulación de las existencias de patatas de siembra y de patatas de consumo,
– exigirán que, para todos los cultivos de tomate de la zona, solamente se planten tomateras obtenidas de semillas que cumplan los requisitos de la Directiva 2000/29/CE o, si se han propagado vegetativamente, de tomateras producidas a partir de estas semillas y cultivadas bajo control oficial,
– efectuarán el examen oficial que dispone el artículo 3, apartado 1;
bb) en los casos en que, en virtud del artículo 6, apartado 1, letra c), inciso ii), se hayan declarado contaminadas aguas de superficie o en que, de conformidad con el anexo V, punto 2, se hayan incluido dichas aguas entre los factores de la posible propagación del organismo:
– realizarán un examen anual, en los momentos oportunos, con una toma de muestras de las aguas de superficie y, cuando sea oportuno, de las plantas huésped solanáceas en las fuentes hídricas pertinentes, así como análisis con arreglo a los métodos pertinentes establecidos en el anexo II para el material vegetal indicado y para otros casos,
– con el fin de impedir la propagación del organismo, establecerán controles oficiales de los planes de riego y rociamiento, así como una prohibición del uso de las aguas declaradas contaminadas para el riego y rociamiento del material vegetal indicado y, en su caso, de otras plantas huésped. Esta prohibición podrá reexaminarse en función de los resultados obtenidos en el examen anual mencionado, y podrán revocarse las declaraciones cuando los organismos oficiales responsables tengan la certeza de que las aguas superficiales ya no están contaminadas. Podrá autorizarse el uso del agua sometida a prohibición, bajo control oficial, para el riego y el rociamiento de las plantas huésped, cuando se utilicen técnicas aprobadas oficialmente que eliminen el organismo y eviten su propagación,
– en los casos en que se hayan contaminado vertidos de residuos líquidos, establecerán controles oficiales de la eliminación de los residuos sólidos o líquidos procedentes de las instalaciones industriales de transformación o envasado que manipulen el material vegetal indicado;
c) establecerán, cuando sea pertinente, un programa para la sustitución en un plazo adecuado de todas las existencias de patatas de siembra.
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
[Bloque 28: #av-3]
Los métodos de eliminación de residuos autorizados oficialmente mencionados en el anexo VI, punto 1, deberán cumplir las disposiciones que se indican a continuación con el fin de evitar todo riesgo identificable de propagación del organismo:
i) los residuos de patatas y tomates (incluidas las patatas, mondaduras y tomates descartados) y cualquier otro residuo sólido asociado con las patatas y los tomates (incluido el suelo, las piedras y otros restos) se eliminarán de una de las siguientes maneras:
– en un vertedero de eliminación de residuos autorizado oficialmente en donde no exista ningún riesgo identificable de escape del organismo al medio ambiente, por ejemplo, a través de filtración a tierras agrícolas ni de contacto con fuentes de agua que puedan utilizarse para el riego de dichas tierras. Los residuos se conducirán directamente al vertedero en unas condiciones de confinamiento que impidan todo riesgo de pérdida de los mismos,
o
– mediante incineración,
o
– a través de otras medidas, siempre que se descarte el posible riesgo de propagación del organismo. Dichas medidas se notificarán inmediatamente al Ministerio de Agricultura, Pesca y Alimentación y este a su vez, a través del cauce correspondiente, a la Comisión y a los demás Estados miembros,
ii) residuos líquidos: antes de la eliminación, los residuos líquidos que contengan sólidos en suspensión se someterán a procesos de filtración o sedimentación para eliminar dichos sólidos. Estos sólidos se eliminarán tal como se establece en el inciso i).
A continuación, los residuos líquidos:
– se calentarán a un mínimo de 60°C en todo su volumen durante un mínimo de 30 minutos antes de la eliminación,
o
– se eliminarán, previa autorización oficial y bajo control oficial, de manera que no exista ningún riesgo identificable de que los residuos puedan entrar en contacto con tierras agrícolas ni fuentes de agua que pudieran utilizarse para la irrigación de tierras agrícolas. Los detalles de estas medidas se notificarán al Ministerio de Agricultura, Pesca y Alimentación y este a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión.
Las opciones descritas en el presente anexo se aplican asimismo a los residuos asociados a la manipulación, la eliminación y el tratamiento de lotes contaminados.
Se modifica por el art. único de la Orden APA/719/2007, de 15 de marzo. Ref. BOE-A-2007-6422
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid