Suscrito con fecha 11 de diciembre de 2019 el Convenio entre el Instituto de Salud Carlos III, O.A., M.P. y la Fundación Probitas para el estudio del mapeo de oncocercosis, filariasis línfática y loiasis en Guinea Ecuatorial Continental para el desarrollo de estrategias de control y prevención de estas enfermedades, y en cumplimiento de lo dispuesto en el apartado ocho del artículo 48 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, procede la publicación en el «Boletín Oficial del Estado» de dicho convenio, que figura como anexo de esta Resolución.
Madrid, 31 de enero de 2020.–La Directora del Instituto de Salud Carlos III, O.A., M.P., Raquel Yotti Álvarez.
En Madrid, a 11 de diciembre de 2019.
REUNIDOS
De una parte, Dra. doña Raquel Yotti Álvarez, como Directora del Instituto de Salud Carlos III, O.A., M.P. (en adelante, ISCIII), Organismo Público de Investigación, adscrito al Ministerio de Ciencia, Innovación y Universidades a través de la Secretaría General de Coordinación de Política Científica, NIF: Q-2827015-E, nombrada por Real Decreto 1029/2018, de 3 de agosto (BOE n.º 188, del 4), actuando en nombre y representación del ISCIII, con domicilio en la calle Sinesio Delgado, número 6, de Madrid, y en ejercicio de las competencias atribuidas por el artículo 11 del Real Decreto 375/2001, de 6 de abril, por el que se aprueba su Estatuto.
Y de otra parte, Dra. doña Marta Segú y en representación de Probitas Fundación Privada (en adelante, PROBITAS), con CIF número G64939796, en virtud de las atribuciones que tiene conferidas según escritura notarial número 1692 del notario doña Maria de Rocafiguera Gibert de 21 de octubre de 2011 y con domicilio social a efectos de notificaciones en c/ Jesús i Maria, 6, 08022 Barcelona.
PROBITAS y el ISCIII serán denominadas conjuntamente como las «Partes» e, individualmente, como la «Parte».
EXPONEN
(A) Que PROBITAS fue constituida como fundación el 25 de julio de 2008 e inscrita el 8 de enero de 2009 en el Registre de Fundacions de la Generalitat de Catalunya, con el número de registro 2535, así como en el Registro de Organizaciones no Gubernamentales de Desarrollo (ONGD) por resolución de la Agencia Española de Cooperación Internacional para el Desarrollo (AECID) del 16 de febrero de 2012.
(B) Que PROBITAS tiene como fines fundacionales contribuir a la mejora de los recursos sanitarios y al bienestar de todas aquellas regiones del mundo que padezcan escasez de medios y/o conocimientos en el ámbito de la salud y/o que requieran acciones puntuales como consecuencias de catástrofes de origen natural o humano.
(C) Que, en cumplimiento de sus fines fundacionales/objetivos/actividades, el ISCIII presentó a la convocatoria de ayudas de PROBITAS para Proyectos de Salud Internacional y Cooperación 2019-2020 el proyecto «Mapeo de Oncocercosis, Filariasis linfática y Loiasis en Guinea Ecuatorial Continental para el desarrollo de estrategias de control y prevención de estas enfermedades», para el que cuenta con un presupuesto insuficiente aportado por la OMS.
(D) Que este proyecto fue aprobado por el patronato de PROBITAS para ser financiado y, de conformidad con el procedimiento previsto en las bases de estas ayudas, la colaboración entre PROBITAS y la entidad beneficiaria debe formalizarse mediante la firma de un convenio.
(E) Que el ISCIII tiene como misión principal el fomento de la generación de conocimiento científico en ciencias de la salud y desarrollar y ofrecer servicios científico-técnicos e investigación de la más alta calidad, dirigidos al Sistema Nacional de Salud y al conjunto de la sociedad.
(F) Que el ISCIII es un Organismo Público de Investigación, que se rige por la Ley 14/2011, de 1 de junio, de la Ciencia, la Tecnología y la Innovación.
(G) El Real Decreto 375/2001, de 6 de abril, por el que se aprueba el Estatuto del ISCIII, le otorga la potestad de establecer acuerdos y contratos con centros del Sistema Nacional de Salud, instituciones y organismos públicos de investigación biomédica y en ciencias de la salud nacionales e internacionales, universidades y entidades privadas que realicen actividades de investigación científica y desarrollo tecnológico, para la realización de proyectos y actividades de investigación, desarrollo tecnológico, innovación y otras actividades de carácter científico, docente y asesor.
(H) Que, reconociéndose capacidad legal suficiente para actuar en este acto, las Partes acuerdan suscribir el presente Convenio regulando la participación de PROBITAS en el Proyecto (según definido más adelante), de acuerdo con las siguientes
CLÁUSULAS
1.1 El objeto del presente Convenio es establecer las relaciones entre el ISCIII y PROBITAS para el desarrollo del proyecto «Mapeo de oncocercosis, filariasis linfática y loiasis en Guinea Ecuatorial continental para el desarrollo de estrategias de control y prevención de estas enfermedades», mediante una subvención otorgada por PROBITAS.
1.2 Sujeto a los términos y condiciones establecidos en este Convenio, PROBITAS colaborará con el ISCIII en el Proyecto descrito en el «Anexo I: Descripción del Proyecto» según indicado en el «Anexo II: Alcance de la Colaboración» y según proyecto presentado y aprobado por el patronato el día 31 de mayo de 2019 en el «Anexo III: Proyecto de Colaboración» (el «Proyecto»).
1.3 Los fondos comprometidos serán entregados por PROBITAS al ISCIII en el momento y plazos indicados en el Anexo II, por medio de una o más transferencias bancarias libres de costes y gastos.
1.4 En caso de discrepancia, las condiciones particulares establecidas en los Anexos I y II prevalecerán sobre las condiciones generales establecidas en estas cláusulas.
2.1 PROBITAS realizará las aportaciones económicas, suministrará los equipos, materiales o medicamentos, o prestará los servicios de asistencia técnica de conformidad con lo indicado en este Convenio y, en particular, con lo establecido en el Anexo II.
2.2 El ISCIII destinará las aportaciones económicas, los equipos, materiales o medicamentos, o la asistencia técnica recibidos de PROBITAS, íntegra y exclusivamente a la realización y desarrollo del Proyecto, de acuerdo con todos los aspectos técnicos del mismo, velando por la correcta aplicación de dichos fondos, bienes o servicios. Realizará las actividades descritas en el anexo I.
2.3 Obligaciones de suministro de información:
(a) Con la periodicidad, momento y condiciones indicadas a continuación, el ISCIII proporcionará a PROBITAS la siguiente información y/o documentación relativa a la realización y desarrollo del Proyecto:
(i) Al firmar el Convenio, el logo del ISCIII en alta resolución (mínimo 300 dpi) en formato jpg; y la autorización firmada para la publicación de fotografías por parte de PROBITAS para su página web y rendición de cuentas anual;
(ii) Semestralmente el Informe de Seguimiento técnico y económico cuya plantilla se adjunta como Anexo IV a este Convenio, debidamente cumplimentado y firmado por una cualquiera de las personas designadas por el ISCIII en la Comisión Técnica de Seguimiento; y
(iii) Al finalizar el Proyecto, el Informe de Evaluación Final Técnico y Económico cuya plantilla se adjunta como Anexo V a este Convenio, debidamente cumplimentado y firmado por las 2 personas designadas por el ISCIII en la Comisión Técnica de Seguimiento.
(b) Tanto los Informes de Seguimiento como el Informe de Evaluación Final deberán acompañarse de la siguiente documentación y datos de soporte:
(i) Las facturas superiores a 300 euros. Las facturas que se hayan imputado a PROBITAS deberán incluir una diligencia con el nombre del Proyecto, año de ejecución, la referencia del financiador PROBITAS y el importe de la factura. En caso de aportarse copias, éstas deberán estar compulsadas por una Administración Pública. En caso de que la compulsa no fuera posible y esté justificada, el ISCIII podrá enviar por correo certificado las facturas reales con su diligencia a la sede administrativa de PROBITAS. Tras su verificación, PROBITAS devolverá por correo certificado dichas facturas al ISCIII.
(ii) presupuesto ejecutado desglosado por conceptos en todos los informes sean de seguimientos o de evaluación final.
(iii) fotografías de alta resolución (mínimo 300 dpi) en formato jpg.
2.4 Obligaciones de difusión y publicidad:
(a) El ISCIII deberá difundir la colaboración de PROBITAS en el Proyecto en cualquier acto que se realice y en cualquier material que se publique o edite en relación al Proyecto, insertando la denominación social y el logotipo de PROBITAS. A tal efecto, PROBITAS deberá ser previamente informada y prestar su consentimiento y aprobación expresos a los diseños, emplazamientos y características del material, impresión, denominación y logotipo en todo material impreso y/o audiovisual que se produzca, edite o publique en relación con el Proyecto;
(b) PROBITAS, a su coste, podrá publicar y difundir su colaboración en el Proyecto sin el consentimiento previo del ISCIII, quien deberá ser previamente informada.
2.5 Las Partes se comprometen a crear una Comisión Técnica de Seguimiento integrada por 2 representante(s) de cada una de las Partes, quienes aparecen indicados en el Anexo II, y cuya función principal será:
(a) Velar por, y realizar el seguimiento de, el adecuado desarrollo del Proyecto y del presente Convenio, reuniéndose para ello (bien sea física o por videoconferencia o conferencia telefónica múltiple), con la periodicidad mínima que se indica en el Anexo II, así como cuando lo solicite fehacientemente cualesquiera de sus miembros.
(b) Acudir a alguna de las reuniones relacionadas con el Proyecto con el previo aviso y acuerdo con la contraparte local.
3.1 El ISCIII manifiesta y garantiza a PROBITAS que:
(a) Los fines fundacionales/objetivos/actividades del ISCIII y/o el Proyecto son ciertos y veraces y no están en conflicto ni constituyen (o puede derivar en) un incumplimiento o violación material de cualquier ley o regulación aplicable a las Partes;
(b) está plenamente facultada y capacitada para suscribir este Convenio, así como para cumplir las obligaciones dispuestas en el mismo;
(c) el otorgamiento de este Convenio no está en conflicto ni constituye (o puede derivar en) un incumplimiento o violación material de cualquier ley, regulación aplicable a las Partes, o de cualquier contrato o acuerdo al que estén vinculados o al que sus propiedades o activos se encuentre sujetos; y
(d) realizará sus mejores esfuerzos y prestará la colaboración adecuada y necesaria para lograr los objetivos de este Convenio, en las condiciones y dentro de los plazos establecidos en el mismo.
3.2 PROBITAS manifiesta y garantiza al ISCIII que:
(a) Sus fines fundacionales son ciertos y veraces y no están en conflicto ni constituyen (o puede derivar en) un incumplimiento o violación material de cualquier ley o regulación aplicable a las Partes;
(b) está plenamente facultada y capacitada para suscribir este Convenio, así como para cumplir las obligaciones dispuestas en el mismo;
(c) el otorgamiento de este Convenio no está en conflicto ni constituye (o puede derivar en) un incumplimiento o violación material de cualquier ley, regulación aplicable a las Partes, o de cualquier contrato o acuerdo al que estén vinculados o al que sus propiedades o activos se encuentre sujetos; y
(d) realizará sus mejores esfuerzos y prestará la colaboración adecuada y necesaria para lograr los objetivos de este Convenio, en las condiciones y dentro de los plazos establecidos en el mismo.
Este Convenio se perfecciona en el momento de su firma. Sus efectos se iniciarán una vez inscrito en el Registro Electrónico estatal de Órganos e Instrumentos de Cooperación del sector público estatal y su publicación en el «Boletín Oficial del Estado». A partir de la fecha de su publicación tendrá la vigencia indicada como «Duración de la Colaboración» en el Anexo II, salvo que fuera resuelto con anterioridad conforme a los términos de la Cláusula 7. Transcurrido dicho plazo, las Partes podrán acordar por escrito una prórroga de este Convenio por un periodo máximo de un (1) año adicional.
5.1 Será causa de extinción del Convenio el cumplimiento de las actuaciones que constituyen su objeto o por incurrir en causa de resolución.
5.2 Serán causas de resolución:
a) El transcurso del plazo de vigencia del Convenio, sin haber acordado la prórroga del mismo.
b) El acuerdo unánime de todas las Partes.
c) El incumplimiento de las obligaciones y compromisos asumidos por parte de alguna de las Partes.
En este caso, cualquiera de las Partes podrá notificar a la parte incumplidora un requerimiento para que cumpla en un plazo de veinte (20) días con las obligaciones o compromisos que se consideran incumplidos. Este requerimiento será comunicado al responsable de la Comisión mixta prevista en la cláusula quinta.
Si trascurrido el plazo indicado en el requerimiento persistiera el incumplimiento, la Parte que lo dirigió notificará a la otra Parte firmante la concurrencia de la causa de resolución y se entenderá resuelto el Convenio.
d) Por decisión judicial declaratoria de la nulidad del convenio.
e) Por cualquier otra causa distinta de las anteriores previstas en este convenio y en las Leyes.
5.3 A la terminación de este Convenio, se extinguirán todas las obligaciones establecidas en el mismo, a excepción de aquellas que por su naturaleza deban tener una vigencia superior en el tiempo.
La modificación del contenido del Convenio requerirá acuerdo unánime de las Partes.
7.1 El presente Convenio es de naturaleza administrativa de los previstos en el artículo 47 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del sector Público.
7.2 Las dudas y controversias que pudieran suscitarse con motivo de la interpretación y aplicación del presente Convenio y que no puedan ser resueltas de forma amistosa por las Partes a través de la Comisión Mixta regulada en la Cláusula quinta, serán de conocimiento y competencia del Orden Jurisdiccional Contencioso-Administrativo.
8.1 En relación con el tratamiento de los datos de carácter personal, ambas Partes en el desarrollo de sus correspondientes actividades derivadas del presente Convenio, atenderán las disposiciones de obligado cumplimiento establecidas en el Reglamento (UE) 2016/679 del Parlamento Europeo y del Consejo, de 27 de abril de 2016, relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y en la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, así como en la legislación nacional aplicable por razón de la materia objeto del Convenio.
8.2 En cumplimiento de la mencionada normativa, las Partes se comprometen al tratamiento de los datos en el respeto a los principios recogidos en el artículo 5 del RGPD, a satisfacer los deberes relativos a la información a los interesados, la obtención del consentimiento informado cuando sea exigible, el ejercicio de los derechos de acceso, rectificación, supresión y oposición, así como a la limitación del tratamiento y portabilidad de los datos y a no ser objeto de decisiones individualizadas automatizadas, y demás requerimientos organizativos y de seguridad establecidos.
8.3 Este Convenio se somete a lo dispuesto en el artículo 8.1.b) de la Ley 19/2013, de 9 de diciembre, de Transparencia, Acceso a la Información Pública y Buen Gobierno.
Las Partes asumen, en la realización de las actividades objeto del Convenio, la obligación de confidencialidad, respecto de toda la información de la contraparte a que hayan tenido acceso en virtud de su ejecución y que sea considerada como confidencial por esta. Las restricciones a la divulgación establecidas en esta Cláusula 10 no se aplicarán a cualquier información que: (i) adquiera el carácter de dominio público; (ii) ya sea conocida por la Parte receptora, quien deberá acreditar este hecho documentalmente, y no se haya adquirido directamente de la Parte divulgante; (iii) requiera ser divulgada en virtud de una ley u orden judicial, pero, en este caso, se deberá notificar dicho requerimiento con antelación suficiente a la Parte divulgante, a los efectos de que esta pueda solicitar asistencia para prevenir o limitar dicha divulgación, y siempre y cuando cualquier divulgación se extienda única y exclusivamente a aquello que sea necesario, estando la misma sujeta a la previa consulta formulada a la Parte divulgante para fijar el momento y la extensión de dicha divulgación.
10.1 Ambas Partes acuerdan crear una Comisión Mixta, paritaria, de vigilancia, control y seguimiento de la ejecución de las acciones previstas en el presente Convenio, que se constituirá en el plazo máximo de un (1) mes a contar desde la fecha en que este resulte eficaz.
10.2 La comisión mixta será el órgano encargado del seguimiento, vigilancia y control del cumplimiento del presente Convenio y de la resolución de los problemas de interpretación y cumplimiento que puedan plantearse. Asimismo, a dicha comisión podrán incorporarse los técnicos que las partes consideren oportuno, según los temas a tratar.
10.3 En ningún caso la comisión mixta podrá adoptar decisiones que excedan de las estrictas funciones de control y seguimiento previstas en la presente cláusula.
10.4 Sus normas de funcionamiento serán las establecidas para los órganos colegiados en el capítulo II del Título Preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del sector Público.
11.1 Ninguna de las partes puede ceder, subrogar ni delegar, total o parcialmente, a un tercero los derechos y obligaciones contenidos en este Convenio, salvo autorización expresa por escrito de la otra Parte.
11.2 Toda notificación se realizará por escrito y estará firmada por la Parte que la emite o en su nombre y, salvo que se entregue en persona a la otra Parte, se remitirá o se enviará por burofax, fax, correo certificado o correo electrónico con acuse de recibo, dirigidos a las direcciones indicadas en el encabezamiento.
Y en prueba de conformidad, ambas Partes suscriben este Convenio por duplicado en la fecha establecida en el encabezamiento de este Convenio.–Por el Instituto de Salud Carlos III, la Directora, Raquel Yotti Álvarez.–Por Probitas Fundación Privada, la Directora General, Marta Segú i Estruch.
Descripción del objeto de la colaboración (el «Proyecto»)
Mejorar la salud de la población ecuatoguineana que vive en la zona continental a través del diagnóstico y control de la oncocercosis, la filariasis linfática y la loiasis.
Detalle de los objetivos/actividades del Proyecto
Conocer si existe transmisión de oncocercosis en Guinea Ecuatorial continental para desarrollar recomendaciones nacionales para avanzar hacia la eliminación de la oncocercosis y el control de la FL / Loa a nivel nacional.
Evaluar la utilidad de test rápido Ov16 / FTS, marcadores serológicos, método de amplificación isotérmica mediada por bucle (LAMP) y Loa-PCR a tiempo real para la detección de oncocercosis y FL para guiar las decisiones del programa sobre el tratamiento y la vigilancia de estas enfermedades.
Actividades del ISCIII previstas:
– Compra y transporte del material.
– Compra de dos máquinas LAMP.
– Preparación de protocolos y procedimientos operativos estándar (POEs).
– Formación del personal local que formará parte de los equipos de trabajo.
– Trabajo de campo (realización de encuestas y recogida de muestras).
– Presentación del primer informe de seguimiento a Fundación Probitas.
– Evaluación de la primera fase del proyecto.
– Análisis de datos y análisis de laboratorio.
– Elaboración de informe y de las recomendaciones para el MINSABS.
– Presentación del segundo informe de seguimiento a Fundación Probitas.
– Presentación de resultados.
– Diseño de las estrategias de control.
– Evaluación final del proyecto.
– Comunicación científica de resultados (artículos, congresos).
Descripción del alcance de la colaboración de PROBITAS al Proyecto (la «Colaboración»)
La colaboración de PROBITAS durante 2019/2020 en el proyecto:
Mapeo de Oncocercosis, Filariasis linfática y Loiasis en Guinea Ecuatorial Continental para el desarrollo de estrategias de control y prevención de estas enfermedades impulsado por el ISCIII es fundamentalmente económico y tiene el objetivo de mejorar la salud de la población ecuatoguineana que vive en la zona continental a través del diagnóstico y control de la oncocercosis, la filariasis linfática y la loiasis.
El apoyo de PROBITAS asciende a 49.936 euros.
El coste total del proyecto para 2019/2020 asciende a 241.602 euros por lo que PROBITAS contribuye al 21 % del total.
Forma de la Colaboración (indicando, en su caso, las condiciones particulares de pago)
PROBITAS colaborará con 49.936 euros que se imputarán a la/s partida/s:
Equipos y suministros.
Según presupuesto aprobado por el patronato el día 31 de mayo de 2019 para los equipos y suministros expuestos en el Anexo I.
PROBITAS realizará una primera aportación de 24.968 euros (50% del total) a la fecha efectiva de la firma del Convenio. Tras esta primera transferencia, el ISCIII deberá elevar un informe de seguimiento, siguiendo las indicaciones del Anexo IV, a los 6 meses. En dicho informe, el ISCIII deberá haber justificado, al menos, el 80% del importe de la transferencia.
Tras la verificación del informe de seguimiento, PROBITAS realizará una segunda aportación por valor de 24.968 euros.
Las facturas que se hayan imputado a PROBITAS deberán incluir una diligencia con el nombre del proyecto, año de ejecución, la referencia del financiador PROBITAS y el importe de la factura. En caso de aportarse copias, éstas deberán estar compulsadas por una Administración Pública. En caso de que la compulsa no fuera posible y esté justificada, el ISCIII podrá enviar por correo certificado las facturas reales con su diligencia a la sede administrativa de Probitas. Tras su verificación, la Fundación devolverá por correo certificado dichas facturas al ISCIII.
Las facturas que se imputen a PROBITAS deberán haberse emitido en el periodo que abarca el presente convenio y que se especifica en «Duración de la Colaboración».
Máximo en 18 meses, 3 meses después de la finalización del proyecto, el ISCIII deberá presentar el informe final, según anexo V, y justificar la totalidad de los gastos imputados a PROBITAS.
Es necesario que, tras la transferencia, el ISCIII envíe por correo postal a PROBITAS un Certificado de Aportación Económica en la que figure el importe exacto recibido de conformidad con lo establecido en el artículo 24 de la Ley 49/2002, de 23 de diciembre, de régimen fiscal de las entidades sin fines lucrativos y de los incentivos fiscales al mecenazgo.
Detalle de la cuenta bancaria del ISCIII
Cuenta Corriente IBAN ES4590000001200200009118, Banco de España, calle Alcalá, 50. 28014-Madrid.
Duración de la Colaboración
La colaboración tendrá una duración de 1 año, a contar desde que el convenio sea eficaz.
Composición de la Comisión Técnica de Seguimiento
Por parte de PROBITAS, la Directora General, y la Project Manager y por parte del ISCIII, la Directora del Instituto Carlos III o persona en quien delegue y el Director del Centro Nacional de Medicina Tropical o persona en quien delegue.
Periodicidad mínima y fechas previstas de reunión de la Comisión Técnica de Seguimiento
Como mínimo una vez en Barcelona, fecha que puede coincidir con la presentación del informe de seguimiento o final. Asimismo, un representante de PROBITAS se podrá desplazar a Madrid para conocer de primera mano el alcance del proyecto, siempre con previo aviso y de acuerdo con el ISCIII.
Fase 2: Convocatoria de subvenciones a Proyectos de Cooperación en el Sector de la Salud Internacional 2019-2020
1. Datos de la entidad solicitante:
Entidad solicitante:
Nombre de la entidad: Instituto de Salud Carlos III (ISCIII).
NIF/CIF: Q2827015-E.
Dirección completa de la entidad:
Calle: Sinesio Delgado, 4 (entrada por Avda. Monforte de Lemos, 5).
Código postal: 28029.
Ciudad: Madrid.
Teléfonos: 918223673.
Correo electrónico:
Responsable de la entidad (Presidente/a o Director/a).
NIF: Q2827015-E.
Cargo: Directora.
Responsable técnico del proyecto (persona de contacto).
Cargo: Investigadora.
Teléfonos:
Correo electrónico:
Socio local:
Nombre: Plan Nacional de Lucha contra la Oncocercosis y la Filariasis Linfática del Ministerio de Salud y Bienestar Social (MINSABS) de Guinea Ecuatorial.
Fecha de constitución:
Forma jurídica: Ministerio de Sanidad y Bienestar Social.
Identificación fiscal:
Dirección completa: Avda. del Rey Malabo s/n, Malabo, Bioko, Guinea Ecuatorial.
Estado/Provincia/Departamento, etc.: Malabo.
Teléfono:
Correo electrónico:
Persona responsable de la entidad:
Cargo: Director.
Persona responsable del proyecto que se presenta:
Cargo: Técnico de proyecto.
¿Existe algún convenio de colaboración entre la entidad solicitante y el socio local?: No / sí (Adjuntar el convenio de colaboración):
Sí (Está prorrogada la XI Comisión Mixta Hispano-Guineana y la XII todavía no se ha reunido) ver documentos adjuntos:
– Encomienda de Gestión ISCIII-MINSABS.
– V Plan Director de la Cooperación Española.
– Carta de aprobación de solicitud de fondos a ESPEN-OMS África por parte del Ministro de Sanidad de la República de Guinea Ecuatorial).
2. Datos generales del proyecto:
2.1 Título del proyecto:
Mapeo de Oncocercosis, Filariasis linfática y Loiasis en Guinea Ecuatorial Continental para el desarrollo de estrategias de control y prevención de estas enfermedades.
2.2 Presupuesto total del proyecto (en euros): 241.602.
2.3 Presupuesto total solicitado a Probitas Fundación Privada:
Importe solicitado a Probitas Fundación Privada (en euros): 49.936.
% solicitado a Probitas Fundación Privada sobre presupuesto total: 21%.
2.4 Otros financiadores del proyecto:
|
Nombre de los financiadores |
O.M.S. |
ISCIII |
||
|---|---|---|---|---|
|
Importe solicitado por financiador (euros). |
135.588 |
56.078 |
||
|
% sobre presupuesto total. |
56% |
23% |
||
|
Fecha de concesión de la subvención. |
02/2019 |
– |
2.5 Calendario planificado para la ejecución del proyecto:
Fecha prevista de inicio: 01/07/2019.
Fecha prevista de finalización: 31/12/2020.
Duración (en meses): 18 (la financiación de la fundación Probitas se solicita para la primera fase del proyecto, comprendida entre el 01/07/2019 y el 01/07/2020, y que tiene una duración de 12 meses).
2.6 Ámbito territorial:
País: Guinea Ecuatorial.
Región o municipio: Región Continental.
2.7 Beneficiarios:
Núm. de beneficiarios directos: 3.900.
De los cuales, n.º de mujeres: ~ 1.450 (50%).
De los cuales, n.º de niños (< 15 años): ~ 1.450 (50%).
Núm. de beneficiarios indirectos: 882.747.
Descripción de los beneficiarios directos:
Población mayor de 5 años que habita de forma habitual en las comunidades centinelas en las que se realizará el estudio. La unidad muestral será el distrito (hay 13 distritos en la zona continental, en cada distrito se seleccionarán 300 participantes, total tamaño muestral=3.900). En cada distrito se visitarán entre 3-4 comunidades centinelas, un total de 39-52 comunidades. En cada comunidad se seleccionarán aleatoriamente entre 75 y 100 participantes. Las personas que resulten positivas a oncocercosis, Filariasis linfática y/o loiasis recibirán tratamiento según las guías nacionales.
Descripción de los beneficiarios indirectos:
Los resultados de este proyecto guiarán las intervenciones que llevará a cabo el MINSABS tras el estudio, en concreto la distribución de ivermectina y/o albendazol, dependiendo de las prevalencias de oncocercosis y loiasis que se encuentren. Estas campañas de distribución masiva de tratamiento se realizarán para toda la zona continental, por lo que los beneficiarios indirectos serán toda la población de esta parte del país (882.747 según datos del último censo realizado en 2015).
Tanto la realización del trabajo de campo como la implementación de las medidas derivadas de los resultados del mismo respetarán y seguirán los principios de equidad en el acceso a la salud.
2.8 Sector de actuación en que se focaliza principalmente el proyecto (subrayar máximo dos de las opciones siguientes):
– Fortalecimiento de las estructuras sanitarias locales.
– Acondicionamiento y equipamiento de laboratorios de diagnóstico y centros de salud.
– Provisión de agua, saneamiento e higiene para la prevención de las enfermedades elegibles.
– Asistencia sanitaria especializada.
– Formación y capacitación del personal local de salud.
– Investigación aplicada en la mejora del diagnóstico y tratamiento.
– Control de vectores.
– Campañas de sensibilización e IEC (información, educación, comunicación) a nivel comunitario.
2.9 Objetivos del proyecto:
2.9.1 Objetivo general del proyecto (solo uno):
Mejorar la salud de la población ecuatoguineana que vive en la zona continental a través del diagnóstico y control de la oncocercosis, la filariasis linfática y la loiasis.
2.9.2 Objetivo(s) específico(s) del proyecto (máximo dos):
– Conocer si existe transmisión de oncocercosis en Guinea Ecuatorial continental para desarrollar recomendaciones nacionales para avanzar hacia la eliminación de la oncocercosis y el control de la FL / Loa a nivel nacional.
– Evaluar la utilidad de test rápido Ov16 / FTS, marcadores serológicos, método de amplificación isotérmica mediada por bucle (LAMP) y Loa-PCR a tiempo real para la detección de oncocercosis y FL para guiar las decisiones del programa sobre el tratamiento y la vigilancia de estas enfermedades.
2.10 Resumen de los principales componentes/actividades:
– Compra y transporte del material.
– Preparación de protocolos y procedimientos operativos estándar (POEs).
– Formación del personal local que formará parte de los equipos de trabajo.
– Trabajo de campo (realización de encuestas y recogida de muestras).
– Presentación del primer informe de seguimiento a Fundación Probitas.
– Evaluación de la primera fase del proyecto.
– Análisis de datos y análisis de laboratorio.
– Elaboración de informe y de las recomendaciones para el MINSABS.
– Presentación del segundo informe de seguimiento a Fundación Probitas.
– Presentación de resultados.
– Diseño de las estrategias de control.
– Evaluación final del proyecto.
– Comunicación científica de resultados (artículos, congresos).
3. Resumen ejecutivo del proyecto que se presenta:
Resumen narrativo del proyecto.
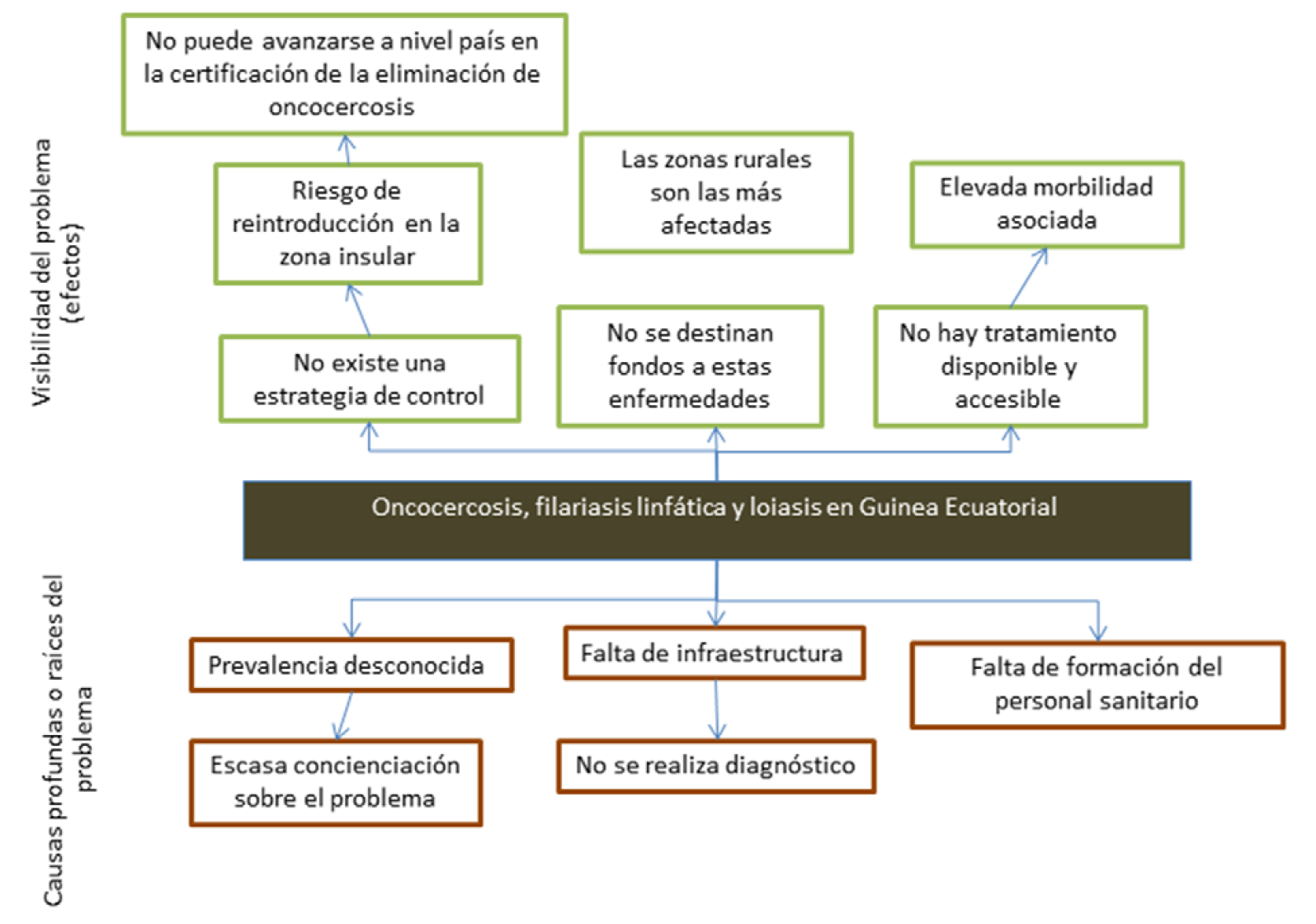
Los esfuerzos realizados en el control de la oncocercosis por parte del Ministerio de Sanidad y Bienestar Social de Guinea Ecuatorial (MINSABS) y la Organización Mundial de la Salud (OMS) se han centrado hasta la fecha en la zona insular del país, por ser considerada históricamente un área hiperendémica para oncocercosis. El éxito de las campañas de Administración Masiva de Medicamentos (AMM) realizadas durante más de 20 años en esta zona del país ha hecho que esta región sea una de las primeras en certificar la interrupción de la transmisión de la oncocercosis en el África Subsahariana. Para poder avanzar a nivel país, se necesita conocer cuál es la situación en la zona continental (la más habitada del país), donde no se ha llevado a cabo ninguna estrategia de control y donde se desconoce la prevalencia real de oncocercosis.
Para poder diseñar estrategias de control seguras y eficaces frente a oncocercosis es necesario conocer la prevalencia de otras filariasis. En concreto, la pauta y tipo de AMM se determinará en función de la prevalencia (y carga de enfermedad) de loiasis y de filariasis linfática, ya que el tratamiento tradicional con ivermectina está contraindicado en países con alta endemicidad de loa, por riesgo importante de aparición de efectos adversos neurológicos, que ocasionalmente conduce a la muerte en individuos con alta microfilaremia (5000-30000 mf/ml). Existen en la actualidad métodos diagnósticos novedosos que la propia Organización Mundial de la Salud (OMS) ha incorporado en las guías actualizadas de oncocercosis. Estos métodos son en general menos cruentos y más sensibles, ya que con ellos se pretende determinar la prevalencia en zonas con distintos niveles de endemicidad. Estas herramientas necesitan ser testadas en el terreno para poder estimar su validez según el nivel de endemicidad del lugar de estudio. Es por ello que en el presente proyecto nos planteamos la utilización de algunas de estas técnicas, y en concreto test de diagnóstico rápido (TDR) y otras pruebas serológicas, técnica de amplificación isotérmica mediada por bucle (LAMP en inglés) y PCR en tiempo real.
Entre las nuevas técnicas desarrolladas hasta la fecha, la PCR en tiempo real es la única metodología que ha sido capaz de combinar alta sensibilidad y especificidad con la capacidad de cuantificar con precisión los niveles de microfilarias de L. loa en aquellas áreas donde es co-endémica con O. volvulus y/o W. bancrofti. No obstante, esta técnica requiere de un laboratorio sofisticado, bien equipado y el uso de reactivos relativamente caros. Según la OMS, los criterios de inclusión de método de diagnóstico son: sensibilidad, especificidad, bajo costo, simplicidad, rapidez, adaptabilidad a la temperatura y fácil disponibilidad de equipos.
Alternativamente, ha surgido la técnica de LAMP que está basado en la síntesis de ADN específico por desplazamiento de la cadena por autociclado junto con su propiedad habitual de polimerización a una temperatura isotérmica. Esta metodología destaca por ser una prueba de diagnóstico eficaz, fácil de realizar y de interpretar los resultados (visualización directa por turbidez o por colorimetría), a pesar de que el principio y mecanismo de acción es complejo. Por su efectividad, la LAMP se convierte en un método de diagnóstico point-of-care apto para territorios de bajos recursos, capaz de diferenciar altas y bajas microfilaremias, cuanto mayor esla microfilaremia, menor es el tiempo de positividad de la reacción.
Análisis de la problemática y justificación de la propuesta.
La oncocercosis es una enfermedad tropical desatendida (ETD) causada por Onchocerca volvulus, un parásito nematodo que se transmite a los humanos a través de las picaduras de moscas negras infectadas (Simulium spp.). Entre sus síntomas se encuentran prurito intenso, afecciones cutáneas desfigurantes y discapacidad visual, que puede llegar a la ceguera permanente. Más del 99% de las personas infectadas viven en 31 países del África subsahariana.
Entre 1974 y 2002, se logró controlar la enfermedad causada por O. volvulus en África Occidental a través del Programa de Lucha contra la Oncocercosis (OCP), principalmente mediante la fumigación con larvicidas contra las larvas de la mosca negra (lucha antivectorial) desde helicópteros y aviones. Esto se complementó con la distribución a gran escala de ivermectina a partir de 1989. El Programa Africano de Lucha contra la Oncocercosis (APOC) se puso en marcha en 1995 con el objetivo de controlar la oncocercosis en los países de África en los que seguía siendo endémica. En 2009, y tras más de 20 años de actividades llevadas a cabo en el marco de OCP/APOC-OMS, se produjo un giro en el paradigma de OMS: los programas nacionales deberían aspirar a la eliminación de la transmisión, no sólo al control de la enfermedad. Cuando el control era el objetivo principal, las áreas con una carga de oncocercosis baja o desconocida no se incluyeron en los programas de AMM, para permitir la priorización de recursos hacia las áreas con mayor carga. Ahora que la eliminación de la transmisión es el objetivo, estas áreas hipo y mesoendémicas no tratadas deben ser reevaluadas e incluidas en los programas de AMM.
Si bien las encuestas recientes sobre la prevalencia de la oncocercosis han mostrado evidencia de la interrupción de la transmisión en algunos lugares de África, existe la necesidad de mapear la prevalencia de la oncocercosis en áreas de baja transmisión. Las nuevas Guías de la OMS para la verificación de la eliminación de la oncocercosis proporcionan orientación sobre la interrupción del tratamiento y la vigilancia posterior en áreas tratadas con AMM para la oncocercosis. Sin embargo, estas directrices iniciales no proporcionaron un protocolo estándar para delinear áreas que requieren tratamiento con ivermectina bajo el nuevo paradigma de eliminación.
Bajo un paradigma de eliminación, se requiere mayor certeza para declarar un sitio no endémico. Con el fin de desarrollar estas guías con estrategias comunes para lograr la eliminación y facilitar la obtención de la evidencia requerida para el desarrollo de nuevas pautas, se estableció el Subgrupo de Asesoramiento Técnico sobre Oncocercosis (STO). En la reunión inaugural de octubre de 2017 del STO de la OMS, se hicieron recomendaciones preliminares sobre un protocolo estandarizado de mapeo de eliminación de la oncocercosis, incluido el marco de muestreo, los diagnósticos y los umbrales para iniciar la administración masiva de medicamentos.
La OMS recomienda el tratamiento de la oncocercosis con ivermectina al menos una vez al año durante un periodo entre 10 y 15 años. Cuando oncocercosis coexiste con Loa loa hay que ajustar las estrategias terapéuticas. L. loa es otro nematodo filárico endémico en diversos países africanos. El tratamiento frente a oncocercosis puede causar eventos adversos graves neurológicos en personas con altos niveles de microfilarias de L. loa en sangre. Aunque se sospecha que en Guinea Ecuatorial Continental hay zonas endémicas a loiasis, no se ha hecho hasta la fecha ningún estudio de prevalencia.
La filariasis linfática (FL), conocida generalmente como elefantiasis, es otra ETD causada por Wuchereria bancrofti que afecta al sistema linfático y puede producir hipertrofia anormal de algunas partes del cuerpo, causando dolor, discapacidad grave y estigma social. La FL puede eliminarse interrumpiendo la propagación de la infección mediante la repetición anual, durante un mínimo de 5 años, de la quimioterapia preventiva con combinaciones de medicamentos seguros. El tratamiento quimioprofiláctico recomendado depende de la coendemicidad con otras filariasis. En países con oncocercosis, la OMS recomienda AMM con ivermectina y albendazol. En ausencia de oncocercosis y presencia de loiasis, sólo albendazol.
Guinea Ecuatorial (GE) consta de dos partes, una región insular y una continental. En la región insular, se ha interrumpido la transmisión de la oncocercosis después de más de 20 años de actividades de control, y se ha dado una recomendación al Ministerio de Salud para que detenga la AMM y comience los 3 años de vigilancia post-tratamiento, según lo recomendado por la Organización Mundial de la Salud (OMS). Según datos oficiales, oncocercosis, FL y loiasis son endémicas en el área continental, con prevalencias poco claras debido a datos desactualizados o limitados. Según el informe de APOC de 2008, en GE continental la oncocercosis es hipo-meso endémica según el mapeo epidemiológico rápido de la oncocercosis (REMO) (con diferencias significativas entre comunidades), la prevalencia de FL varia de 0 a 14% según la evaluación geográfica rápida para Filariasis Linfática (RAGFIL) y la prevalencia de loiasis es superior al 60% con RAPLOA. Por otra parte, en la última visita de APOC (2015), todas las muestras cutáneas analizadas (n=1.327 en 26 comunidades centinelas) resultaron negativas (comunicación personal con la OMS).
Para avanzar en el control y la eliminación de la oncocercosis a nivel nacional, se necesita una investigación más exhaustiva en la región continental, y para ello se hace preciso el uso de técnicas diagnósticas novedosas y sensibles que puedan ser útiles no sólo en este proyecto sino para la comunidad científica y los organismos internacionales implicados en la lucha frente a estas enfermedades. Por este motivo en el presente proyecto se utilizarán las siguientes herramientas diagnósticas:
– Para O. volvulus.
El SD Bioline Monoplex Ov16 / Wb123 RDT es el método de diagnóstico principal. Se obtendrá una gota de sangre por punción digital usando una lanceta estéril de un solo uso para adultos, después de que el dedo haya sido desinfectado con toallitas/gasas impregnadas con alcohol. La gota de sangre será depositada directamente en el pocillo de la tarjeta Ov16 RDT. Se añadirá la solución de dilución al segundo pocillo. La prueba se leerá a los 20 minutos cronometrados con un reloj. Hasta que el rendimiento de la RDT esté mejor definido, también se realizará ELISA Ov16 (realizado en muestras de sangre seca). Las muestras de sangre con punción de dedo para el ELISA Ov16 se recogerán en una protein saver card (PSC) utilizando una lanceta estéril de un solo uso. Se seguirán las precauciones estándar al recoger y preparar el dried blood spot (DBS) para el envío y se cumplirá con las regulaciones nacionales e internacionales. Esto incluirá un sistema de envasado triple básico para proporcionar una seguridad razonable frente a la exposición ocupacional y mantener una integridad óptima de la muestra. El embalaje externo permitirá el intercambio de aire adecuado para evitar la acumulación excesiva de calor y humedad. Los paquetes desecantes se agregarán a los contenedores primarios antes de enviarlos al laboratorio. Toda la sangre recogida en papel de filtro se secará y almacenará después siguiendo las instrucciones detalladas en el correspondiente procedimiento operativo estándar (POE) para la posterior prueba de anticuerpos en el laboratorio mediante ELISA.
Se recogerá una muestra de biopsia cutánea de individuos positivos por Ov16 RDT para análisis por PCR. La muestra de piel se obtendrá de la cresta ilíaca con pinzas de matriz Walser. Estudios anteriores han demostrado que el uso de PCR en una o cuatro muestras da el mismo resultado, por lo que sí es negativo [7], no sería necesario solicitar más muestras al paciente. Además, incluso si el diagnóstico molecular debe repetirse, una sola biopsia permite la posibilidad de hacer más de 10 repeticiones.
– Para W. bancrofti (Filariasis linfática).
Se obtendrán aproximadamente 75 µl de sangre por punción en el dedo y la muestra se agregará a la almohadilla de la tira reactiva de filariasis (FTS) que detecta el antígeno filarial circulante de W. bancrofti en la sangre. La lectura del resultado se hará a los diez minutos.
De los participantes con FTS positivo (+10% de negativos), se recogerá aproximadamente 60 µl de sangre del mismo pinchazo en papel de filtro (Whatman) para su posterior análisis de antígeno o anticuerpo en el laboratorio. Las muestras de sangre en el papel Whatman se secarán a temperatura ambiente y se almacenarán temporalmente, antes de ser transportadas a un laboratorio de referencia para su posterior análisis serológico mediante ELISA y PCR.
– L. loa.
Para el diagnóstico de loiasis, se recogerán alrededor de 20 µl de sangre a través de punción en el dedo y se extenderá una gota gruesa en un portaobjetos de vidrio correctamente identificado. La microsocopía, además de ser el gold standard, proporcionará una lectura numérica de la densidad de microfilarias de L. loa en la sangre. Se realizará entre las 9 a.m. y las 4 p.m.
Se obtendrá de todos los participantes (dado que la lectura se realizará en el laboratorio de referencia en Madrid) aproximadamente 60 µl de sangre capilar a través de punción digital en papel de filtro Whatman para posterior análisis por PCR panfilárica confirmatoria y LAMP. La técnica de LAMP para L. Loa ha mostrado una elevada sensibilidad y especificidad (comparables a las de PCR en tiempo real) en estudios similares llevados a cabo en Gabón, Camerún y Etiopía.
Otras técnicas serológicas in-house complementarias (como ELISA para L. Loa), actualmente en desarrollo, también se podrán usar para fines de diagnóstico, si fuera pertinente.
Adecuación y alineación del proyecto con políticas locales, estatales o internacionales en el ámbito de la salud.
El proyecto de cooperación científico-técnica del ISCIII en Guinea Ecuatorial se configura como un proyecto de asistencia técnica siguiendo las directrices del Plan Nacional de Desarrollo Económico y Social «Hacia el Horizonte 2020», en sintonía con las necesidades y demandas del MINSABS y con las directrices de la cooperación española, y como no puede ser de otra manera, con las acciones del programa marco europeo en la acción de Salud. Los objetivos del presente proyecto están además alineados con los Objetivos de Desarrollo Sostenibles de las Naciones Unidas, en particular con el objetivo 3.
La finalidad última del presente proyecto es la mejora de la salud global. El fortalecimiento de los sistemas de salud en terceros países a través de un enfoque holístico que permita una distribución efectiva y equitativa de programas efectivos de salud pública y asistencia sanitaria de calidad, teniendo en cuenta sus tres componentes principales (recursos humanos, medicinas, infraestructura) es un elemento esencial para la mejora de la salud global en los mismos. Para alcanzarla, proponemos un proyecto que es producto de una combinación de fondos económicos con una adecuada adaptación de nuestra experiencia a las necesidades en investigación y en el sector salud detectadas Guinea Ecuatorial.
Las enfermedades tropicales desatendidas, entre ellas la oncocercosis y la Filariasis linfática, son enfermedades infecciosas que proliferan principalmente en entornos empobrecidos y que afectan a los grupos de población más vulnerables. A partir del presente proyecto, pretendemos no sólo mejorar la salud de estos grupos de población, a través de las recomendaciones que surjan de nuestros resultados, sino también alcanzar el conocimiento que nos permita mejorar el diagnóstico de esta enfermedad tanto en países con un contexto epidemiológico similar como en países donde esta enfermedad se considere importada, como es el caso de España. Para ello, se hará libre difusión de los resultados, que serán además compartidos con la OMS y con compañeros del entorno científico europeo e internacional.
El proyecto aquí presentado pretende en última instancia contribuir a fortalecer el propio Programa Nacional de Lucha contra la Oncocercosis y otras Filariasis (PNLOF), dependiente del MINSABS. Indirectamente, este redundará en un beneficio para el propio Sistema Nacional de Salud mediante el fortalecimiento de las capacidades asistenciales, laboratoriales y en investigación.
Participación de la población beneficiaria y/o los socios locales en la formulación, ejecución, y evaluación del proyecto.
El presente proyecto surge a partir de una petición del MINSABS de una asistencia técnica que les apoye en el control e interrupción de la transmisión de la oncocercosis a nivel nacional. Esta solicitud nace tras años de colaboración entre el Instituto de Salud Carlos III (ISCIII) y el MINSABS en distintos proyectos de salud. Ambas instituciones llevan colaborando de forma orgánica años en diversos proyectos de salud, entre ellos dando apoyo técnico y científico en el estudio y control de las enfermedades tropicales desatendidas (ETD). Por este motivo, nuestra contraparte ecuatoguineana ha participado activamente en la formulación de este proyecto. La ejecución del mismo será llevada a cabo por personal técnico del PNLOF bajo la supervisión del director de dicho programa, de nuestro coordinador en el terreno y de personal expatriado que viajará exprofeso para la realización del estudio. Este proyecto cuenta además con el apoyo económico y científico de la dirección del Proyecto especial para la eliminación de las ETD (ESPEN) de la OMS. La evaluación del proyecto será llevada a cabo por un comité en el que participarán expertos de estos tres organismos (MINSABS, ISCIII y ESPEN).
Vinculación de las autoridades públicas y comunitarias a nivel local en el proyecto.
Las autoridades públicas y comunitarias de los 13 distritos de los que se compone Guinea Ecuatorial continental serán informadas de la realización de este proyecto una vez sea aprobado por los financiadores. Será necesario contar con la aprobación expresa de dichas autoridades para poder realizarlo, y su involucración en el trabajo de campo será esencial para el éxito del proyecto. Al figurar dicha acción dentro del plan estratégico del Programa Nacional de lucha contra la Oncocercosis y otras Filariasis, la participación local será notificada en tiempo por la Delegación de Salud de la Región continental, lugar donde se realizarán las acciones. El incentivo de dicha participación será la ganancia en salud de la población local que emane de las recomendaciones de los resultados de nuestro proyecto.
Explicar las perspectivas de sostenibilidad.
– Sostenibilidad política, económica, sociocultural y técnica del proyecto una vez finalizada la ejecución. ¿Existe una estrategia de salida de la ONGD al finalizar el proyecto?
El proyecto forma parte del marco estratégico del Ministerio de Sanidad y Bienestar Social de Guinea Ecuatorial y encomendado como objetivo del Programa Nacional de Lucha contra la Oncocercosis y otras Filariosis.
Por otro lado, el Instituto de Salud Carlos III es un organismo autónomo público español que presta apoyo científico-técnico al Sistema Nacional de Salud y a terceros países a través de distintas encomiendas y proyectos. Este hecho garantiza estabilidad, como pone de manifiesto los más de veinte años de colaboración entre el MINSABS y el ISCIII. Por este motivo, el presente proyecto es sostenible desde todos los puntos de vista, ya que nuestra presencia en el país no finaliza con el proyecto.
– Posibilidades de replicación y de extensión de los resultados de esta acción a otras zonas del país o región.
Con el presente proyecto pretendemos cubrir la zona continental, que es la más habitada y la única en la que aún no se han realizado estudios de prevalencia bien diseñados y representativos de oncocercosis, loiasis y FL. Los resultados no podrán ser replicables o extendidos a otras zonas del país (ya que el resto de zonas ya han sido cubiertas) pero si podrán servir de base para estudios que se realicen en países vecinos con un contexto epidemiológico similar. De hecho, el protocolo que se elabore se compartirá con ESPEN para que la OMS pueda extenderlo a otras regiones africanas. Esto es de especial relevancia sobre todo si consideramos que varias de las técnicas diagnósticas que proponemos son novedosas y no se han pilotado antes en el terreno.
Describir la experiencia y capacidad operativa de la entidad solicitante y el socio local.
– Describir brevemente la experiencia de la entidad solicitante en la gestión de proyectos de cooperación internacional.
El Instituto de Salud Carlos III (ISCIII) cuenta con una trayectoria de más de 20 años de investigación en ciencias de la vida y de la salud y prestación de servicios de referencia, además de ser el organismo gestor de la Acción Estratégica en Salud en el marco del Plan Nacional de I+D+I. Unido a esta actividad de investigación Biomédica y Servicios Científico-Técnicos en España, trabaja en proyectos internacionales de mejora de la salud de las poblaciones más vulnerables, a través de la generación del conocimiento, la formación y la investigación. La presencia en el ámbito de la cooperación internacional del ISCIII en Guinea Ecuatorial se remonta a la década de los 90, con el Proyecto de Ayuda al Control del Paludismo en la isla de Bioko (1991-2000). En el marco de este proyecto, se desarrollaron otras líneas de actuación en el ámbito de las infecciones parasitarias responsables de diarreas y el seguimiento epidémico de la infección por el VIH. En 2002 la AECID aprueba la propuesta presentada por el Centro Nacional de Medicina Tropical (CNMT/ISCIII) de un proyecto global de asistencia técnica a los Programas Nacionales de Control del Paludismo, Tripanosomiasis, VIH/SIDA, Tuberculosis y Lepra bajo el título de «Centro de Referencia para el Control de Endemias en Guinea Ecuatorial» (CRCE). Su objetivo era fortalecer al Sistema Nacional de Salud de Guinea Ecuatorial en la lucha y control de las enfermedades endémicas. En el año 2010 se produce un cambio de orientación de la estrategia de la Cooperación Española en Guinea Ecuatorial, centrándose en el desarrollo de las capacidades locales en el ámbito de la salud. A partir de aquí se desarrolla el proyecto como asistencia técnica, en sintonía con las necesidades y demanda del Ministerio de Sanidad y Bienestar Social de Guinea Ecuatorial (MINSABS). En la actualidad el ISCIII tiene una la encomienda de gestión financiada por la Agencia Española de Cooperación Internacional y Desarrollo (AECID) «Extensión del proyecto de mejora continua de la calidad asistencial y manejo clínico de enfermedades endémicas en las provincias de Litoral, Kie Ntem y Wele Nzás y Centro Sur, Guinea Ecuatorial», impulsado por el Gobierno de Guinea Ecuatorial y en sintonía con las necesidades y demanda del MINSABS y de las directrices de la cooperación española.
– Describir brevemente la experiencia del socio local en la gestión de proyectos de cooperación internacional, así como su experiencia en la gestión conjunta de proyectos con la entidad solicitante.
El MINSABS, como contraparte local del ISCIII en Guinea Ecuatorial es el responsable de la gestión local de todos los proyectos conjuntos realizados hasta la fecha. Además, el MINSABS, como máxima autoridad de salud en el país, recibe directamente fondos de otras entidades públicas (UNICEF, OMS, BM, entre otros) y privadas (Marathon Oil) y gestiona los proyectos derivados de dicha financiación. El Programa Nacional de Lucha contra la Oncocercosis y otras Filariosis (PNLOF) es el programa del MINSABS encomendado para realizar las actividades de prevención y control de estas patologías. Cuenta con el asesoramiento técnico del ISCIII y de la OMS-África para el desarrollo del objetivo de interrupción de la transmisión de estas enfermedades. El PNLOF lleva trabajando en la región insular y tiene experiencia desde el año 1989. Tienen experiencia en encuestas REMO, control vectorial y diagnóstico por skin snip así como diagnóstico microscópico y mediante test de diagnóstico rápido. Su acción en la región insular, mediante búsqueda activa, diagnóstico y tratamiento con ivermectina, junto al control vectorial con larvicidas en los cursos fluviales cortos y rápidos donde se desarrolla el vector, ha hecho que en la actualidad se haya interrumpido la transmisión de la oncocercosis en la isla de Bioko.
– ¿Participa la entidad solicitante o el socio local en redes de asociaciones de cooperación al desarrollo o similares? Indicar cuales.
El Centro Nacional de Medicina Tropical, Instituto de Salud Carlos III, coordina la Red de Investigación Cooperativa en Enfermedades Tropicales (www.ricet.es). Dentro de uno de sus Programas de Investigación, existe un work package (WP4) denominado «Enfoque operacional de prevención y control sobre las enfermedades tropicales desatendidas en los países en origen-Internacionalización con proyectos en países tropicales».
Las enfermedades tropicales desatendidas (NTDs) emergentes y reemergentes presentan serios desafíos asociados con su prevención y tratamiento, su expansión geográfica y su impacto negativo sobre el progreso económico y social de los países afectados. Además, estas enfermedades no sólo tienen un impacto en origen, en los países afectados, sino que su potencial para extenderse a otras regiones las hace relevantes en la globalización de las enfermedades que no respetan las fronteras geopolíticas.
Este WP4 está encaminado a la traslación del conocimiento a los países de origen con los que la RICET y sus grupos de investigación, tiene una relación de colaboración. De esta manera se desarrollan una serie de proyectos internacionales colaborativos en los países tropicales, origen de estas patologías, con el objetivo de facilitar la formación, prevención y control de las mismas mediante el uso y aplicación de las herramientas desarrolladas en el contexto de la red.
Los objetivos del WP4 de la RICET son:
– Intervención en enfermedades parasitarias (helmintiasis): proyectos de colaboración relacionados con la prevención y el control de strongiloides, geohelmintiasis, la oncocercosis, la esquistosomiasis y la fascioliasis en varios países.
– Intervención en enfermedades parasitarias (protozoos): proyectos de colaboración relacionados con la intervención en prevención y control de la tripanosomiasis humana africana (THA), la enfermedad de Chagas y otras protozoosis.
– Intervención sobre los vectores. Grupos de investigación de la RICET implementan acciones y estudios sobre los vectores responsables de la transmisión de las enfermedades tropicales desatendidas, como la oncocercosis, la esquistosomiasis y la fascioliasis.
– Estudios sobre el papel de los reservorios en la transmisión de las enfermedades tropicales desatendidas en los países de origen.
Por otro lado, el PNLOF de Guinea está incluido en la red africana coordinada desde ESPEN.
4. Diseño de la propuesta.
4.1 Análisis de la problemática: Árbol de problemas y soluciones.
Árbol de problemas
Árbol de soluciones
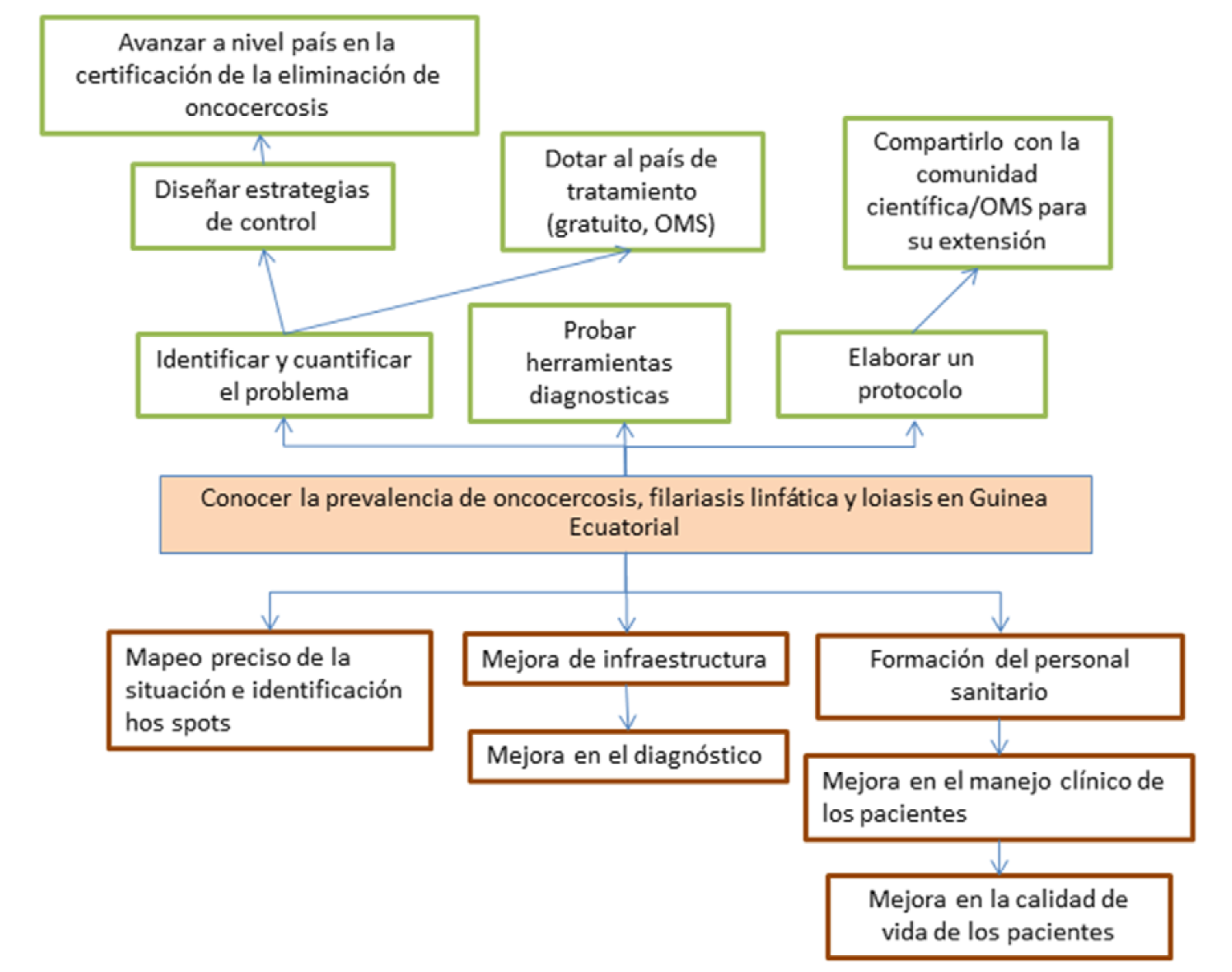
4.2 Descripción resumida de la acción: (NOTA: utilizar la plantilla de «Matriz de planificación del proyecto» adjunta).
|
Lógica de la intervención |
Indicadores objetivamente verificables |
Fuentes de Verificación |
Hipótesis |
|
|---|---|---|---|---|
|
OBJETIVO GENERAL. |
Mejorar la salud de la población ecuatoguineana que vive en la zona continental a través del diagnóstico y control de la oncocercosis, la filariasis linfática y la loiasis. |
– N.º de personas atendidas por estas enfermedades. – N.º de personas que reciben tratamiento. |
– Encuestas trabajo de campo. – Registros de AMM del MINSABS. |
|
|
OBJETIVOS ESPECÍFICOS. |
– Conocer si existe transmisión de oncocercosis en Guinea Ecuatorial continental para desarrollar recomendaciones nacionales para avanzar hacia la eliminación de la oncocercosis y el control de la FL / Loa a nivel nacional. – Evaluar la utilidad de test rápido Ov16 / FTS, marcadores serológicos, método de amplificación isotérmica mediada por bucle (LAMP) y Loa-PCR a tiempo real para la detección de oncocercosis y FL para guiar las decisiones del programa sobre el tratamiento y la vigilancia de estas enfermedades. |
– Prevalencia de oncocercosis, FL y loiasis en la zona continental y por distritos. – Guía de recomendaciones de AMM. – Sensibilidad y especificidad de TDR/FTS, serología, LAMP y Loa-PCR frente al gold standard. |
– Protocolo y POEs. – Encuestas trabajo de campo. – Resultados de laboratorio (Guinea Ecuatorial y España). – Registros de AMM del MINSABS. |
– Se mantiene el apoyo de las autoridades del MINSABS y OMS durante el proyecto. |
|
RESULTADOS ESPERADOS. |
1. Mejorada la salud de la población de Guinea Ecuatorial continental a través de tratamiento de estas enfermedades. 2. Fortalecido el sistema nacional de salud en técnicas diagnósticas y manejo clínico de estas enfermedades. |
1.1 Diagnosticados el 100% de la muestra. 1.2 Diseñada la campaña de AMM. 1.3 Tratados el 100% de los positivos. 2.1 Formado al menos el 50% del personal técnico del PNLOF. 2.2 Equipado el laboratorio con una LAMP y reactivos. |
– Protocolo y POEs. – Encuestas trabajo de campo. – Resultados de laboratorio (Guinea Ecuatorial y España). – Registros de AMM del MINSABS. |
– El personal de salud, autoridades y personal técnico de campo participan activamente en el proyecto. |
|
Insumos. |
Costes. |
– El personal de salud, autoridades y personal técnico de campo participan activamente en el proyecto. |
||
|
ACTIVIDADES. |
– Compra y transporte del material. – Preparación de protocolos y procedimientos operativos estándar (POEs). – Capacitación del personal local. – Trabajo de campo. – Análisis de datos y de laboratorio. – Elaboración del informe y de las recomendaciones. – Presentación de resultados. – Evaluación del proyecto. – Diseño de estrategias de control. |
(a financiar por PROBITAS). Máquina LAMP, test, reactivos y portatiles. |
49.936 |
|
|
Condiciones previas. El PNLOF cuenta con un staff con amplia experiencia en este tipo de estudio. La OMS dona gratuitamente el tratamiento. |
4.3 Cronograma.
Se solicita financiación a PROBITAS para la primera fase del proyecto (12 meses). La duración total del proyecto será de 18 meses.
|
ACTIVIDADES |
PERIODO FINANCIADO POR PROBITAS/OMS/ISCIII |
PERIODO FINANCIADO POR OMS/ISCIII |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
2019 |
2020 |
|||||||||||||||||
|
7 |
8 |
9 |
10 |
11 |
12 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
Compra y transporte del material. |
x |
x |
||||||||||||||||
|
Preparación de protocolos y procedimientos operativos estándar (POEs). |
x |
x |
||||||||||||||||
|
Formación del personal local que formará parte de los equipos de trabajo. |
x |
x |
||||||||||||||||
|
Trabajo de campo (realización de encuestas, recogida de muestras, análisis en terreno). |
x |
x |
x |
x |
||||||||||||||
|
Presentación del primer informe de seguimiento a Probitas. |
x |
|||||||||||||||||
|
1.º Evaluación del proyecto. |
x |
|||||||||||||||||
|
Análisis de datos y análisis de laboratorio. |
x |
x |
x |
x |
x |
x |
x |
|||||||||||
|
Elaboración de informe y de las recomendaciones para el MINSABS. |
x |
x |
||||||||||||||||
|
Presentación del segundo informe de seguimiento a Probitas (informe final) |
x |
|||||||||||||||||
|
Presentación de resultados. |
x |
x |
||||||||||||||||
|
2.º Evaluación del proyecto. |
x |
x |
||||||||||||||||
|
Diseño de las estrategias de control. |
x |
x |
||||||||||||||||
|
Comunicación científica de resultados (articulos, congresos). |
x |
x |
||||||||||||||||
4.4 Presupuesto global del proyecto:
|
PARTIDAS |
CONTRIBUCIONES EXTERNAS EN EFECTIVO (cash) |
CONTRIBUCIONES LOCALES Y VALORIZACIÓN |
Coste total |
||||||
|---|---|---|---|---|---|---|---|---|---|
|
Probitas Fundación Privada |
ONG |
Otros |
Total |
ONG |
Otros |
Local |
Total |
||
|
COSTES DIRECTOS. |
|||||||||
|
A.I. Gastos de identificación y formulación. |
Partida sin subvención. |
3.183 |
|||||||
|
A.II. Terrenos e inmuebles. |
Partida sin subvención. |
||||||||
|
A.III. Construcción/rehabilitación. |
|||||||||
|
A.IV. Equipos y suministros. |
45.397 |
37.891 |
37.891 |
||||||
|
A.V. Personal local (máx. 20% del total solicitado). |
36.216 |
36.216 |
|||||||
|
A.VI. Personal expatriado. |
Partida sin subvención. |
8.984 |
8.984 |
34.980 |
34.980 |
||||
|
A.VII. Fondo rotatorio. |
Partida sin subvención. |
||||||||
|
A.VIII. Funcionamiento. |
15.064 |
15.064 |
|||||||
|
A.IX. Viajes y estancias. |
Partida sin subvención. |
21.924 |
21.924 |
||||||
|
A.X. Imprevistos. |
Partida sin subvención. |
10.000 |
10.000 |
||||||
|
A.XI. Evaluación final externa (máx 6% del importe solicitado). |
6.000 |
6.000 |
|||||||
|
A.XII. Auditoría. |
|||||||||
|
TOTAL COSTES DIRECTOS. |
45.397 |
123.262 |
123.262 |
50.980 |
50.980 |
219.639 |
|||
|
Porcentaje sobre el total. |
21 |
56 |
56 |
23 |
23 |
100 |
|||
|
TOTAL COSTES INDIRECTOS (máx. 10% importe solicitado). |
4.540 |
12.326 |
12.326 |
5.098 |
5.098 |
21.964 |
|||
|
Porcentaje sobre el total. |
21 |
56 |
56 |
23 |
23 |
100 |
|||
|
TOTAL EUROS. |
49.936 |
135.588 |
135.588 |
56.078 |
56.078 |
241.602 |
|||
4.5 Seguimiento y monitorización del proyecto:
El proyecto plantea desde el inicio un enfoque de trabajo coordinado y colaboración constante con el MINSABS para su plena implicación.
Instrumentos:
– Se realizará un informe semestral y un informe final de seguimiento y cierre de proyecto respectivamente. Responsables: Director del PNLOF con el apoyo del Coordinador local del ISCIII, ambos se coordinarán en terreno para facilitar el seguimiento.
– Acta de las reuniones de coordinación mantenidas. Responsable: Coordinador local del ISCIII. En las reuniones podrán participar otros posibles actores relevantes en la implementación del proyecto (OMS).
– Documento de donación del material al MINSABS. Responsable: Coordinador local del ISCIII.
– Informe de evaluación.
Metodología: Se designarán dos personas responsables del desarrollo del proyecto. Una persona en Guinea (Coordinador local del ISCIII) y otra en Madrid (investigadora del CNMT-ISCIII), que acordaran el procedimiento de seguimiento para la realización de las actividades.
4.6 Aspectos relevantes y comentarios acerca del proyecto no reflejados con anterioridad:
La financiación solicitada a la fundación Probitas será clave para la transferencia de conocimientos y de material de laboratorio al socio local. En la siguiente tabla se desglosa dicha financiación:
|
INSTRUMENTO |
UNID |
PRECIO UNIDAD |
PRECIO + 21% IVA |
PRECIO TOTAL |
|
|---|---|---|---|---|---|
|
Maquina LAMP |
2 |
9.822,86 |
11.885,6606 |
23.771,3212 |
|
|
Test LAMP |
tubos genie |
1 |
453,72 |
549,0012 |
549,0012 |
|
maletin transporte |
2 |
324,09 |
392,1489 |
784,2978 |
|
|
cebadores |
2 |
130,4843 |
165,17 |
330,34 |
|
|
betaina |
1 |
243,32 |
308 |
308 |
|
|
Bst polimerasa 2.0 |
5 |
69,49 |
84,0829 |
420,4145 |
|
|
dNTPs mix |
6 |
35 |
42,35 |
254,1 |
|
|
Evagreen |
1 |
176,846 |
213,98366 |
213,98366 |
|
|
Qiaxcell DNA screening gel cartridge |
3 |
867,5 |
1.050 |
3.150 |
|
|
RT-PCR Kit (500 reacciones) |
40 |
225 |
272,25 |
10.890 |
|
|
Pol 1 UI/ul SB 1000 |
10 |
100 |
121 |
1.210 |
|
|
DNA ladder 50 |
5 |
60 |
72,6 |
363 |
|
|
Tubos PCR 0,2 ml |
8 |
23,21 |
28,1 |
224,8 |
|
|
Eppendorf tapa plana 1,7 ml (500 tubos) |
8 |
7,99 |
9,67 |
77,36 |
|
|
Portátil. Lenovo Legion Y520 Intel Core i7 |
3 |
750,5 |
950 |
2.850 |
|
|
TOTAL COSTES DIRECTOS |
45.396,62 |
||||
|
COSTES INDIRECTOS (10%) |
4.539,662 |
||||
|
TOTAL |
49.936,282 |
||||
Además, la adquisición de estos materiales no solo permitirá la mejora en el diagnóstico de estas enfermedades, sino que servirá de base para la elaboración de un protocolo de estudio que pueda ser extrapolable a otros países vecinos con una situación epidemiológica similar. Si no se consiguiera la financiación por parte de la fundación Probitas, el estudio podrá ser llevado a cabo pero sin cubrir algunos de los objetivos clave, concretamente la evaluación del método de amplificación isotérmica mediada por bucle (LAMP) y de la PCR panfilaria a tiempo real para la detección de oncocercosis y FL para guiar las decisiones del programa sobre el tratamiento y la vigilancia de estas enfermedades.
5. Documentación adjunta: (incluidos en este formulario).
– 1: Matriz de marco lógico.
– 2: Presupuesto detallado por partidas y financiadores previstos.
Nota: Se pueden utilizar las plantillas que se adjuntan como modelos o bien emplear aquellas que considere la entidad siempre que se trate de un formato similar.
6. Listado de anexos al proyecto: mapas, fotos, documentación, etc.
Se anexa:
Anexo 1. Comunidades centinelas con al menos un participante positivo según REMO 2008-2013, en Guinea Ecuatorial continental.
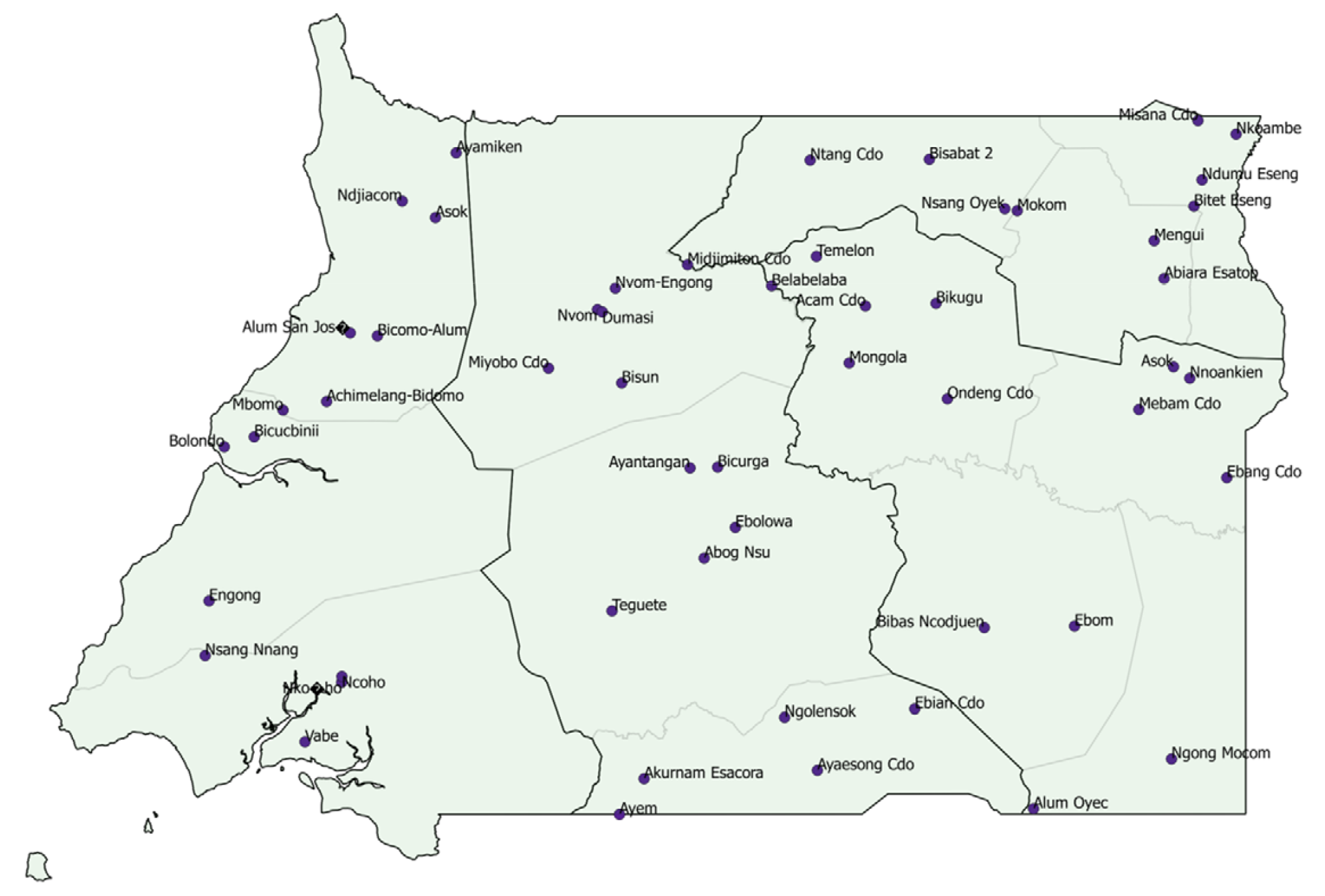
Fuente: El mapa ha sido elaborado a partir de los datos proporcionados por la OMS.
Anexo 2. Protocolo inicial del proyecto (adjunto).
Anexo 3. Encomienda de Gestión ISCIII-FCSAI-MINSABS (adjunto).
Anexo 4. Carta de MINSABS a OMS solicitando la financiación para el proyecto (adjunto).
Anexo 5. V Plan Director de la Cooperación Española (adjunto).
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid